高浓度Na+//NO-3,SO2-4 -H2O溶液的膜蒸馏结晶耦合过程调控
孙国鑫,苟萌萱,周诚,常佩,贺高红,姜晓滨
(1 大连理工大学化工学院,精细 化工国家重点实验室,辽宁 省石化行业高效节能分离技术工程实验室,辽宁大连 116024; 2 西安近代化学研究所,陕西 西安 710065)
引 言
煤化工、含能材料等重要工业流程中产生的大量高浓度Na+//NO-3, SO2-4-H2O 废水,若采用传统方法处理,治理成本高且分离效率低,对溶解在其中的固体盐晶体性质难以控制[1]。如果对该高浓复合盐水不加以处理而直接排放,不仅会造成严重的环境污染,而且会造成巨大的资源浪费[2-3]。因此,对于富含硝酸盐、硫酸盐的高浓废水的综合处理和回收利用具有重要意义。
如图1 所示,典型的盐水处理系统包含三个阶段,分别是预浓缩、蒸发和结晶[3-4]。在第一阶段预浓缩过程中,主要实现水的回收和盐水体积的浓缩和最小化。该阶段可以显著减少接下来两个阶段的处理量和综合能耗[5-6]。在第二阶段蒸发过程中,主要通过膜蒸馏[6-7]、多级闪蒸[8]、多效蒸发[9]等过程实现高浓度盐水的进一步蒸发浓缩。在第三阶段结晶过程中,主要通过膜结晶[10]、传统蒸发结晶[11]、冷冻结晶[12-13]等过程实现晶体产品的回收[14]。

图1 复合盐水处理技术框架图Fig.1 Framework of brine treatment technology
随着膜分离技术的发展,膜蒸馏(MD)现已发展成为一个处理高浓度盐水的新研究方向[7,15]。与反渗透(RO)等典型膜分离技术相比,MD 的优势在于可以使用低等级废热在低操作压力下处理高浓度的盐水溶液[16]。由于MD 的驱动力是热进料流和冷渗透流之间的跨膜压差,在MD 工艺中浓度极化对传质的影响并不显著,使得MD 对近饱和态的盐水适用性更强。此外,非挥发性盐分溶液可以被近100%的截留,从而保障产生高质量、高纯度的渗透水[17]。因此,MD是一种既可以实现预浓缩阶段的处理,还可以实现蒸发阶段处理的理想操作技术。研究者将MD 和膜结晶过程耦合,研发膜蒸馏结晶(MDC)过程可以实现高盐度溶液的深度处理[18-19]。
同时,结晶过程的核心问题是晶体成核和生长的控制,这决定了晶体产品分离的难易程度以及诸多产品特性[20]。许多研究表明,MDC 有利于制备出晶体尺寸分布较集中的晶体产品[21],对于调控晶体外部形貌、流动性也有积极作用[22]。MDC 过程所用的疏水微孔膜既是溶剂汽化浓缩溶液的传质界面,也是溶质实现非均相成核的重要活性表面[23-25]。因此,MDC 具有实现高浓度Na+//NO-3, SO2-4-H2O 废水处理的重要应用潜力。目前,针对高浓度复合盐水体系,特别是硝酸盐及硫酸盐体系的膜蒸馏结晶操作过程研究较少,缺乏对其调控方法和耦合分离控制区间设计的研究。因此探究高浓度Na+//NO-3,SO2-4-H2O 溶液的膜蒸馏结晶耦合过程调控具有实际意义。
本研究首先对Na+//NO-3, SO2-4-H2O 体系的相平衡进行分析和理论计算,以此探究该体系的结晶路线以及适宜的操作温度、理论最大收率、分质结晶过程中不同盐分切割点等关键参数。其次,对减压蒸发结晶、膜蒸馏结晶及二者的耦合等三种操作模式,分别通过对Na+//NO-3, SO2-4-H2O 溶液体系处理实验进行对比。同时,基于实验结果,以高纯度、高收率为目标对膜蒸馏结晶耦合过程的工艺进行探究,主要侧重于提升收率、优化晶体产品形貌、提高晶体产品纯度,并为开发可实际应用的膜蒸馏结晶技术提供基础。
1 实验材料和方法
1.1 试剂及材料
本实验采用的试剂和膜材料如表1 和表2所示。

表1 实验药品与试剂Table 1 Drugs and reagents used in the experiment

表2 中空纤维膜材料的结构参数Table 2 Membrane structure parameters of hollow fiber membrane
1.2 实验装置及仪器
本实验采用的实验仪器如表3所示。

表3 实验中使用的仪器Table 3 Apparatus used during the experiment
本实验采用的减压蒸发结晶装置如图2 所示,真空膜蒸馏结晶装置如图3所示。

图2 减压蒸发结晶装置示意图Fig.2 Schematic diagram of the experimental device for vacuum evaporative crystallization
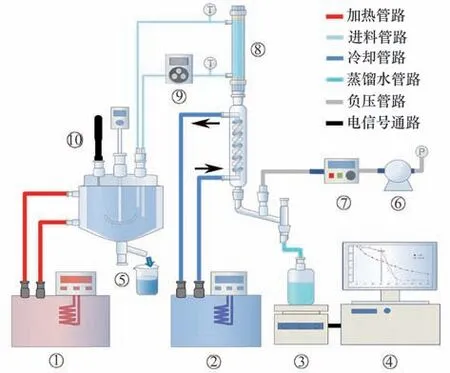
图3 真空膜蒸馏结晶装置示意图Fig.3 Schematic diagram of the experimental device for vacuum membrane distillation crystallization
1.3 实验部分
1.3.1 实验过程
(1)复合盐溶液的配制。首先根据实际废水成分配制实验所需的特定模拟盐水溶液。其中硫酸钠质量分数为13.6%±0.1%,硝酸钠质量分数为18.2%±0.1%。具体配制过程如下:将60 g 硫酸钠和80 g硝酸钠加入300 g去离子水中搅拌至完全溶解。将溶解后的盐溶液倒入结晶釜中搅拌并通过水浴加热升温至95℃。
(2)减压蒸发结晶实验。待配制的特定盐溶液温度稳定后,开启真空泵。随着溶液不断浓缩,溶液体系性质发生变化,为使运行过程中的体系温度稳定在80℃±0.5℃,通过真空控制器实时调节系统真空度,以调整溶液的蒸发强度,稳定体系温度。待体系蒸发水量达到预定水量后,关闭真空泵。调节水浴温度使体系温度稳定在80℃±0.5℃,设置2 h的养晶停留时间。养晶结束后对晶体产品进行过滤、干燥、称重及后续相关表征。
(3)膜蒸馏结晶实验。待配制的特定盐溶液温度稳定后,开启蠕动泵,使特定盐溶液充满管路和膜组件。调节水浴温度使体系温度稳定后开启真空泵。用真空控制器实时调节系统真空度,使体系温度稳定在80℃±0.5℃。用SPDC Data Collection V2.01 软件实时记录天平示数变化,对膜的渗透通量进行实时监控。待体系蒸发水量达到预定水量后关闭真空泵,反转蠕动泵将管路及膜组件中的结晶母液回流至结晶釜中。调节水浴温度使体系温度稳定在80℃±0.5℃,设置2 h 的养晶停留时间。养晶结束后对产品进行过滤、干燥、称重及后续相关表征和数据处理。
(4)膜蒸馏结晶耦合减压蒸发结晶实验。该耦合过程首先进行的是膜蒸馏结晶过程。根据实验得出最佳耦合区间,在最佳耦合区间内进行过程耦合。待蒸发水量进入最佳耦合区间后,在膜蒸馏结晶实验装置(图3)的基础上移除膜组件、蠕动泵,调整相应管路将实验装置调整为减压蒸发结晶装置(图2),并继续进行减压蒸发结晶。
1.3.2 分析与表征 用IC(DIONEX ICS-5000,美国)测试产品纯度(将样品用去离子水稀释1000 倍后,通过离子色谱测定稀溶液中硫酸根及硝酸根的含量);用场发射扫描电子显微镜(NOVA Nano SEM 450,美国)表征晶体表面形貌;用光学显微镜(Motic AE31,厦门)表征晶体形貌;用X 射线衍射仪(SmartLab 9 kw,日本)进行晶体鉴定分析。
2 实验结果与讨论
2.1 Na+//NO-3,SO24 --H2O 三元体系相图分析及理论计算
如图4 所示,此三元体系在40℃[313.15 K,图4(a)][26]及60℃[333.15 K,图4(b)][27]时,存在复盐NaNO3·Na2SO4·H2O 的结晶区,这一区域内将难以得到高纯的硝酸盐或硫酸盐。当温度升高至80℃[353.15 K,图4(c)][28]时,复盐的结晶区消失。因此,为避免硫酸钠结晶过程受硝酸钠晶体析出的影响,保证硫酸钠结晶的纯度,选择80℃±0.5℃为结晶过程的控制操作温度。

图4 Na+//NO-3,SO2-4 -H2O 三元体系相图Fig.4 Phase diagram of the ternary system Na+//NO-3,SO2-4 -H2O
如图5所示,通过溶解度数据,绘制353.15 K 三元体系Na+//NO-3,SO2-4-H2O 的稳定相图,并在此基础上绘制蒸发结晶操作线WQ,其中M点为原料液操作点,线段WQ与曲线A′E交于点N,与线段AE交于点P,随着溶液的不断浓缩,M点沿线段WQ向Q点运动,当M点运动至N点,表明溶液达到饱和,当M点运动至P点,此时Na2SO4达到最大收率。

图5 353.15 K 三元体系Na+//NO-3,SO2-4 -H2O相图Fig.5 Phase diagram of the ternary system Na+//NO-3,SO2-4 -H2O at 353.15 K
温度为353.15 K 的三元体系Na+//NO-3, SO2-4-H2O 稳定相图数据如表4所示。

表4 353.15 K 三元体系Na+//NO-3,SO2-4 -H2O 稳定相图数据Table 4 Stable phase diagram data of the ternary system Na+//NO-3,SO2-4 -H2O at 353.15 K
复合盐水溶液初始配比mNa2SO4:mNaNO3:mH2O=60 g:80 g:300 g;Q点的固相组成为mNa2SO4:mNaNO3=60 g:80 g;通过理论计算可知Na2SO4的最大理论收率为95.871%。
温度为313.15 K 的三元体系Na+//NO-3,SO2-4-H2O稳定相图数据如表5所示。

表5 313.15 K 三元体系Na+//NO-3,SO2-4 -H2O 稳定相图数据Table 5 Stable phase diagram data of the ternary system Na+//NO-3,SO2-4 -H2O at 313.15 K
蒸发结晶终点得到的母液可以通过冷却结晶的方法对NaNO3产品进行回收,使用313.15 K 的溶解度数据进行近似理论计算。如图6的局部放大图所示,E1点距离线段B-P3很近,在近似计算中可将E1点近似看作线段B-P3上一点,因此E1点处可以获得313.15 K 下NaNO3的最大收率。通过理论计算可知Na2NO3的最大理论收率为29.756%。
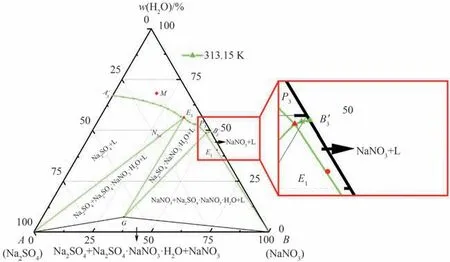
图6 313.15 K 三元体系Na+//NO-3,SO2-4 -H2O 相图Fig.6 Phase diagram of the ternary system Na+//NO-3,SO2-4 -H2O at 313.15 K
2.2 减压蒸发结晶过程分析
在80℃±0.5℃的温度条件下,直接进行减压蒸发结晶实验,对减压蒸发结晶过程得到的晶体进行分析。从图7中可以看出减压蒸发结晶产品中出现大量“空心晶体”,纯度为94.060%(质量分数)。由于均相成核过程成核能垒高,因此均相成核过程需要提供更大的过饱和度作为推动力。在较大的过饱和度下,溶液会发生爆发成核现象,即在较短的时间内产生大量晶核,无法及时扩散的大量晶核极易造成晶核聚集,聚集后的晶核从自由能最小的晶面开始向中心生长。同时在爆发成核过程中消耗了大部分的过饱和度,进而导致晶体不能生长完全,形成大量的“空心晶体”。如图8 所示,根据Zhou[29]的研究,晶体生长遵循的经典路径是步骤1、2、3。但是,如果由于主体溶液的过饱和度过大、化学结构单元之间强烈的范德华力相互作用会使晶体在变大之前发生聚集,单个晶体无法得到充分生长,形成一些无序的多晶(步骤4)或无定形球形颗粒(步骤5 和6),然后进行表面结晶(步骤7 和8)。当对表面结晶进行热力学控制时,薄的晶体表面可形成单晶多面体形态,从而使整个颗粒的表面自由能最小,然后结晶从表面延伸到核心。因此,当聚集作用占据晶体生长的早期阶段时,溶液中自由晶体的生长环境就会受到干扰。晶核聚集后的表面成为最活跃的结晶部位,从而产生相反方向生长的晶体[30]。这种反向生长的空心晶体在传统的结晶过程中时有发生,严重影响晶体形貌,造成母液包藏等现象。这也是传统蒸发结晶难以直接制备高品质晶体的主要原因。

图7 减压蒸发结晶产品扫描电镜图Fig.7 SEM images of vacuum evaporation crystallization product

图8 经典(第1~3步)和新提出的反向晶体生长路线(第4~10步)的示意图Fig.8 Schematic of classic(steps 1—3)and newly proposed reversed crystal growth routes(steps 4—10)
2.3 膜蒸馏结晶过程分析
图9 和图10 分别表示了不同装填密度下膜组件的蒸发量及渗透通量随时间的变化情况。由图可以看出在膜组件尺寸一定的情况下,随着中空纤维膜组件中膜丝数目的增加,膜组件装填密度升高,膜的渗透通量减小。基于膜蒸馏过程的特点及膜组件的特性进行分析,虽然在一定范围内随着膜面积的增加,膜孔数目也随之增加,在同样的空间内有了更多的供气体水分子通过的“通道”。但是大量膜丝存在的情况下,会使得膜组件内流场发生变化,死区逐渐增多,影响膜的传质传热,加剧浓度及温度极化现象,导致通量下降。因此,对于膜蒸馏结晶过程,实际使用的膜组件有较优的装填密度区间。综合分析,本文后续实验中选择装填密度为227.0 m2/m3的膜组件用于膜蒸馏结晶耦合减压蒸发结晶分离高浓度Na+//NO-3,SO2-4-H2O溶液体系。
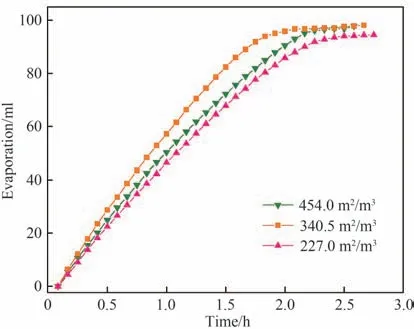
图9 不同膜组件装填密度下蒸发量随时间变化趋势Fig.9 Change of evaporation with time under different membrane module package density

图10 不同膜组件装填密度下渗透通量随时间变化趋势Fig.10 Change of permeate flux with time under different membrane module package density
随机选取通过膜蒸馏结晶实验得到的硫酸钠晶体光学显微镜图及扫描电镜图分别如图11 和图12 所示,Na2SO4晶体形态完整,没有中空结构。从图12(a)和图12(b)可以看出在膜蒸馏结晶操作的调控下,晶体生长过程遵循经典成核生长方式(图8中第1~3 步),这与减压蒸发结晶(VEC)过程得到的空心晶体(图7)形成鲜明对比。由此亦可体现出膜蒸馏结晶技术在晶体成核、生长过程温和可控的优势。

图11 膜蒸馏结晶产品光学显微镜图Fig.11 Optical microscope images of membrane distillation crystallization products

图12 膜蒸馏结晶产品扫描电镜图Fig.12 SEM images of membrane distillation crystallization products
由图13 可以看出在晶体表面分布的优势元素是Na、O、S 三种元素,整体晶体纯度较高。晶体表面分布着少量的N 元素,是由于过滤过程中Na2SO4晶体表面不可避免地存在少量的母液残留,由后续干燥过程中母液中的NaNO3晶体析出造成的。
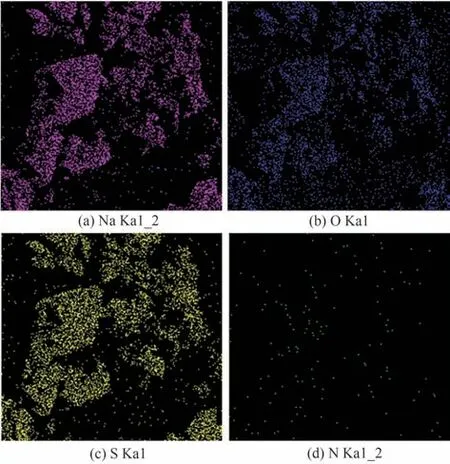
图13 膜蒸馏结晶产品表面元素分析Fig.13 Elemental mapping of membrane distillation crystallization products surface
如图14 所示,从XRD 谱图分析中可以看出,四个样品的峰值互相吻合度较高。通过对不同膜面积样品的XRD 谱图进行jade 6 软件分析发现,四个样品的谱图与数据库中pdf 卡号为74-1738 的Na2SO4晶体标准卡片的谱图吻合度较高,样品对比后的FOM 值均在10 以内。由此,可以定性得出回收的晶体为硫酸钠且得到的硫酸钠晶体晶型与标准晶型相符。为定量分析MDC产品纯度,对其进行了离子色谱分析。

图14 不同膜组件装填密度下得到的样品与标准样品XRD谱图Fig.14 XRD patterns of samples and standard samples obtained under different membrane package density
本文开展7组膜蒸馏结晶平行实验得到的硫酸钠产品纯度(离子色谱测定)如表6 所示,平均值达到96.770%。

表6 膜蒸馏结晶产品纯度Table 6 Purity of membrane distillation crystallization products
2.4 膜蒸馏结晶-减压蒸发结晶耦合过程分析
膜蒸馏结晶在高浓缩率、高晶体含量下有发生膜污染和膜浸润的风险。因此,为保障连续高效操作,本文提出研究膜蒸馏结晶-减压蒸发结晶耦合过程。首要内容是确定膜蒸馏和减压蒸发各自的溶剂蒸发比例。如图15 所示,对于膜蒸馏过程,膜通量变化曲线通常出现两个拐点,将曲线分为三段。根据实验结果,总结数据信息得到了膜通量随时间阶段性变化的示意图。图15 中的拐点A和拐点B将整个曲线分为了斜率不一的三段曲线。

图15 膜蒸馏过程的典型膜通量(a)和阶段性变化原理示意图(b)Fig.15 Schematic diagram of typical membrane flux(a)and step-by-step change principle of membrane distillation process(b)
在第一阶段,由于配制的初始溶液已经是近饱和的溶液,同时随着溶液体系的不断浓缩,体系浓度不断升高,溶液性质发生变化,导致膜通量出现下降[31]。第二阶段,晶体在膜表面开始异相成核,晶体在膜表面脱附的标准曲线首先随着晶体尺寸的增加而上升,然后急剧下降。此理论在之前的研究中已经得到验证,分别受晶体粒径大小、膜表面粗糙度以及进料条件(黏度等)的影响,有两种不同的晶体运动可能性:脱附和黏附[32]。随着晶核的产生并短暂附着在膜表面上,导致膜通量的衰减。第三阶段,膜表面开始出现不可脱附性的晶体,也就是膜表面有晶体引起的结垢,从而导致大量膜孔被堵塞,膜通量急剧下降,此阶段易造成膜的不可修复性损伤,因为膜表面不可脱附性的结垢会破坏膜表面的疏水结构,进而降低疏水膜的透水压力,导致膜孔润湿,致使膜失去分离性能。
综合分析膜通量变化的三个阶段,优选两个拐点之间的第二阶段作为MDC 耦合VEC 的理想区间。首先第二阶段晶体在膜表面异相成核、生长、脱附机制可以实现结晶过程的调控,实现粒径均一的晶种添加过程,有效规避由于均相成核过程爆发成核导致的空心晶体等不可控现象,得到形貌规整、表面无缺陷的高质量晶体产品。同时由于晶体在膜表面“异相成核、生长、脱附”机制可以有效避免膜表面的不可脱附性的结垢现象,保护膜表面的疏水结构,实现膜的重复利用。
基于膜通量衰减三段式理论,优选第二阶段作为MDC-VEC 的耦合区间,并以此为基础进行MDC-VEC 耦合过程多次重复实验探究。图16 为MDC-VEC 耦合过程四次平行实验的蒸发量变化趋势图。图17 是MDC-VEC 耦合过程四次平行实验的膜通量(蒸发强度)变化趋势图。图16 及图17 中折点之前左边部分为膜蒸馏结晶,折点之后右边部分为减压蒸发结晶。由此可以说明根据膜通量衰减三段式理论开发的MDC-VEC 耦合过程具有现实可行性,同时可以实现高浓度Na+//NO-3, SO2-4-H2O溶液的高效处理,具有可重复性。
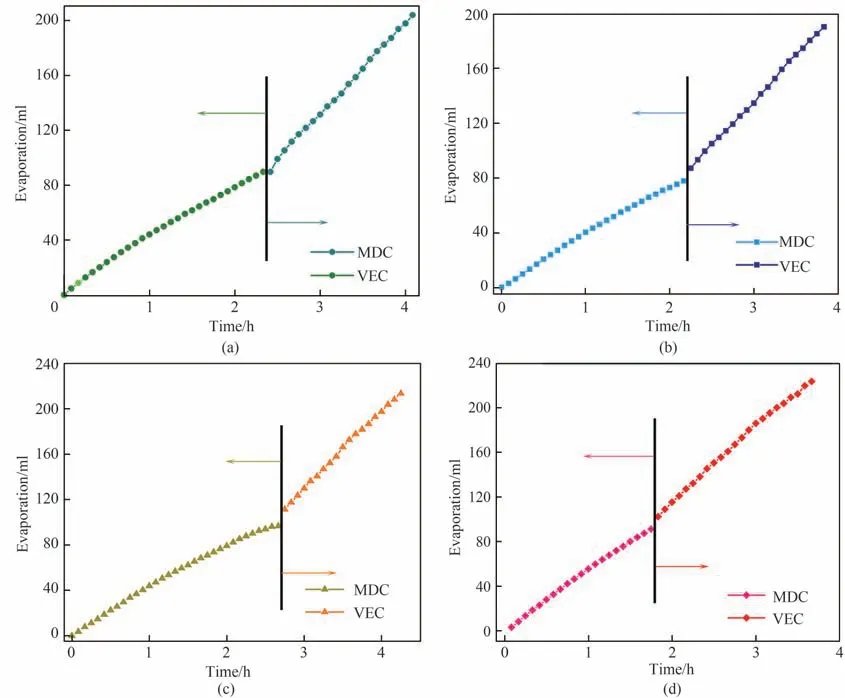
图16 MDC-VEC耦合过程蒸发量变化趋势Fig.16 Evaporation of MDC-VEC coupling process
实验结果表明,通过优化膜蒸馏操作区间和减压蒸发结晶耦合,获得的晶体产品质量同样较好。图18的表面元素分析中,在样品晶体表面分布的元素是Na、S、O、N 四种,其中Na、S、O 三种元素占据绝对优势。说明在样品中,由这三种元素构成的物质在样品中占比较大。结合表7 可以发现,MDC 过程处理该复合盐水体系得到的晶体纯度一般在95.000%左右,与理论计算过程得到的纯度95.871%较为接近。MDC-VEC耦合过程相较于MDC单一操作得到的产物纯度存在一定程度降低。其原因是在VEC 过程后期,由于搅拌不充分及蒸发水量较多等原因,溶液飞溅至反应釜内壁上从而出现了部分板结,在蒸发至预定水量后收集产物时,板结的晶体混入产物当中,导致晶体纯度降低。
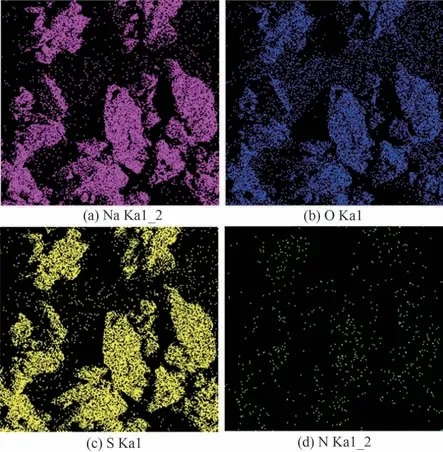
图18 MDC-VEC耦合过程产品晶体表面元素分布Fig.18 Elemental mapping of MDC-VEC coupling process products surface
MDC-VEC 耦合过程处理复合高盐水得到的硫酸钠产品收率主要与总蒸发量有关,膜蒸馏与减压蒸发的总蒸发量在70%~77%之间时,硫酸钠组分回收率在75%~80%之间。膜蒸馏阶段为后续的减压蒸发结晶提供了足够的晶种使其可以在较低过饱和度下结晶,减压蒸发结束后2 h 的停留时间为晶体的生长提供了充裕的时间。因此膜蒸馏-减压蒸发结晶耦合能够较大程度分离复合盐水,定向制备高品质的无机盐结晶。通过一系列膜蒸馏结晶耦合减压蒸发结晶实验得到的硫酸钠产品收率、纯度及母液蒸发量数据如表7所示,晶体纯度较理想,为下一步开展相关盐水体系的规模化研究提供了重要支撑。
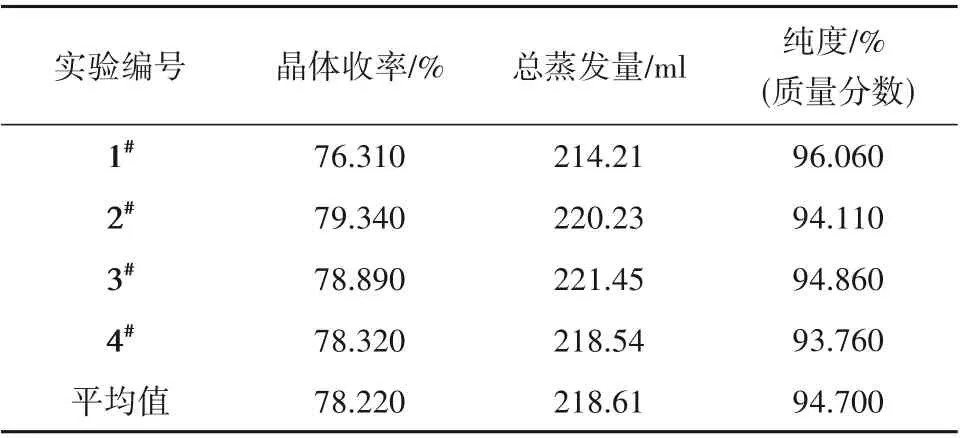
表7 MDC-VEC耦合过程晶体收率、总蒸发量及纯度Table 7 Crystal yield,total evaporation and purity during MDC-VEC coupling process
3 结 论
本研究以Na+//NO-3, SO2-4-H2O 体系为例,分别通过减压蒸发结晶过程、膜蒸馏结晶过程以及膜蒸馏结晶耦合过程对高浓度复合无机盐水的处理进行了探究,通过引入膜蒸馏结晶技术将目标盐分的成核机制转变为非均相成核,成核能垒有效降低,避免了典型蒸发结晶过程受扩散限制和局部浓度过高影响,偏离经典成核生长路线的问题,有效防止爆发成核造成的空心晶体,提升了结晶过程的制备纯度和效率。
通过大量实验和理论探究提出了膜通量衰减的三段式理论,明确了膜通量衰减第一阶段是由溶液体系性质变化导致的,第二阶段是由晶体在膜表面成核及自动脱附导致的,第三阶段是由膜表面晶体聚集并难以自动脱附导致的。进而依据得到的膜通量衰减三段式理论,得出了膜蒸馏结晶过程与减压蒸发结晶过程的最优耦合区间,通过实验证明膜蒸馏结晶耦合过程制备的硫酸钠晶体收率达到78.000%以上,纯度达到94.000%以上,为高浓度复合无机盐水的高效处理提供了新的思路。同时,规模化连续生产过程的稳态操作条件及参数仍然需要进一步探索,从而实现进一步扩大产能,提升产品纯度,降低综合能耗。未来的研究中,更高通量的疏水微孔蒸馏膜与本文研究得到的膜蒸馏优化操作区间相结合,有望在复合盐水体系的水分回收和晶体资源利用领域取得更好的效果。

