21日龄仔猪断奶过程不同肠段细胞外基质重要蛋白表达规律的研究
唐青松 王 丽 徐 娥 刘春艳 肖明飞 肖 昊 吴绮雯 蒋宗勇 易宏波*
(1.广东省农业科学院动物科学研究所,畜禽育种国家重点实验室,农业农村部华南动物营养与饲料重点实验室,岭南现代农业科学与技术广东省实验室茂名分中心,广东省畜禽育种与营养研究重点实验室,广州 510640;2.贵州大学动物科学学院,动物营养与饲料研究所,贵阳 550025)
仔猪早期断奶易引起肠道功能受损和生长迟缓,肠道健康问题导致的断奶后仔猪死亡率为6%~10%,有时甚至高达20%[1]。过去数十年,科学研究者们对肠道功能的研究主要聚焦于肠黏膜上层(上皮细胞、紧密连接蛋白、黏液素、分泌型免疫球蛋白和抗菌肽等),然而对肠道黏膜下层细胞外基质(extracellular matrix,ECM)的变化知之甚少。ECM主要由胶原蛋白(collagen)、纤维黏连蛋白(fibronectin,FN)、层黏连蛋白(laminin)、肌腱蛋白(tenascin,TN)以及蛋白聚糖/氨基聚糖等组成[2]。其中,胶原蛋白分子通过1/4的错位排布构成纤维状结构,与ECM分子相互连接构成复杂的三维矩阵网络[3],构成黏膜下层重要的物理屏障。整合素(integrin)是一种普遍存在于动物细胞表面的跨膜异质二聚体,由α和β亚基组成,是ECM之间、细胞与ECM之间的相互识别和黏附的关键分子[4]。ECM为组织形态提供重要的结构支撑,且参与细胞黏附、趋化、组织修复和维持动物机体正常稳态等生理过程[5]。此外,ECM是宿主细胞和病原体之间的重要屏障,且大多数免疫调节反应均在ECM网络构成的宿主细胞微环境中进行[6-7]。研究报道,破坏秀丽隐杆线虫基底膜ECM会加剧上皮细胞自噬[8]。果蝇肠道基底层Ⅳ型胶原蛋白突变会引起肠上皮细胞变性和肠功能异常[9]。此外,小鼠肠道整合素基因的敲除会引发肠道炎症[10-11]。由此可见,ECM对动物肠道功能及健康有着重要的调控作用。然而,ECM在仔猪肠道上的研究还未被引起重视,尤其是仔猪断奶的关键阶段的变化规律至今还未见相关报道。因此,本试验旨在研究不同日龄断奶仔猪肠道ECM的表达规律,为断奶仔猪肠道ECM的调控研究提供参考。
1 材料与方法
1.1 试验设计和样品采集
试验选用24头健康和体况相近的21日龄“杜洛克×长白×大白”三元杂交断奶仔猪,随机分配到6个栏中,每栏4头。试验期间所有仔猪自由采食商品饲粮和自由饮水,免疫程序与保健等程序均保持一致。分别于试验开始时(断奶后0 d)、断奶后7 d、断奶后14 d、断奶后28 d从每个重复栏中随机选择1头仔猪进行麻醉后处死。剖开仔猪腹腔后仔细收集近端十二指肠、中段空肠和远端回肠约1.5 cm的组织样品,完全浸泡于4%的多聚甲醛中,用于制作Masson染色切片。取近端十二指肠、中段空肠和远端回肠肠段剪开,用磷酸盐缓冲液(PBS)冲洗内容物后保存于2 mL冻存管,液氮速冻,转移至-80 ℃冰箱保存待测。
1.2 Masson染色
保存于固定液(4%多聚甲醛)的肠道组织样品经脱水、石蜡包埋、切片和脱蜡后,切片经Masson染液套装(Servicebio,中国)进行染色,然后脱水和中性树胶封片成片。使用Axio Scope A1显微镜(Zeiss,德国)观察切片图像,采用Image-Pro软件(Media Cybernetics,美国)采集40倍和200倍放大的图像。
1.3 免疫荧光
Masson染色中制作的蜡块经切片、脱水、抗原修复和画圈后,用牛血清蛋白(bovine serum albumin,BSA)孵育30 min,弃掉封闭液后滴加已稀释的一抗[Ⅰ型胶原蛋白α2链(COL1A2)、Ⅳ型胶原蛋白α2链(COL4A2)、Ⅵ型胶原蛋白(collagen Ⅵ)]4 ℃孵育过夜,玻片置于PBS中在脱色摇床上洗涤3次,每次5 min。稍甩干后滴加已稀释的二抗,室温孵育50 min,滴加4’,6-二脒基-2-苯基吲哚二盐酸盐(DAPI)染液后避光孵育10 min,滴加自发荧光淬灭剂后冲洗10 min,洗涤3次后的切片用抗荧光淬灭封片剂封片。使用Zeiss LSM710激光共聚焦扫描显微镜(Zeiss,德国)获取图像。
1.4 RNA提取和实时荧光定量PCR(qRT-PCR)
按照Trizol试剂盒(Invitrogen,美国)说明提取十二指肠、空肠和回肠组织样品总RNA,用超微量紫外分光光度计NanoDrop 1000(Thermo Fisher Scientific,美国)评估总RNA的浓度和纯度。将1 μg的总RNA使用反转录试剂盒(TaKaRa,日本)逆转录得到20 μL的第1链cDNA,加入180 μL焦碳酸二乙酯(DEPC)水10倍稀释用于qRT-PCR。qRT-PCR(CFX System,Bio-Rad,美国)体系为10.0 μL:5.0 μL的iTaq Universal SYBR Green Supermix(Bio-Rad,美国),10 μmol/L的上、下游引物各0.5 μL,4.0 μL的cDNA。扩增程序为:95 ℃预变性30 s,95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,39个循环。引物序列根据NCBI中猪的基因序列,使用Primer Premier 5.0(Premier,加拿大)进行设计,引物由上海生工生物工程股份有限公司合成。本研究检测的靶基因和管家基因——β-肌动蛋白(β-actin)的引物序列见表1。采用2-ΔΔCt法计算靶基因的mRNA相对表达量,0 d表达量设为1.0。

表1 qRT-PCR引物序列
1.5 Western blot分析
将大约100 mg的空肠组织样加入1 mL的放射免疫沉淀法缓冲液(RIPA)裂解液,裂解液中提前加入100×的蛋白酶抑制剂和磷酸酶抑制剂。冰上放置30 min,10 000×g离心5 min,转移上清液。稀释10倍的上清液使用二喹啉甲酸(BCA)蛋白试剂盒(Thermo Fisher Scientific,美国)检测蛋白浓度。等量的蛋白中加入5×上样缓冲液(Biosharp,中国),100 ℃变性8 min。取大约30 μg的蛋白质使用7%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,然后转移到聚偏二氟乙烯(PDVF)膜上,使用5%BSA封闭1 h。一抗4 ℃孵育过夜,二抗常温孵育1 h。一抗COL1A2(ab96723)、COL4A2(ab125208)、Ⅵ型胶原蛋白(ab6588)、层黏连蛋白(ab11575)、纤维黏连蛋白1(fibronectin 1,FN1)(ab6328)和β-肌动蛋白(ab8226)购至Abcam公司。使用Clarity Western ECL Substrate(Bio-Rad,美国)检测蛋白条带,采用ImageJ软件(National Institutes of Health,美国)分析条带蛋白灰度值。
1.6 数据统计分析
使用Excel 2019对数据进行初步整理,采用SPSS 26.0软件进行单因素方差分析(one-way ANOVA),并用最小显著性(LSD)法进行多重比较,结果以“平均值和标准误”表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 不同日龄断奶仔猪肠道胶原蛋白的分布
本试验使用Masson染色分析了断奶仔猪十二指肠、空肠和回肠的胶原蛋白纤维分布情况。结果表明,十二指肠中胶原蛋白纤维主要存在于肠黏膜下层,呈纤维状穿插于弥散淋巴组织之间,黏膜上层胶原蛋白纤维含量较少(图1);空肠胶原蛋白纤维主要分布于肠黏膜下层,肠黏膜上层有少量胶原蛋白纤维存在(图2);回肠具有比十二指肠和空肠更加丰富的胶原蛋白纤维,整体呈树状且主要分布于集合淋巴结之间(图3)。
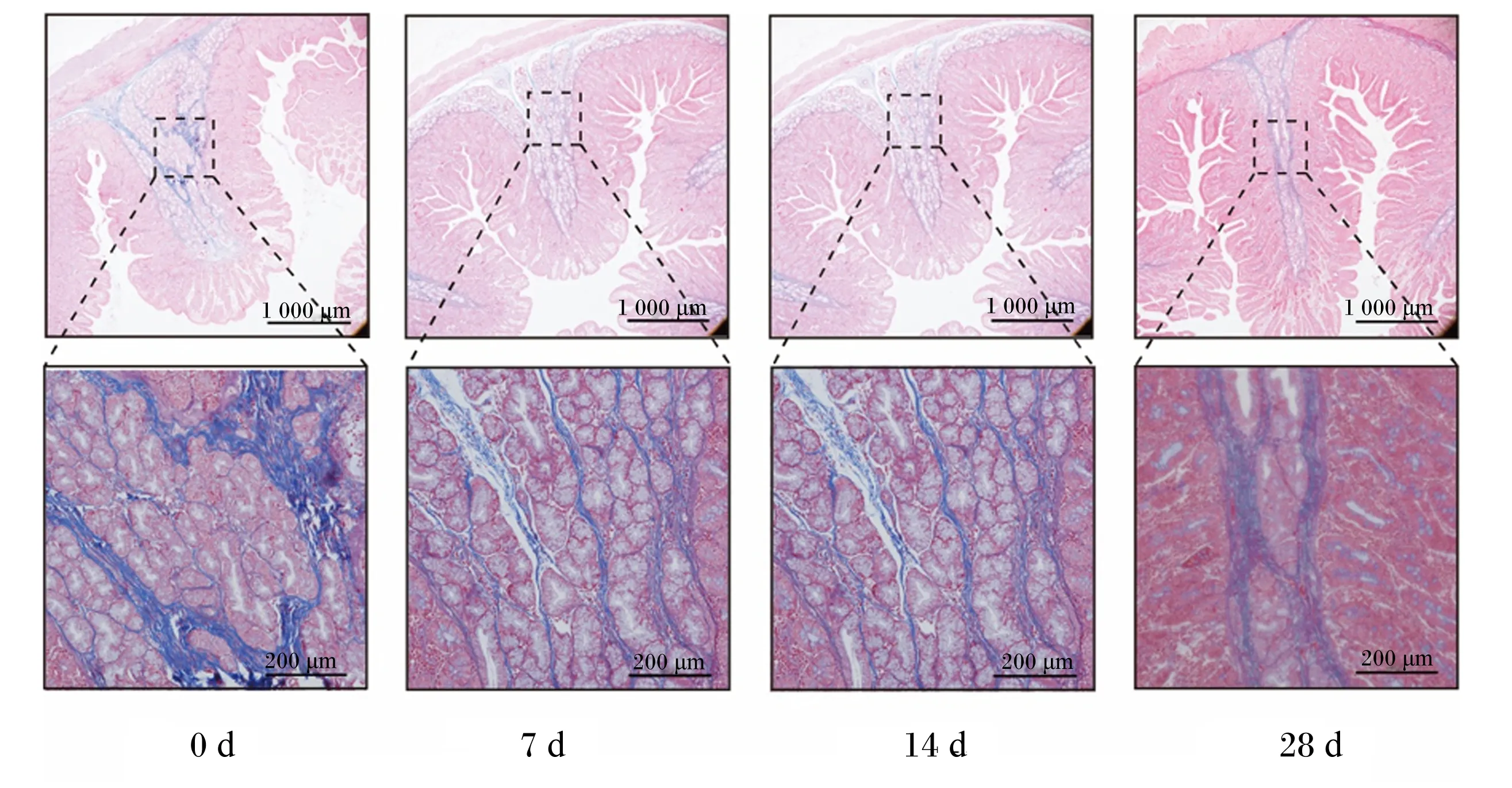
0 d:断奶后0 d;7 d:断奶后7 d;14 d:断奶后14 d;28 d:断奶后28 d。下图同。
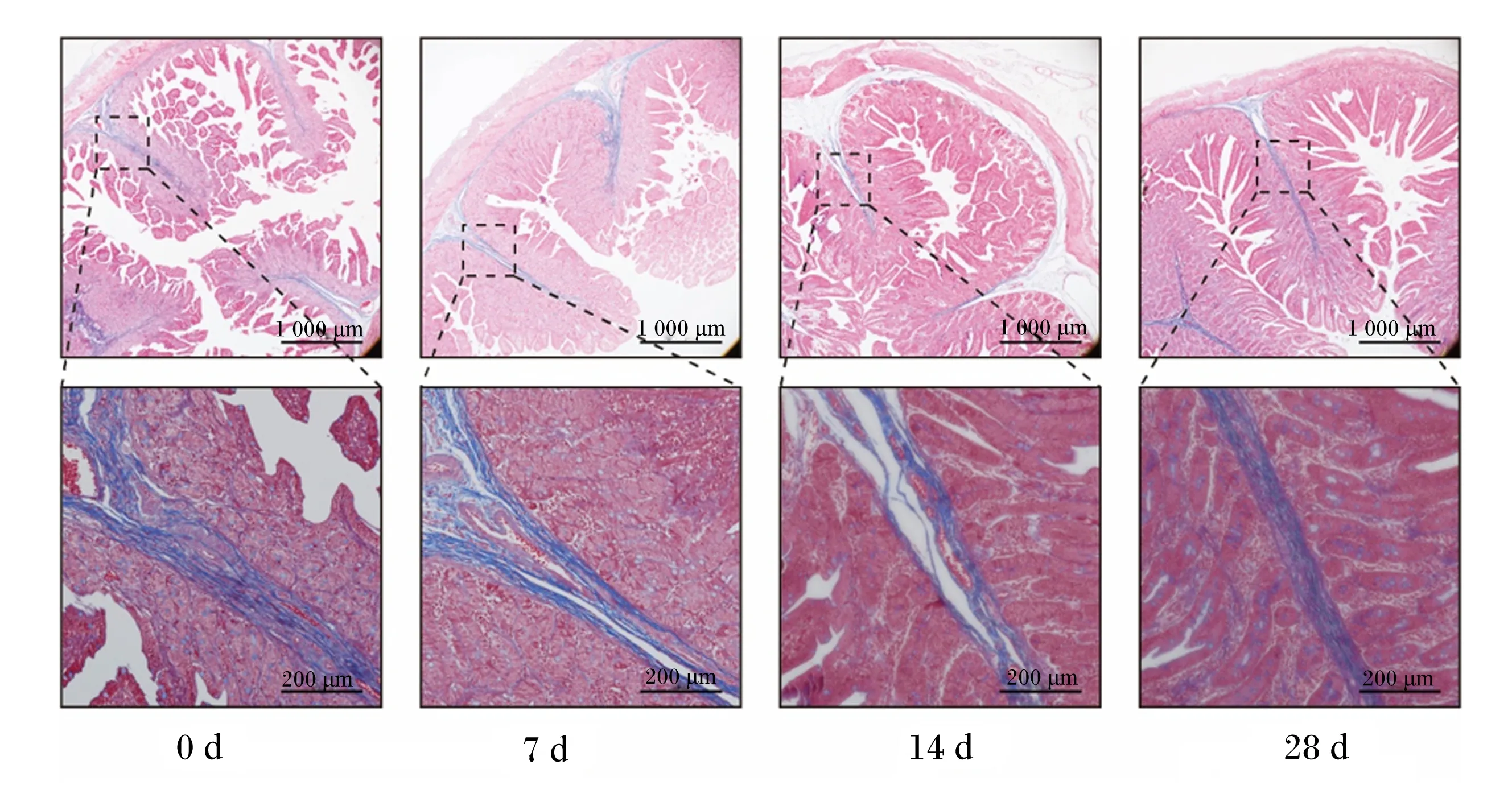
图2 断奶仔猪空肠胶原纤维Masson染色
2.2 不同日龄断奶仔猪十二指肠ECM相关基因的表达规律
如图4所示,与0 d相比,7、14和28 d断奶仔猪十二指肠COL1A2、Ⅲ型胶原蛋白α1链(COL3A1)、COL4A2、Ⅴ型胶原蛋白α1链(COL5A1)、Ⅵ型胶原蛋白α1链(COL6A1)和肌腱蛋白C(TNC)的mRNA相对表达量极显著降低(P<0.01);28 d十二指肠COL1A2和COL3A1的mRNA相对表达量极显著高于14 d(P<0.01);14 d十二指肠COL3A1的mRNA相对表达量显著低于7 d(P<0.05)。与0 d相比,7和14 d断奶仔猪十二指肠FN1和整合素α1(ITGA1)的mRNA相对表达量极显著降低(P<0.01),28 d十二指肠FN1和ITGA1的mRNA相对表达量显著降低(P<0.05);28 d十二指肠FN1的mRNA相对表达量显著高于14 d(P<0.05)。与0 d相比,14 d断奶仔猪十二指肠整合素β2(ITGB2)的mRNA相对表达量显著提高(P<0.05);14和28 d十二指肠ITGB2的mRNA相对表达量分别极显著(P<0.01)和显著(P<0.05)高于7 d。
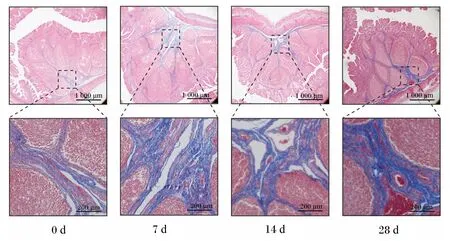
图3 断奶仔猪回肠胶原纤维Masson染色
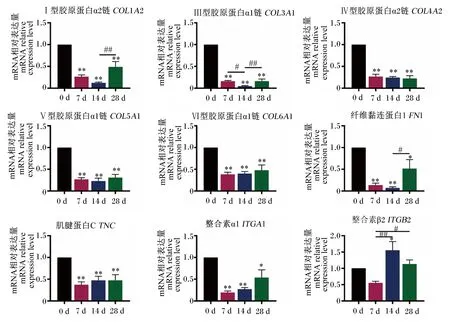
与0 d相比,数据柱标记*表示差异显著(P<0.05),数据柱标记**表示差异极显著(P<0.01);#表示7、14和28 d之间差异显著(P<0.05),##表示7、14和28 d之间差异极显著(P<0.01)。下图同。
2.3 不同日龄断奶仔猪空肠ECM相关基因的表达规律
如图5所示,与0 d相比,7 d断奶仔猪空肠COL1A2的mRNA相对表达量显著降低(P<0.05),14和28 d空肠COL1A2的mRNA相对表达量极显著降低(P<0.01);7、14和28 d空肠COL3A1的mRNA相对表达量极显著降低(P<0.01),且28 d空肠COL3A1的mRNA相对表达量显著低于7 d(P<0.05);7和14 d空肠COL4A2的mRNA相对表达量显著降低(P<0.05),且28 d空肠COL4A2的mRNA相对表达量极显著降低(P<0.01);7 d空肠COL5A1和COL6A1的mRNA相对表达量分别显著(P<0.05)和极显著(P<0.01)降低,28 d空肠COL5A1和COL6A1的mRNA相对表达量显著高于7 d(P<0.05);14和28 d空肠FN1的mRNA相对表达量分别显著(P<0.05)和极显著(P<0.01)降低,且28 d空肠FN1的mRNA相对表达量显著低于7 d(P<0.05);28 d空肠TNC和ITGB2的mRNA相对表达量极显著高于7 d(P<0.01),且28 d空肠ITGB2的mRNA相对表达量极显著高于14 d(P<0.01);7和14 d空肠ITGA1的mRNA相对表达量显著降低(P<0.05),28 d空肠ITGA1的mRNA相对表达量极显著降低(P<0.01),且显著低于7和14 d(P<0.05)。
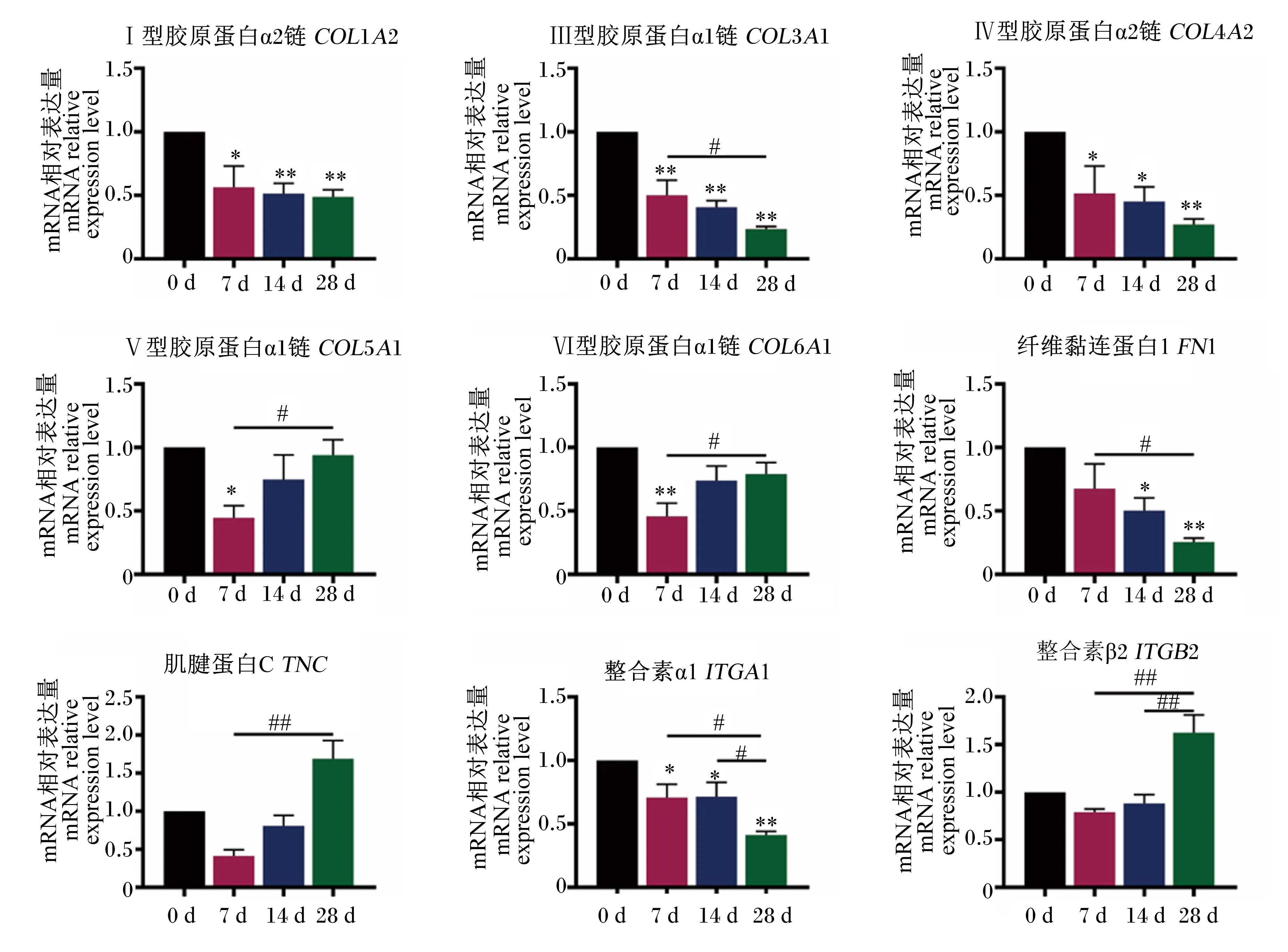
图5 断奶仔猪空肠ECM相关基因的表达规律
2.4 不同日龄断奶仔猪回肠ECM相关基因的表达规律
如图6所示,与0 d相比,7 d断奶仔猪回肠FN1的mRNA相对表达量极显著降低(P<0.01),且14 d和28 d回肠FN1的mRNA相对表达量分别显著(P<0.05)和极显著(P<0.01)高于7 d。断奶仔猪回肠COL1A2、COL3A1、COL4A2、COL5A1、COL6A1、TNC、ITGA1和ITGB2的mRNA相对表达量在各个时间点之间均无显著性差异(P>0.05)。
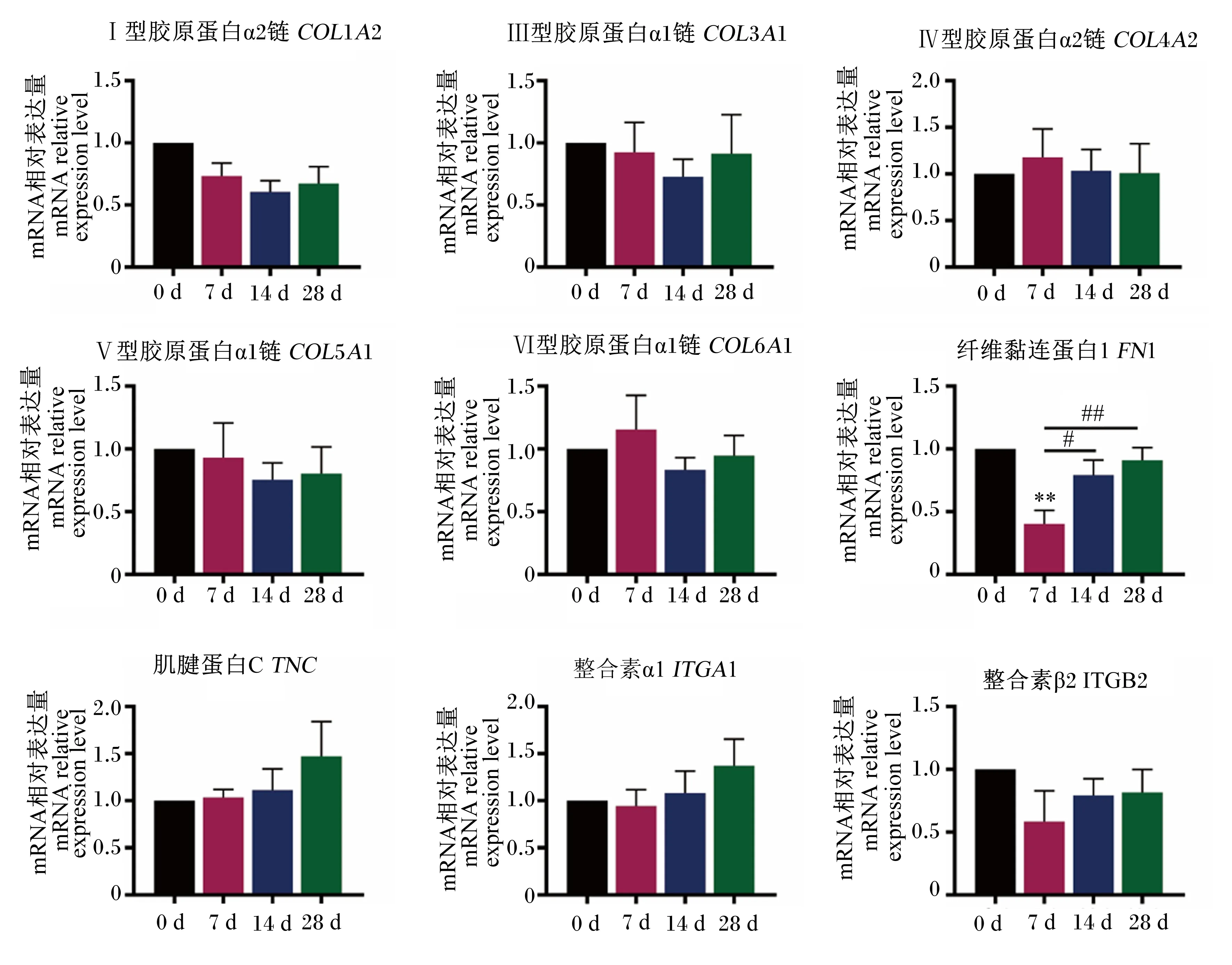
图6 断奶仔猪回肠ECM相关基因的表达规律
2.5 不同日龄断奶仔猪空肠ECM相关蛋白的表达规律与免疫荧光分析
不同肠段中,断奶对仔猪十二指肠ECM相关蛋白的影响最大,其次是空肠,对回肠影响最小。本试验采用空肠组织测定ECM相关蛋白的表达规律,如图7所示,与0 d相比,14和28 d断奶仔猪空肠COL1A2、COL4A2和Ⅵ型胶原蛋白的蛋白相对表达量显著降低(P<0.05),7 d空肠COL1A2和Ⅵ型胶原蛋白的蛋白相对表达量分别极显著(P<0.01)和显著(P<0.05)降低;14和28 d空肠层黏连蛋白的蛋白相对表达量分别显著(P<0.05)和极显著(P<0.01)降低,且28 d空肠层黏连蛋白的蛋白相对表达量显著低于7 d(P<0.05);14和28 d空肠FN1的蛋白相对表达量极显著降低(P<0.01),且14 d空肠FN1的蛋白相对表达量显著低于7 d(P<0.05)。
3 讨 论
ECM为组织形态提供重要的结构支撑,且参与细胞黏附、趋化、组织修复和维持机体正常稳态等生理过程。研究报道,ECM的过度沉积会导致肠道纤维化、炎症以及癌细胞转移增加等病理现象[5,12-14]。然而,最近研究发现,适当的ECM有助于动物的肿瘤免疫[15-16]。因此,ECM是断奶仔猪肠道功能的重要评价指标。本试验结果显示,断奶会降低仔猪十二指肠和空肠胶原蛋白(COL1A2、COL3A1、COL4A2、COL5A1、COL6A1和Ⅵ型胶原蛋白)、FN1、层黏连蛋白、TNC、ITGA1和ITGB2的表达和分泌,并且降低了断奶后7 d回肠FN1的表达。
胶原蛋白是ECM的主要组成成分,占哺乳动物体内总蛋白的25%~35%[17]。迄今为止,脊椎动物已发现28种不同类型的胶原蛋白,Ⅰ型胶原蛋白是动物最丰富的胶原蛋白,约占总胶原蛋白的90%[17-18]。Ⅰ、Ⅱ、Ⅲ、Ⅴ型和Ⅵ型胶原蛋白是典型的纤维形成胶原蛋白,能够组装形成具有特征性的1/4交错排列的纤维矩阵网络[3]。Ⅳ型胶原蛋白是网状结构胶原蛋白,负责稳定整体ECM网络结构[3]。本试验利用Masson染色分析了断奶仔猪十二指肠、空肠和回肠的胶原蛋白纤维分布情况,结果发现十二指肠、空肠和回肠中胶原蛋白纤维主要分布于肠黏膜下层,肠黏膜上层胶原蛋白纤维分布较少,且回肠具有比十二指肠和空肠更加丰富的胶原蛋白纤维,整体呈树状且主要分布于集合淋巴结之间。本试验空肠的免疫荧光显示,COL1A2主要呈小点状分布于肠道黏膜上层,COL4A2呈纤维状分布于肠黏膜下层,而Ⅵ型胶原蛋白在肠黏膜上层和下层均有较多分布,我们猜测Ⅵ型胶原蛋白可能是仔猪肠道中存在的主要胶原蛋白类型。Ⅵ型胶原蛋白是由3条不同的α链组成的三聚体,具有独特的微纤维网络结构[3];Ⅵ型胶原蛋白中还存在参与蛋白质互作的von Willebrand结构域[19],但其具体的生物学功能至今仍然还未见报道。
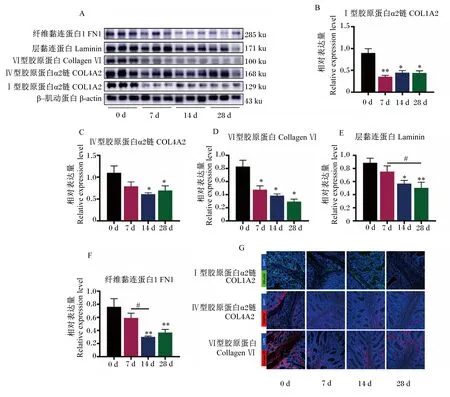
A为空肠蛋白条带;B、C、D、E和F依次分别为COL1A2、COL4A2、Ⅵ型胶原蛋白、层黏连蛋白和FN1的蛋白条带灰度值分析;G为空肠免疫荧光,图片放大倍数为200。
胶原蛋白能够调节动物肠道形态和肠道屏障功能,并在肠道组织免疫微环境中发挥重要作用[20]。近年研究发现,Ⅳ型胶原蛋白突变会引起果蝇肠上皮细胞变性、肠功能肠道障碍和形态异常[9]。本试验结果发现,仔猪断奶后7、14和28 d十二指肠COL4A2、COL5A1和COL6A1的mRNA相对表达量均极显著降低,且COL1A2和COL3A1的mRNA相对表达量均在断奶后14 d最低,呈现出随着时间的推移先降低后升高的趋势。在空肠中,COL1A2、COL3A1和COL4A2的mRNA相对表达量均随着断奶后时间的推移而更为显著降低,但COL5A1和COL6A1的mRNA相对表达量在断奶后7 d最低,呈现先降低后升高的趋势。研究报道,对160个猪场的12 034头仔猪进行28 d的统计调查发现,断奶后3~4 d仔猪开始腹泻,断奶后7~9 d腹泻最为严重,断奶后21 d仍然有很高的腹泻率[21]。这与本试验肠道胶原蛋白的变化较为一致,尤其是十二指肠中的COL1A2和COL3A1和空肠中的COL5A1和COL6A1的mRNA表达变化,这可能是导致ECM变化的一个重要原因。然而,仔猪断奶对回肠胶原蛋白mRNA表达没有显著性影响,这可能与回肠末端组织较为钝化有关。此外,空肠COL1A2、COL4A2和Ⅵ型胶原蛋白的蛋白表达结果显示,仔猪断奶后7~28 d空肠COL1A2和Ⅵ型胶原蛋白的蛋白相对表达量均显著降低,而空肠COL4A2的蛋白相对表达量仅在断奶后14和28 d显著降低,这与基因表达结果基本相似。以上结果表明,断奶应激可能会降低断奶仔猪空肠胶原蛋白的表达和分泌。
FN和层黏连蛋白是ECM的重要组成部分,属于非胶原糖蛋白,它们具有既可与细胞结合,又可与ECM其他大分子结合的共同特点[3]。TNC是一种六聚体大分子ECM糖蛋白,是动物组织炎症、机械应变、损伤和形成之间的汇聚节点[22-23]。本试验结果发现,仔猪断奶后十二指肠FN1和TNC的mRNA相对表达量显著降低,断奶后14和28 d空肠FN1的mRNA相对表达量显著降低,回肠FN1的mRNA相对表达量在断奶后4 d降到最低后在14和28 d恢复到未断奶时的水平。空肠FN1蛋白表达与mRNA表达结果趋势相似。另外,本研究还检测了层黏连蛋白的蛋白表达,其相对表达量同样是在断奶后14和28 d显著降低。以往研究表明,FN1的表达上调会通过增加甲基化而降低蛋白酪氨酸磷酸酶受体M型,进而导致转录蛋白信号转导器和激活子3磷酸化增加,促进恶性胶质肿瘤细胞增殖[24]。此外,TNC被成纤维细胞和免疫细胞广泛分泌会引起动物炎症疾病[25],且通过激活细胞因子参与组织损伤[26]。即使目前大多研究表明,FN1、层黏连蛋白和TNC的表达增多会导致组织损伤和肿瘤等疾病,但本试验中胶原蛋白、FN1、层黏连蛋白和TNC的表达在断奶后却降低了,这提示断奶仔猪肠道ECM的降低另有其因,这仍需未来加以深入研究。
整合素是ECM分子之间和ECM与细胞之间的重要连接分子。整合素是具有二聚体的跨膜蛋白,一端连接胞内的微丝,另一端跨膜连接胞外已固定在胶原蛋白纤维上的FN[27]。ITGA1和ITGB2是整合素的2个重要配体。本试验结果发现,断奶后7~28 d十二指肠ITGA1的mRNA相对表达量均显著降低,但断奶后14 d十二指肠ITGB2的mRNA相对表达量却显著提高。此外,断奶后7~28 d空肠ITGA1的mRNA相对表达量均显著降低,断奶没有引起空肠ITGB2的mRNA表达的变化,但相比断奶后28 d与7 d和14 d相比极显著提高。以往研究表明,敲除小鼠整合素基因会引起肠道炎症和肠通透性增加[11]。此外,整合素与FN、层黏连蛋白等ECM相关蛋白在限制和促进猪流行性腹泻病毒感染中具有重要调控作用[28]。由此可见,整合素与ECM分子相互依存并发挥屏障和免疫调控作用,这与本试验胶原蛋白和FN、层黏连蛋白和TNC的表达较为一致。
4 结 论
① 不同日龄断奶仔猪十二指肠、空肠和回肠中胶原蛋白纤维主要分布于肠黏膜下层,肠黏膜上层胶原蛋白纤维分布较少,且回肠具有比十二指肠和空肠更加丰富的胶原蛋白纤维。
② 仔猪断奶后十二指肠和空肠的胶原蛋白(COL1A2、COL3A1、COL4A2、COL5A1、COL6A1和Ⅵ型胶原蛋白)、FN1、层黏连蛋白、TNC、ITGA1和ITGB2的表达和分泌降低;十二指肠COL1A2、COL3A1和FN1的mRNA相对表达量在断奶后14 d降到最低,空肠COL5A1和COL6A1的mRNA相对表达量在断奶后7 d降到最低;仔猪断奶后7 d回肠FN1的mRNA相对表达量显著降低,但断奶对其他ECM相关基因表达无显著影响。

