饲料中不同脂肪源对青鱼生长性能、血清生化指标及肌肉品质的影响
陈艳婷 贾小巍 钱鹏丞 张 辰 吴成龙 叶金云
(湖州师范学院生命科学学院,浙江省水生生物资源养护与开发技术研究重点实验室,湖州 313000)
随着我国经济的快速发展,消费者不仅要求水产品食品安全、营养全面,也更注重其肌肉品质[1],而养殖水产品的品质与饲料中营养成分密切相关[2-3]。其中,脂肪源可通过影响鱼类生长速度和肌肉沉积速度来影响鱼肉质地,也可通过降解和氧化肌肉中脂质和蛋白质来影响鱼肉的气味和滋味[4]。Regost等[5]研究发现,以鱼油(fish oil,FO)、菜籽油(rapeseed oil,RO)、豆油(soybean oil,SO)为脂肪源时,FO组和SO组大西洋鲑(Salmosalar)肌肉质地显著高于RO组。Fountoulaki等[6]SO、棕榈油、RO全部替代FO后,发现SO组、棕榈油组、RO组金头鲷(Sparusaurata)肌肉的质地、滋味、气味均与FO组无显著差异。但也有研究表明,以高水平SO为脂肪源时,大菱鲆(Psettamaxima)肌肉会产生较强的土腥味[7]。目前,鱼类肌肉品质的研究主要集中于金头鲷、大西洋鲑、大黄鱼(Larimichthyscrocea)等海水性鱼类。而淡水性鱼类肌肉品质的研究主要集中于草鱼(Ctenopharyngodonidella)、罗非鱼(Oreochromisniloticus)2个品种上,对于有较高经济价值的青鱼(Mylopharyngodonpiceus)肌肉品质的研究相对较少。
青鱼作为我国主要的经济养殖鱼类,也是我国传统四大家鱼中唯一的肉食性鱼类。青鱼生长快、个体大、产量高,在长江流域和珠江流域被广泛养殖,2020年我国青鱼年产量高达69.45万t[8]。青鱼肌肉中蛋白质含量高、脂肪含量低、肉味鲜美,受到了广大消费者的喜爱[9]。目前,不同脂肪源对青鱼的研究主要集中于生长性能、脂质代谢和肝脏抗氧化能力等方面[10],对青鱼肌肉品质方面的研究还未见报道。因此,本研究以FO为对照,分别以富含饱和脂肪酸(SFA)的猪油(lard oil,PL)、富含多不饱和脂肪酸(PUFA)的玉米油(corn oil,CO)和SO以及富含单不饱和脂肪酸(MUFA)的RO和花生油(peanut oil,PO)为脂肪源,探究饲料中不同脂肪源对青鱼生长性能、血清生化指标及肌肉品质(抗氧化指标、质地、气味和滋味)的影响,为优化饲料配方并改善青鱼肌肉品质提供理论依据。
1 材料与方法
1.1 试验设计和试验饲料
试验饲料以酪蛋白、明胶为蛋白质源,分别以FO、PL、RO、CO、PO、SO为脂肪源,配制6种等氮等能的试验饲料,试验饲料组成及营养水平见表1。选取平均体重为(5.25±0.25) g的青鱼540尾,随机分为6组,每组3个重复,每个重复30尾。各组分别投喂以FO(FO组)、PL(PL组)、RO(RO组)、CO(CO组)、PO(PO组)和SO(SO组)为脂肪源的试验饲料。饲料原料粉碎后过60目筛,按表1比例精准称重,充分混匀。采用双螺杆挤条机制成粒径为2 mm颗粒饲料,置于37 ℃烘箱中风干,最后将饲料成品密封后置于-20 ℃冰箱中保存备用。
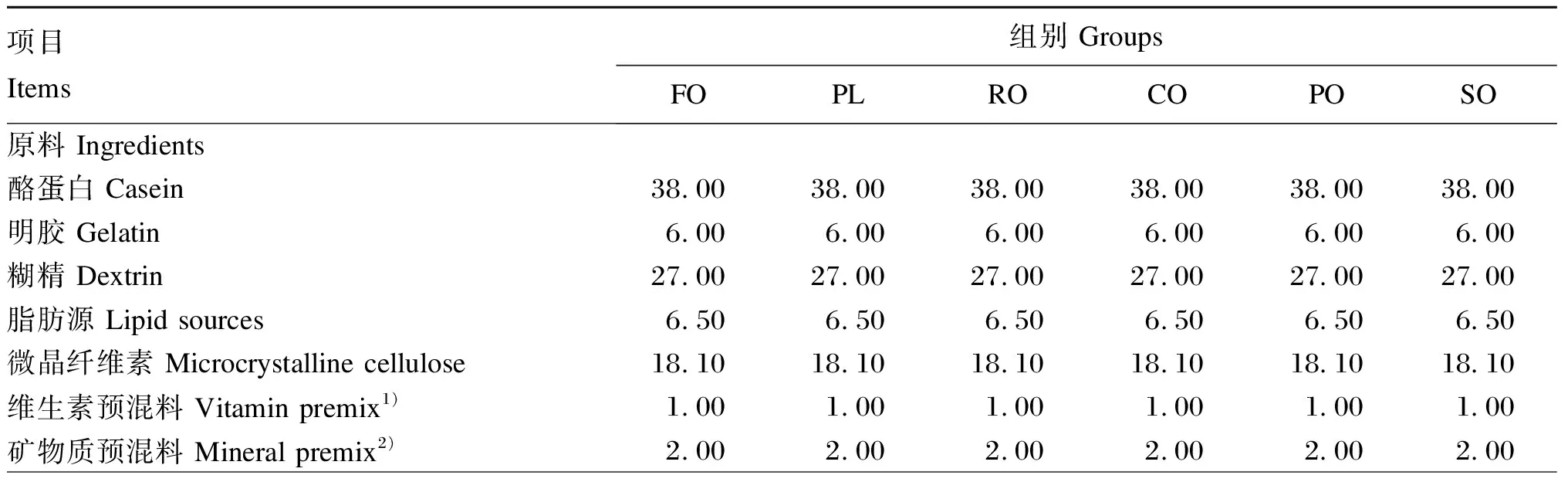
表1 试验饲料组成及营养水平(风干基础)
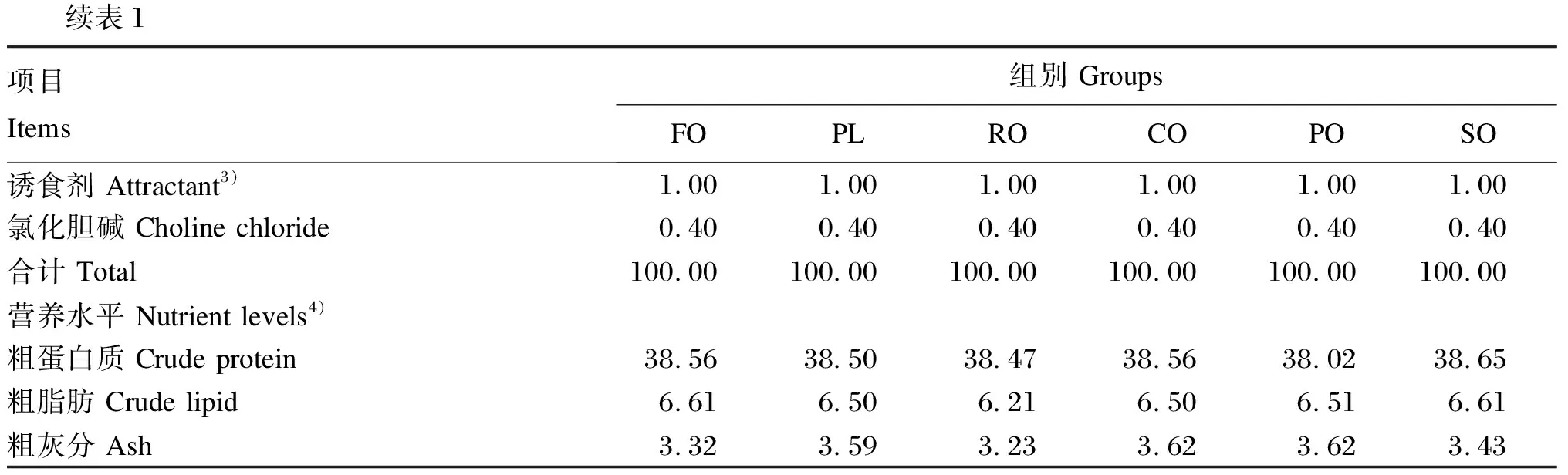
续表1项目Items组别 GroupsFOPLROCOPOSO诱食剂 Attractant3)1.001.001.001.001.001.00氯化胆碱 Choline chloride0.400.400.400.400.400.40合计 Total100.00100.00100.00100.00100.00100.00营养水平 Nutrient levels4)粗蛋白质 Crude protein38.5638.5038.4738.5638.0238.65粗脂肪 Crude lipid6.616.506.216.506.516.61粗灰分 Ash3.323.593.233.623.623.43

表2 试验饲料脂肪酸组成(占总脂肪酸的百分比)

续表2脂肪酸Fatty acids组别 GroupsFOPLROCOPOSOMUFA21.7934.0056.4027.1140.0524.78C20∶20.281.010.66ND0.210.73C18∶2n-6 (LA)44.3414.7517.1145.5928.3543.40C20∶3n-6ND0.78NDNDNDNDC20∶4n-6 (EPA)ND0.81NDNDNDNDn-6 PUFA44.3416.3417.1145.5928.3543.4C18∶3n-3 (ALA)5.321.187.161.080.754.36C20∶3n-3ND0.82NDNDNDNDn-3 PUFA5.322.007.161.080.754.36n-3 PUFA/n-6 PUFA0.120.120.420.020.030.10
1.2 饲养管理
试验用青鱼购于湖州兴旺水产苗种繁育基地,试验鱼暂养2周后,按照试验设计各组分别投喂不同脂肪源的试验饲料,养殖周期为180 d。养殖过程中水温为26~28 ℃,溶氧浓度>5 mg/L。每天饱食投喂2次,投喂时间分别为08:00和17:00。
1.3 样品采集及分析方法
1.3.1 样品采集
养殖试验结束后,禁食24 h,将每组青鱼计数称重。每组随机选取6尾鱼称重后置于-20 ℃冰箱中保存,用于全鱼成分分析。每组随机再取12尾鱼称重后进行尾静脉采血,将血液放入装有肝素的1.5 mL离心管中,在4 ℃条件下,静置8 h,2 500 r/min离心10 min,取上清液分装后放入-80 ℃冰箱中保存,用于血清生化指标的测定。将鱼解剖后取出内脏团、肝脏并称重,以计算脏体比(VSI)、肝体比(HSI)。采集肌肉样品,置于-80 ℃冰箱保存待测。
1.3.2 生长性能的测定
增重率(WGR)、特定生长率(SGR)、肥满度(CF)、VSI和HSI计算公式如下:
WGR(%)=100×(终末均重-初始均重)/
初始均重;
SGR(%/d)=100×(ln终末均重-ln初始均重)/
试验天数;
CF(g/cm3)=100×体重/体长3;
VSI(%)=100×内脏团重量/体重;
HSI(%)=100×肝脏重量/体重。
1.3.3 常规营养成分含量的测定
饲料、全鱼和肌肉中水分含量的测定参照GB/T 6435—2014方法进行;粗蛋白质含量测定使用Rapid N exceed杜马斯定氮仪(德国Elementar公司),参照GB/T 24318—2009方法进行;粗脂肪含量的测定参照GB 5009.6—2010方法进行;粗灰分含量的测定参照GB/T 6438—2007方法进行。
1.3.4 血清生化指标的测定
血清中甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDL-C)含量和碱性磷酸酶(alkaline phosphatase,ALP)活性采用宁波普瑞柏生物技术股份有限公司试剂盒测定,测定方法均参照说明书进行。
1.3.5 肌肉抗氧化指标的测定
肌肉中超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽还原酶(glutathione reductase,GR)、谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)活性、总抗氧化能力(total antioxidant capacity,T-AOC)及谷胱甘肽(glutathione,GSH)、丙二醛(malonaldehyde,MDA)含量采用南京建成生物工程研究所试剂盒测定,测定方法均参照说明书进行。
1.3.6 肌肉质地的测定
将背侧肌切成1.0 cm×1.0 cm×0.8 cm的肉块,使用TA.XT plus型质构分析仪(英国SMS公司)参照质地剖面分析(texture profile analysis,TPA)法测定肌肉的硬度、韧性、紧实度、坚实度、咀嚼性和弹性,每个样品重复测定3次。
1.3.7 肌肉中蛋白质组成及胶原蛋白合成相关指标、组织蛋白酶含量的测定
称取1.00 g肌肉,加入预冷的磷酸缓冲溶液20.00 mL后进行匀浆,将匀浆液置于4 ℃、8 000×g离心机中离心20 min,吸去上清液(水溶性蛋白)于25 mL容量瓶中,用磷酸缓冲溶液定容至25 mL,在4 ℃条件下保存待测。在沉淀中加入20 mL预冷的0.6 mol/L KCl的磷酸缓冲溶液,匀浆后在相同条件下离心20 min,取上清液(盐溶性蛋白)置于25 mL容量瓶中,用0.6 mol/L KCl的磷酸缓冲溶液定容,4 ℃条件下保存待测。肌肉中水溶性蛋白和盐溶性蛋白含量采用考马斯亮蓝法进行测定;胶原蛋白含量测定采用羟脯氨酸法,测得羟脯氨酸含量乘以系数8得到胶原蛋白含量[11];脯氨酸羟化酶(prolyl hydroxylase,PHD)、赖氨酰氧化酶(lysyloxidase,LOX)、胶原吡啶交联(pyridinoline crosslinks,PYD)、组织蛋白酶-B(cathepsin-B,Cath-B)、组织蛋白酶-L(cathepsin-L,Cath-L)含量均采用江苏酶免实业有限公司酶联免疫吸附测定(ELISA)试剂盒测定,测定方法参照说明书进行。
1.3.8 肌肉气味的测定
采用直接顶空吸气法测定肌肉的气味,直接将进样针头插入含样品的顶空瓶中,用PEN3电子鼻(德国Airsense公司)进行测定。测定条件:采样时间为1 s/组,传感器自清洗时间为80 s,传感器归零时间为5 s,样品准备时间为5 s,进样流量为400 mL/min,分析采样时间为80 s。
1.3.9 肌肉滋味的测定
样品在室温下解冻,用剪刀将其剪碎,称取20.0 g样品置于烧杯中,添加100 mL纯水,搅拌均匀后倒入搅拌机中搅拌20 s,然后将样品倒入离心管中3 000 r/min离心5 min,取上清液置于TS-5000Z电子舌(日本Insent公司)进行测试。用30 mmol/L KCl溶液与0.3 mmol/L酒石酸溶液配成参比溶液。将传感器置于参比溶液中归零30 s,随后开始进行鲜味测定。测试时间为30 s,测试完毕后用参比溶液清洗3 s,再次进行回味测定,测试时间30 s。每个样品重复4次,取后3次作为测定结果。
1.4 数据统计分析
试验数据采用SPSS 25.0统计软件进行单因素方差分析(one-way ANOVA),当差异显著时用Duncan氏法进行多重比较,P<0.05表示差异显著。数据采用平均值±标准差(mean±SD)表示。
2 结 果
2.1 饲料中不同脂肪源对青鱼生长性能的影响
如表3所示,各组之间FBW、WGR、SGR无显著差异(P>0.05)。FO组、RO组和SO组CF和VSI显著高于PL组、CO组和PO组(P<0.05)。FO组和SO组HSI显著高于PL组、RO组、CO组和PO组(P<0.05),CO组HSI最低。
2.2 饲料中不同脂肪源对青鱼体成分的影响
如表4所示,PL组、RO组、CO组和PO组全鱼粗蛋白质含量显著高于FO组、SO组(P<0.05),FO组、PL组、RO组、CO组和PO组肌肉粗蛋白质含量显著高于SO组(P<0.05)。SO组和PL组全鱼和肌肉粗脂肪含量显著高于FO组、RO组、PO组和CO组(P<0.05),CO组全鱼和肌肉粗脂肪含量最低。FO组全鱼和肌肉粗灰分含量显著低于其他各组(P<0.05),PL组和PO组全鱼粗灰分含量显著高于FO组、RO组、CO组和SO组(P<0.05)。各组之间全鱼和肌肉水分含量无显著差异(P>0.05)。
如表5所示,FO组和RO组肌肉SFA含量显著低于PL组、CO组、PO组和SO组(P<0.05)。FO组和RO组肌肉MUFA含量显著高于PL组、CO组、PO组和SO组(P<0.05)。RO组肌肉亚麻酸(C18∶3n-3)含量显著高于FO组、PL组、CO组和SO组(P<0.05)。RO组和SO组肌肉二十碳五烯酸(EPA)+二十二碳六烯酸(DHA)含量显著高于FO组、PL组、CO组和PO组(P<0.05)。CO组和SO组肌肉PUFA含量显著高FO组、PL组、RO组和PO组(P<0.05)。
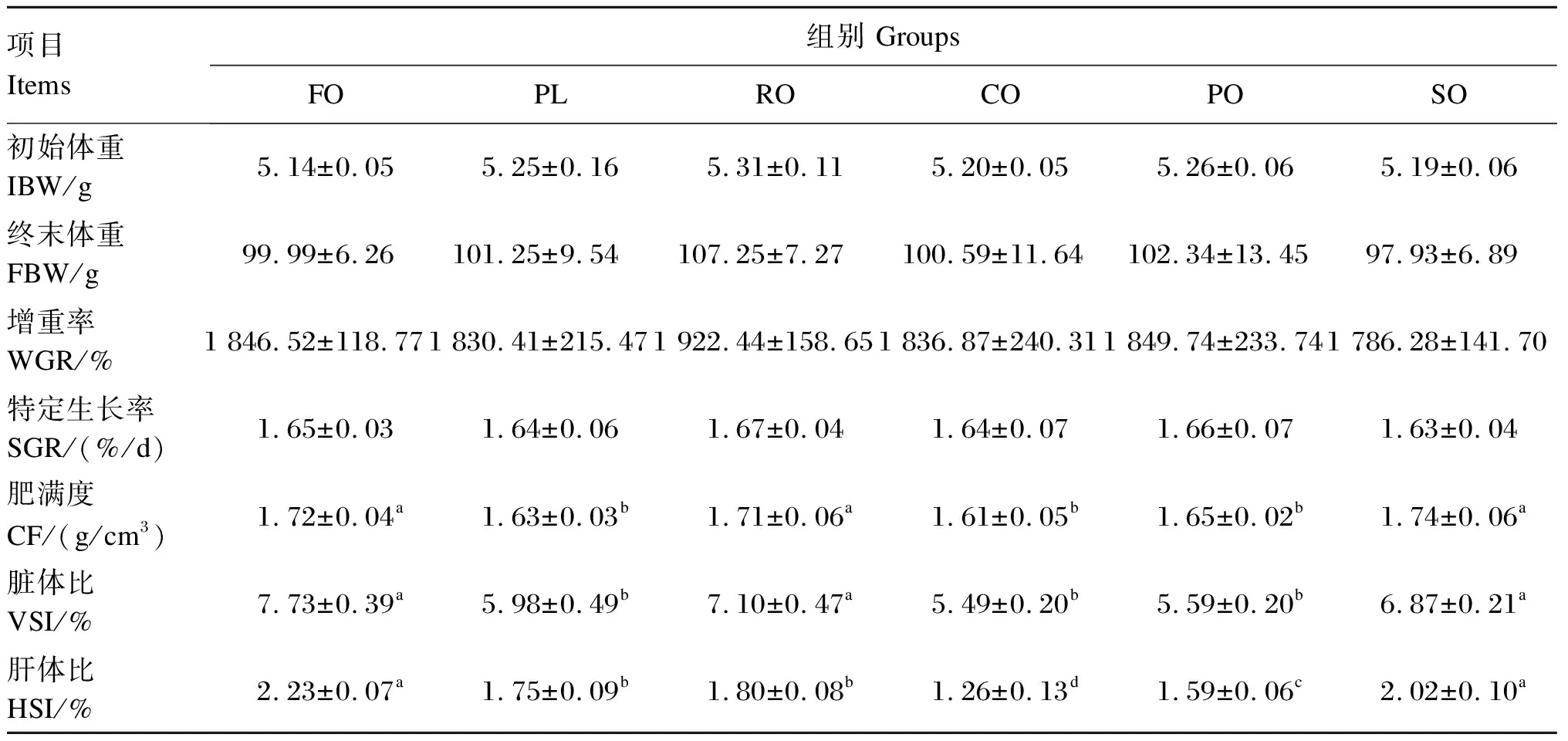
表3 饲料中不同脂肪源对青鱼生长性能的影响
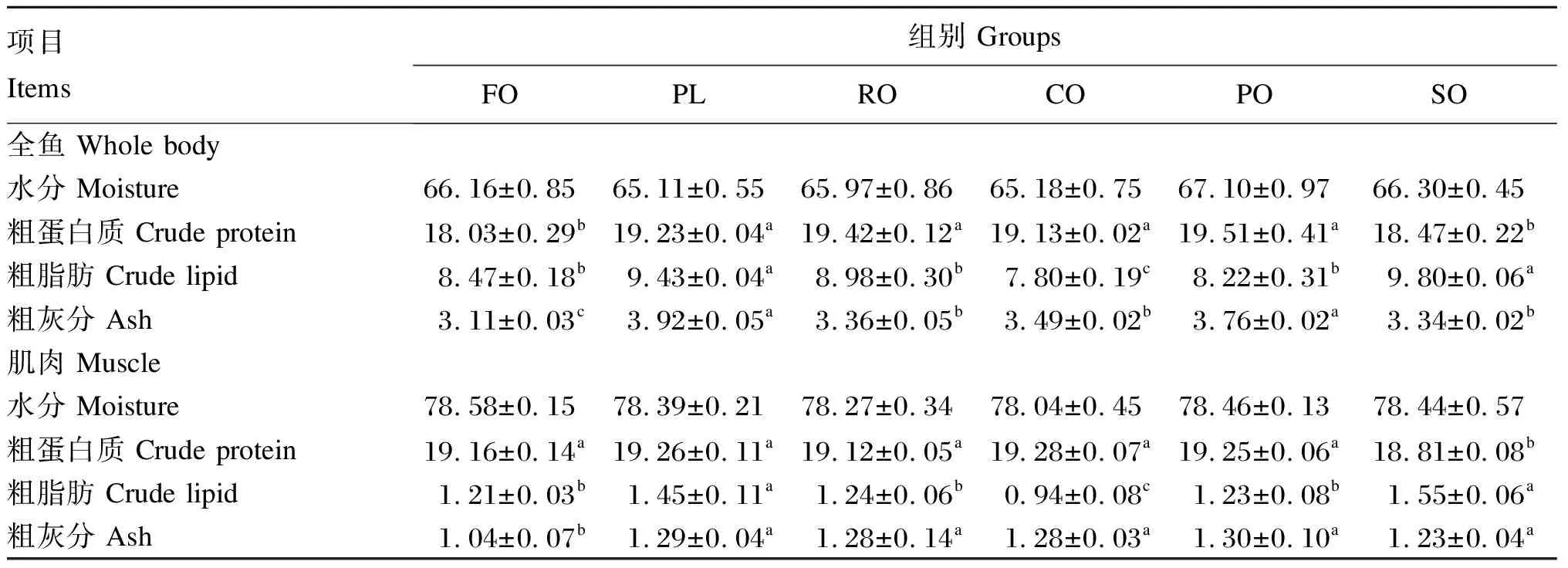
表4 饲料中不同脂肪源对青鱼全鱼和肌肉营养成分的影响

表5 饲料中不同脂肪源对青鱼肌肉脂肪酸组成的影响(占总脂肪酸的百分比)
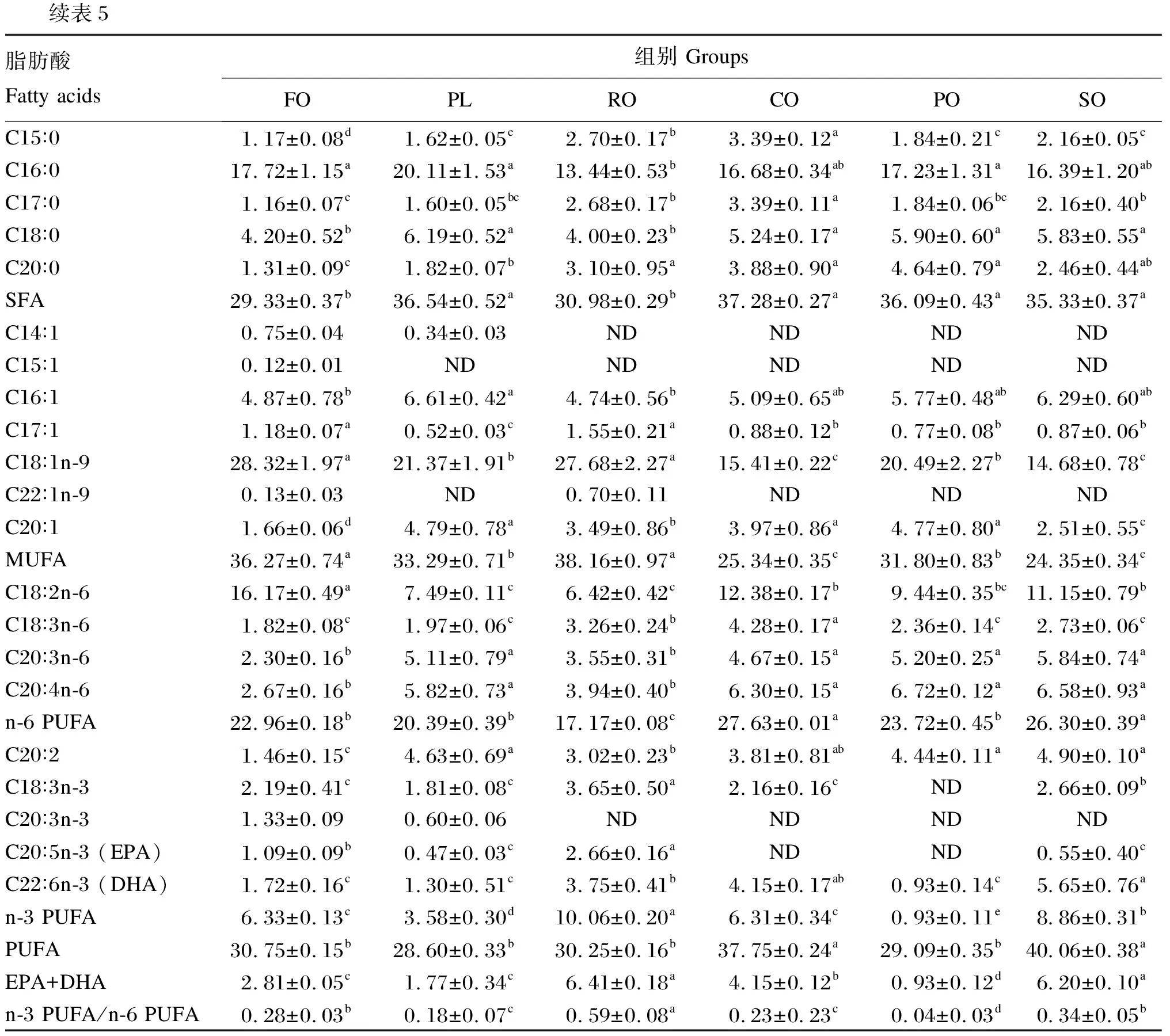
续表5脂肪酸Fatty acids组别 GroupsFOPLROCOPOSOC15∶01.17±0.08d1.62±0.05c2.70±0.17b3.39±0.12a1.84±0.21c2.16±0.05cC16∶017.72±1.15a20.11±1.53a13.44±0.53b16.68±0.34ab17.23±1.31a16.39±1.20abC17∶01.16±0.07c1.60±0.05bc2.68±0.17b3.39±0.11a1.84±0.06bc2.16±0.40bC18∶04.20±0.52b6.19±0.52a4.00±0.23b5.24±0.17a5.90±0.60a5.83±0.55aC20∶01.31±0.09c1.82±0.07b3.10±0.95a3.88±0.90a4.64±0.79a2.46±0.44abSFA29.33±0.37b36.54±0.52a30.98±0.29b37.28±0.27a36.09±0.43a35.33±0.37aC14∶10.75±0.040.34±0.03NDNDNDNDC15∶10.12±0.01NDNDNDNDNDC16∶14.87±0.78b6.61±0.42a4.74±0.56b5.09±0.65ab5.77±0.48ab6.29±0.60abC17∶11.18±0.07a0.52±0.03c1.55±0.21a0.88±0.12b0.77±0.08b0.87±0.06bC18∶1n-928.32±1.97a21.37±1.91b27.68±2.27a15.41±0.22c20.49±2.27b14.68±0.78cC22∶1n-90.13±0.03ND0.70±0.11NDNDNDC20∶11.66±0.06d4.79±0.78a3.49±0.86b3.97±0.86a4.77±0.80a2.51±0.55cMUFA36.27±0.74a33.29±0.71b38.16±0.97a25.34±0.35c31.80±0.83b24.35±0.34cC18∶2n-616.17±0.49a7.49±0.11c6.42±0.42c12.38±0.17b9.44±0.35bc11.15±0.79bC18∶3n-61.82±0.08c1.97±0.06c3.26±0.24b4.28±0.17a2.36±0.14c2.73±0.06cC20∶3n-62.30±0.16b5.11±0.79a3.55±0.31b4.67±0.15a5.20±0.25a5.84±0.74aC20∶4n-62.67±0.16b5.82±0.73a3.94±0.40b6.30±0.15a6.72±0.12a6.58±0.93an-6 PUFA22.96±0.18b20.39±0.39b17.17±0.08c27.63±0.01a23.72±0.45b26.30±0.39aC20∶21.46±0.15c4.63±0.69a3.02±0.23b3.81±0.81ab4.44±0.11a4.90±0.10aC18∶3n-32.19±0.41c1.81±0.08c3.65±0.50a2.16±0.16cND2.66±0.09bC20∶3n-31.33±0.090.60±0.06NDNDNDNDC20∶5n-3 (EPA)1.09±0.09b0.47±0.03c2.66±0.16aNDND0.55±0.40cC22∶6n-3 (DHA)1.72±0.16c1.30±0.51c3.75±0.41b4.15±0.17ab0.93±0.14c5.65±0.76an-3 PUFA6.33±0.13c3.58±0.30d10.06±0.20a6.31±0.34c0.93±0.11e8.86±0.31bPUFA30.75±0.15b28.60±0.33b30.25±0.16b37.75±0.24a29.09±0.35b40.06±0.38aEPA+DHA2.81±0.05c1.77±0.34c6.41±0.18a4.15±0.12b0.93±0.12d6.20±0.10an-3 PUFA/n-6 PUFA0.28±0.03b0.18±0.07c0.59±0.08a0.23±0.23c0.04±0.03d0.34±0.05b
2.3 饲料中不同脂肪源对青鱼血清生化指标的影响
如表6所示,FO组、PL组和SO组血清TG含量显著高于RO组、CO组和PO组(P<0.05)。PO组血清TC含量显著高于其他各组(P<0.05)。PL组血清HDL-C含量显著低于其他各组(P<0.05)。FO组和RO组血清ALP活性显著高于PL组、CO组、PO组和SO组(P<0.05)。各组之间血清LDL-C含量无显著差异(P>0.05)。
2.4 饲料中不同脂肪源对青鱼肌肉抗氧化指标的影响
如表7所示,PO组肌肉SOD、GR活性显著高于其他各组(P<0.05),RO组显著高于PL组、CO组、SO组和FO组(P<0.05)。PO组和SO组肌肉GST活性显著高于FO组、PL组、CO组和RO组(P<0.05),RO组显著高于FO组、PL组和CO组(P<0.05),PL组最低。PO组肌肉GSH含量显著高于其他各组(P<0.05),SO组显著高于FO组、RO组、PL组和CO组(P<0.05),CO组显著低于其他各组(P<0.05)。PO组和PL组肌肉T-AOC显著低于其他各组(P<0.05),CO组显著高于其他各组(P<0.05)。PO组肌肉MDA含量显著高于其他各组(P<0.05),SO组、PL组、FO组显著高于RO组和CO组(P<0.05)。

表6 饲料中不同脂肪源对青鱼血清生化指标的影响

表7 饲料中不同脂肪源对青鱼肌肉抗氧化指标的影响
2.5 饲料中不同脂肪源对青鱼肌肉质地的影响
如表8所示,FO组、RO组和SO组肌肉硬度显著高于PL组、CO组和PO组(P<0.05)。FO组、PL组、RO组和SO组肌肉坚实度显著高于CO组和PO组(P<0.05),CO组最低。FO组、PL组、RO组、PO组和SO组肌肉咀嚼性显著高于CO组(P<0.05)。FO组、PL组、RO组、PO组和CO组肌肉弹性显著高于SO组(P<0.05)。各组之间肌肉韧性和紧实度无显著差异(P>0.05)。
2.6 饲料中不同脂肪源对青鱼肌肉中胶原蛋白及其合成相关指标、组织蛋白酶含量的影响
如表9所示,RO组、CO组、PO组和SO组肌肉水溶性蛋白含量显著低于FO组和PL组(P<0.05),RO组最低。RO组肌肉盐溶性蛋白含量显著高于其他各组(P<0.05)。FO组肌肉胶原蛋白和PHD含量显著高于其他各组(P<0.05)。SO组和CO组肌肉LOX含量显著高于PO组、PL组、FO组和RO组(P<0.05),RO组显著低于其他各组(P<0.05)。SO组肌肉PYD含量显著高于其他各组(P<0.05),RO组显著低于其他各组(P<0.05)。SO组肌肉Cath-B含量显著高于其他各组(P<0.05),PL组和FO组显著高于CO组、RO组和PO组(P<0.05)。PL组、RO组、CO组和SO组肌肉Cath-L含量与FO组无显著差异(P>0.05),而PO组显著低于FO组(P<0.05)。

表8 饲料中不同脂肪源对青鱼肌肉质地的影响

表9 饲料中不同脂肪源对青鱼肌肉蛋白质组成及胶原蛋白合成相关指标、组织蛋白酶含量的影响
2.7 饲料中不同脂肪源对青鱼肌肉气味的影响
主成分分析(PCA)是使用线性组合将具有强烈针对性的多个变量转换为多个相互无关的综合变量进行分析的方法。图1为饲料中不同脂肪源对青鱼肌肉气味PCA图,图中显示了2个主要组件轴:主成分1(PC1)和主成分2(PC2),PC1贡献率为61.22%,PC2贡献率21.99%,总贡献率为83.21%,能反映样品的整体气味。饲料中不同脂肪源对青鱼肌肉气味会产生明显差异,RO组肌肉气味与FO组无明显差异,而PL组、PO组、SO组、CO组肌肉气味与FO组有明显差异。
2.8 饲料中不同脂肪源对青鱼肌肉滋味的影响
由图2所示,PC1贡献率为71.52%,PC2贡献率11.87%,总贡献率为83.39%。RO组、SO组肌肉滋味与FO组无明显差异,而PL组、CO组、PO组肌肉滋味与FO组有明显差异;其中,PO组肌肉滋味与FO组差异最为明显。以参比溶液的输出为零点,酸味和咸味的无味点分别为-13和-6,其他指标无味点均为0。如表10所示,青鱼肌肉酸味、涩味、苦味回味均低于无味点,而咸味、鲜味、甜味、苦味均大于无味点,表明青鱼肌肉中有效味觉指标为咸味、鲜味、甜味、苦味。CO组和PO组肌肉鲜味、咸味显著高于FO组、PL组、RO组和SO组(P<0.05),且RO组肌肉咸味显著高于FO组、PL组和SO组(P<0.05)。RO组和CO组肌肉甜味显著高于FO组(P<0.05),且PL组、PO组和SO组肌肉甜味与FO组无显著差异(P>0.05)。FO组和CO组肌肉苦味显著高于PL组、RO组、PO组和SO组(P<0.05),SO组最低。

图1 饲料中不同脂肪源对青鱼肌肉气味主成分分析图

图2 饲料脂肪源对青鱼肌肉滋味主成分分析图
3 讨 论
3.1 饲料中不同脂肪源对青鱼生长性能和体成分的影响
水产动物对脂肪的利用主要取决于脂肪酸种类及其含量,脂肪源可通过影响水产动物对脂肪酸的消化、吸收和利用,进而对水产动物生长性能产生不同影响[12]。Lin等[13]发现摄食以FO、CO、PO、SO为脂肪源的饲料后,CO组、PO组、SO组石斑鱼(Epinepheluscoioides)生长性能与FO组无显著差异。Qiu等[12]也发现摄食以FO、RO、PO、SO为脂肪源的饲料后,PO组和SO组大黄鱼(Larmichthyscrocea)生长性能与FO组无显著差异,而RO组大黄鱼的生长性能有所提高,可能是由于RO富含n-3PUFA,从而促进了其生长。本研究中,PL组、RO组、CO组、PO组、SO组WGR、FBW和SGR与FO组无显著差异,但SO组WGR、FBW和SGR均低于其他各组,在石斑鱼[13]上也发现了相似的结果。Li等[14]发现SO中亚油酸含量比FO高,而n-6PUFA含量增加,可能在一定程度上抑制了鱼类的生长。
在民俗学界,民俗书写的单边主义被视为理所当然,访谈依旧是常见的田野方式。主动权为调查者所掌控,当地人总是处于被动地位,由调查者们任意支配……民俗学理论和田野的系统训练装饰了民俗学者的合法化身份,这一身份的突出表现指向民俗书写权力。他们在田野中,懂得什么对理论分析和论文制作有用,而抛弃、闲置那些难以进入理论框架的民俗事象,研究的出发点不是民俗生活世界,而是为了满足书写权力的宣泄。[注]万建中:《民俗书写的权力与权力实践》,《思想战线》2018年第5期。
3.2 饲料中不同脂肪源对青鱼血清生化指标的影响

表10 饲料中不同脂肪源对青鱼肌肉滋味的影响
HDL-C可将血液中的TC转入肝脏,从而减少血液中TC含量,降低心血管疾病的发病风险[23]。Gao等[24]发现摄食以FO、RO、CO、SO为脂肪源的饲料后,RO组、CO组和SO组克氏原螯虾(Procambarusclarkia)血清HLD-C含量与FO组无显著差异。李婷婷等[22]也发现RO组、SO组杂交鲟血清HLD-C含量与FO组无显著差异。本研究结果也显示,RO组、CO组、PO组、SO组血清HDL-C含量与FO组无显著差异,而PL组显著低于其他各组。这表明摄食以PL为脂肪源的饲料,可能导致青鱼血清中TC不能充分转运回肝脏进行分解代谢,容易引起部分TC在血管中沉积[23]。ALP在水产动物机体非特异性免疫过程中发挥重要作用,是巨噬细胞溶酶体的标志酶,ALP活性可反映水产动物非特异性免疫能力的强弱[25]。本研究中,FO组和RO组血清ALP活性显著高于PL组、CO组、PO组和SO组,这与异育银鲫(Carassiusauratusgibelio)的结果[26]相似。这表明与PL、CO、PO和SO相比,摄食以FO、RO为脂肪源的饲料可能会提高鱼体的非特异性免疫能力[25]。

T-AOC是机体抗氧化能力的总体体现,而MDA是脂质过氧化的代表产物[24]。Guo等[29]发现摄食以FO、RO、PO为脂肪源的饲料后,RO组、FO组金鲳鱼血清T-AOC显著高于PO组,且PO组血清MDA含量显著高于FO组。刘燕等[30]发现摄食以FO、CO为脂肪源的饲料后,CO组津新鲤(Cyprinuscarpio)血清T-AOC显著高于FO组。在本研究中,PL组、PO组肌肉T-AOC显著低于FO组、RO组、CO组和SO组,而CO组显著高于其他各组;PO组肌肉MDA含量显著高于其他各组,且RO组、CO组显著低于FO组。这与上述金鲳鱼、津新鲤和鲤鱼研究结果相似。PO组肌肉T-AOC降低、MDA含量升高,可能是由于PO中MUFA含量高,加速了机体氧化代谢,同时产生了相对较多的活性氧,机体通过提高SOD、GR、GST等抗氧化酶活性和GSH含量抵抗氧化造成的胁迫[28]。同时,本研究结果也表明摄食RO、CO为脂肪源的饲料可以提高青鱼肌肉抗氧化能力。这可能是由于CO富含PUFA,使得肌肉抗氧化能力提高[10]。而RO中n-3PUFA可通过核因子相关因子2(Nrf2)途径抑制细胞中H2O2的生成,进而提高了机体的抗氧化能力[31]。抗氧化能力的提高可降低肌肉中脂质氧化产生的异味物质,从而改善肌肉品质[32]。
3.3 饲料中不同脂肪源对青鱼肌肉品质的影响
胶原蛋白作为结缔组织的主要成分,其含量直接影响肌肉硬度。Wei等[37]发现添加适量的羟脯氨酸可以促进大黄鱼肌肉胶原蛋白的合成,进而提高了大黄鱼的肌肉品质。杨航等[38]发现通过提高胶原蛋白合成过程中的关键酶,如PHD、LOX,进而提高草鱼肌肉中胶原蛋白含量,达到改善肌肉品质的目的。但目前,脂肪源对水产动物肌肉中胶原蛋白含量的研究较少。本研究结果显示,FO组肌肉胶原蛋白和PHD含量显著高于其他各组,且RO组最低。同时,RO组肌肉LOX、PYD含量均显著低于FO组。这表明摄食以PL、RO、CO、PO、SO为脂肪源的饲料会降低肌肉中胶原蛋白的沉积,其中RO组最为明显。RO可通过降低肌肉PHD、LOX、PYD含量,使得肌肉中胶原蛋白的合成量减少。而PL组、CO组、PO组和SO组肌肉胶原蛋白含量的降低,除了与胶原蛋白的合成含量有关,还可能与胶原蛋白降解含量有关。一般来说,肌肉中胶原蛋白含量与硬度呈正相关[39],而本研究中肌肉胶原蛋白含量结果与上述肌肉硬度结果不一致。而肌肉质地除了与肌肉中胶原蛋白含量有关,还与肌纤维类型[40]、直径[41]、肌肉中水分和脂肪含量[42]等指标有关,具体原因有待于进一步研究。
不同脂肪源主要是脂肪酸组成和含量不同,肌肉中的脂肪酸组成基本上反映了饲料的脂肪酸组成[43]。鱼肉脂肪酸种类和含量的变化,可通过脂肪酸降解和氧化影响肌肉中挥发性风味化合物的种类和含量,进而影响肌肉气味[44]。本研究结果显示,RO组、PO组肌肉气味与FO组相近,PL组、SO组、CO组肌肉气味与FO组有明显差异。Mu等[43]也发现摄食以FO、RO、SO为脂肪源的饲料后,RO组大黄鱼肌肉气味与FO组相近。这可能是由于FO、RO中富含n-3PUFA,而n-3PUFA产生的挥发性醛是一种可以使鱼肉产生香味的物质[45]。肌肉气味还与脂肪酸种类和不饱和程度有关,一般新鲜鱼肉中的挥发性化合物主要是由不饱和脂肪酸氧化分解产生的羰基和醇类,而PL中富含饱和脂肪酸,氧化后产物不同直接影响了鱼肉的气味[43]。陈炼[10]发现PO中n-6PUFA含量低于CO、SO。n-6系列脂肪酸氧化衍生的挥发性醛类对鱼肉的整体气味会产生负面影响[45],这也导致摄食以PO为脂肪源的饲料,肌肉产生的异味物质含量低于CO组和SO组。水产品肌肉滋味的主要贡献物质包括脂肪酸、氨基酸、核苷酸、矿物质等。Izquierdo等[46]发现以60%RO、SO替代FO后,RO组、SO组金头鲷(Sparusaurata)和鲈鱼肌肉滋味与FO组无显著差异。本研究结果显示,RO组、SO组肌肉滋味与FO组无差异。这可能与肌肉蛋白质经组织蛋白酶降解成多肽,进而形成游离氨基酸的种类和含量有关[47]。PO组肌肉Cath-B和Cath-L含量显著低于FO组,组织蛋白酶含量降低抑制了肌肉中蛋白质降解,使得蛋白质降解后产生的游离氨基酸含量降低,进而影响了PO组肌肉的滋味。CO组、PO组肌肉鲜味显著高于FO组,可能是由于CO组、PO组肌肉中肌苷酸(IMP)与谷氨酸盐协同作用后使得鲜味增强[48-49]。RO组肌肉鲜味与FO组无显著差异,表明以RO为脂肪源时,不会影响青鱼肌肉的鲜味。
4 结 论
综上所述,饲料中不同脂肪源对青鱼生长性能、血清生化指标及肌肉品质会产生不同影响。饲料中不同脂肪源对青鱼生长性能未产生负面影响,而摄食以FO和RO为脂肪源的饲料更有利于青鱼健康并且还可改善肌肉质地、气味、滋味。同时。摄食以FO、RO、CO为脂肪源的饲料可提高青鱼肌肉抗氧化能力。与FO相比,摄食以PL、PO、SO为脂肪源的饲料会降低青鱼肌肉抗氧化能力、质地、气味和滋味。

