嗜碱性粒细胞在过敏性疾病中研究进展及临床应用展望
钟文伟 李京阳 耿丽婷 张建华
上海交通大学医学院附属新华医院(上海 200092)
Th2免疫应答是包括支气管哮喘在内的过敏性疾病发病的最重要的免疫学机制。多种免疫细胞、炎症细胞及其分泌的细胞因子、炎症递质相互协同在过敏性炎症的形成和发展过程中起着关键作用。在众多免疫细胞中,嗜碱性粒细胞(basophil,Ba)在过敏性疾病发病机制中的作用逐渐引起关注,尤其是作为生物标记物在过敏性疾病诊断以及疗效评价中的价值是目前研究的热点。本文就Ba在过敏性疾病发病机制中的进展及其临床应用前景作一阐述。
1 嗜碱性粒细胞基础研究
Ba 是一类发现早,但长期被忽视的免疫细胞。Ba 在外周血中含量很低,仅占白细胞总数0.5%左右。Ba 一直被认为是参与Th 2 免疫应答的下游效应细胞。近年来随着对Ba研究的进一步深入,人们对Ba 及其功能有了新的发现和认识,认为其在过敏性疾病发病机制中起着始动者、效应者和调节者作用[1-3]。
1.1 启动Th2免疫应答
近20 年来对于Ba 是否具有抗原递呈细胞功能做了大量研究。最早Nature Immunology等杂志连续报道了关于Ba 具有抗原递呈功能的研究结果[4-6]。首先,研究发现在变应原致敏早期Ba在引流淋巴结中显著升高且在时间上早于Th2细胞和IL-4水平升高,而且发现Ba和T细胞在局部淋巴结中存在细胞-细胞接触现象[7-10]。其次,Ba 在体内外研究中发现可摄取可溶性抗原卵清蛋白(ovalbumin,OVA)。再次,体内、外研究发现Ba可表达共刺激分子CD80、CD86、CD40,并在IgE/抗原复合物刺激下即刻大量释放IL-4[4-6,11-12],在体外也证实了Ba 可通过IL-4自分泌形式(无外源性IL-4的条件下)单独促进Th2细胞分化的结果[4-6,8-9,12-13]。最后在哮喘、过敏性皮炎等动物模型中,采用特异性抗体剔除循环Ba可显著抑制变应原特异性Th2细胞产生,并伴sIgE水平降低和气道过敏性炎症减轻[11-12]。相反,回输体外OVA“致敏”Ba到正常小鼠后可产生OVA-sIgE和OVA特异性Th2细胞并产生过敏性气道炎症[11-12],这些体内、外研究充分表明Ba通过抗原递呈功能在Th 2 免疫应答始动阶段起着关键作用。但有学者认为Ba这种抗原递呈功能不是专职的,Ba无法递呈不溶性抗原成分,因此其抗原递呈功能比较单一[14]。一些研究发现尽管Ba表面可以检测到MHC-II分子蛋白成分,但无法在mRNA水平检测到MHC-II分子或仅检测到低水平表达[3,15]。进一步研究发现Ba通过胞啃作用(trogocytosis)机制从DCs获得MHC-II-肽段[14,16]。因而,目前推测Ba可能通过3种不同模式参与始动Th 2 免疫应答[17]:①Ba 通过抗原递呈功能,表达共刺激分子,分泌早期“IL-4”单独启动Th2细胞定向分化;②Ba通过分泌IL-4等促Th2类细胞因子辅助树突状细胞(dendritic cells,DCs)启动Th2细胞定向分化;③Ba还可以通过胞啃作用机制从DCs 获得MHC II-肽段进而发挥其抗原递呈细胞功能[8,16]。
1.2 记忆性免疫应答
Ba研究的另一关注点是其对记忆性免疫应答中的作用。研究提示Ba在记忆性免疫应答中起着重要作用[8-9,18]。首先,在动物模型中输入或剔除Ba可显著影响记忆性Th2免疫应答,而将Ba输入到OVA致敏小鼠可显著增强记忆性Th 2 免疫应答[19]。其次,体外研究发现,将来源于OVA致敏激发后小鼠肺组织中的Ba与肺组织效应性T细胞共培养可显著延长T 细胞存活时间,促进单细胞水平的Th 2 细胞因子表达[19]。而且,人Ba在体外也可增强记忆性Th2细胞分泌IL-4[9,19]。再者,Ba参与Th2免疫应答涉及细胞间相互接触。在Th2免疫应答模型中观察到Ba在受感染组织与记忆性T 细胞有着动态接触,并增强记忆性T细胞释放IL-4[7]。除Ba增强Th2免疫应答外,活化的Ba在体外可在没有DCs参与下增强记忆性Th17反应[20-21],而Th17则是参与过敏性气道炎症的重要免疫细胞[22-23]。Ba还可通过促进B细胞增殖和抗体产生增强记忆性B 细胞免疫应答[24-26]。可见,Ba在增强记忆性T细胞、记忆性体液免疫,尤其是记忆性Th2免疫应答中起着重要作用,然而Ba以何种机制参与记忆性Th2免疫应答仍未阐明。
2 临床应用
过敏性疾病如哮喘、变应性鼻炎等是儿童时期常见疾病,其发病率呈逐年升高趋势。在过敏性疾病的诊治中临床医师经常困惑的问题是:是不是过敏?是什么过敏?以及治疗后会不会再过敏?这些问题的核心是可靠的诊断手段以及监测病情变化的可靠生物学标记。大量临床研究表明基于嗜碱性粒细胞活化状态的嗜碱性粒细胞活化试验(basophil activation test,BAT)在过敏性疾病诊断以及病情监测中具有很好的临床应用前景。
2.1 嗜碱性粒细胞活化试验
Ba 和肥大细胞是I 型变态反应中的关键效应细胞,两种细胞表面都表达IgE 高亲和力受体FcεRI[27]。在致敏个体中,高亲和力IgE 受体和变应原特异性IgE(specific IgE,sIgE)结合,当接触变应原时通过sIgE和膜高亲和力IgE受体结合交联而脱颗粒,并迅速上调活化标记CD63(定位于溶酶体的一种膜蛋白,脱颗粒过程中CD63向细胞膜移位)和CD 203 c,通过流式细胞仪检测这些特异性表面标记表达情况可判断机体是否存在对特定变应原过敏[28]。由于肥大细胞主要存在于组织,无法直接检测肥大细胞脱颗粒现象。而Ba尽管在外周血中含量少,但仍然可以利用特异性表面标记通过流式细胞仪检测。BAT就是利用Ba的生物 学特点基于流式细胞术而开发的检测方法。BAT是一种体外功能试验,体外模拟I型变态反应并测量变应原刺激后Ba脱颗粒的程度。Ba活性有两种常用的测量方法:Ba反应性(对特定变应原刺激产生脱颗粒反应的Ba 数量)和Ba变应原敏感性阈值(basophil allergen threshold sensitivity,CD-sens,50%Ba对特定变应原发生脱颗粒时的变应原浓度),前者主要应用于过敏性疾病的诊断,而后者主要用于监测过敏性疾病治疗评估及对变应原耐受的自然进程。BAT是一种功能性分析,其结果不仅取决于sIgE的数量,还取决于其亲和力,取决于是否存在其他同型抗体(如IgG4)[28-30]。
2.2 BAT在食物过敏中的应用价值
食物过敏是儿童时期常见过敏性疾病,表现为口腔过敏综合征、胃肠道过敏反应、荨麻疹、湿疹、鼻结膜过敏、支气管痉挛的多系统表现[31-32]。目前食物过敏诊断基于临床病史结合血液中sIgE和/或皮肤点刺试验(skin prick test,SPT)结果。口服食物激发试验(oral food challenge,OFC)是诊断食物过敏的金标准。其中sIgE和SPT这两种检测方法灵敏度高但特异性低,阳性变应原不一定是引起食物过敏的真正变应原,不能区分致敏和过敏,给临床判断是否存在该类食物过敏带来困惑。作为诊断食物过敏金标准的OFC由于不仅耗时而且存在严重过敏反应的风险,临床上较少采用[32-33]。因而临床上需要一种灵敏度和特异度高且风险小的诊断方法。临床研究发现BAT作为一种模拟体外过敏反应的检测手段是一种很有希望取代OFC 的诊断方法。BAT 已被验证用于IgE 介导的食物过敏诊断,并显示出高度的灵敏度和特异度。BAT 诊断食物过敏的准确性高于sIgE和SPT,特异度在75%到100%之间,灵敏度在77%到98%之间[34]。不仅如此,BAT还能够将临床过敏患者与致敏但耐受的患者区分开来[35-36]。除此之外,Ba反应性还有助于区分能否耐受加热处理的牛奶和鸡蛋变应原[37-39]。由于是体外诊断方法,BAT 没有任何引起严重过敏反应的风险。因而BAT在食物过敏诊断中有着传统诊断方法所不具备的优势,极具临床应用前景。
2.3 BAT在药物过敏中的应用价值
药物过敏是一个重要的健康问题,诊断错误会造成严重后果。一方面假阳性结果导致不必要的药物回避,造成临床上用药困难;另一方面假阴性结果可能会造成药物过敏,产生更为严重的后果。因而准确判断药物过敏在临床工作中尤为重要。目前药物过敏诊断手段主要有药物皮肤试验、特异性IgE 以及药物激发试验等,前两种诊断方法总体上特异度和灵敏度通常比较低,皮试假阳性率高,特异度IgE灵敏度低[40-41]。药物激发试验是诊断药物过敏的金标准,但存在发生严重过敏反应风险[41]。BAT 在药物过敏诊断中的研究较为深入和广泛,涉及多种类药物。研究发现BAT 在诊断神经肌肉阻滞、β-内酰胺类抗生素、喹诺酮类抗生素、造影剂,非甾体抗炎药药物过敏中有着较高灵敏度和特异度。如在诊断神经肌肉阻滞过敏中其灵敏度、特异度、阳性预测值(PPV)和阴性预测值(NPV)通常分别在50%~100%、85%~90%、85%~100%和55%~80%之间。对于β-内酰胺类抗生素,其灵敏度、特异度、PPV 和NPV 则分别在30%~55%、80%~100%、50%~90%、55%左右[42]。尤为重要的是BAT 可检测出皮肤试验阴性的药物过敏患者[43-45]。BAT 还可应用于发现药物交叉过敏反应。不像药物皮肤试验和特异性IgE 检测,其检测受到变应原皮试液和检测试剂限制,只能对有限的药物进行检测,BAT则没有上述限制,几乎对所有可疑药物进行检测。另外,和食物过敏诊断一样,BAT作为体外诊断方法没有安全性顾虑。
2.4 BAT在预测输血过敏反应中的应用价值
输血反应是临床上可危及生命的急重症,其中输血过程中引起的输血过敏反应(allergic transfusion reactions,ATRs)目前仍无检测手段早期发现并予以预防。近来,有限临床研究发现被动免疫BAT(passive immune basophil activation test,pi-BAT)可预测输血过程中的过敏反应[46-47]。其原理是分离正常人嗜碱性粒细胞并脱去细胞表面IgE,加入受体血浆和配体血浆,在出现过敏反应患者中存在变应原特异性IgE,配体血浆中存在变应原,因而可通过IgE/FcεR受体通路活化嗜碱性粒细胞。Yasui等[46]在对9 例无ATRs 和22 例ATRs 病例进行pi-BAT 检测,发现10例中重度ATRs病例中有9例pi-BAT阳性,而9例无ATRs中pi-BAT检测均为阴性。该研究为临床识别潜在ATRs 患者,尤其是中重度ATRs 患者提供了有效手段。但pi-BAT 在预测ATRs 中的临床价值仍有待大样本临床研究。
另外,BAT 在慢性荨麻疹[48-49]、局部变应性鼻炎[50]、昆虫毒液过敏[51]等多种过敏性疾病的诊断中有着诊断价值。
2.5 BAT在监测过敏性疾病及治疗评估的价值
Ba敏感性是一种稳定且可重复的测量方法,可用于评估变应原特异性免疫治疗(allergen specific immunotherapy,AIT)及生物制剂治疗的疗效。研究发现在AIT 治疗过程中,随着患者对变应原耐受性增加Ba对相应变应原的敏感性显著降低。AIT后Ba变应原敏感性的降低是由于sIgG(尤其是IgG4)升高,sIgG可与细胞结合的sIgE竞争变应原,导致Ba对相应变应原敏感性降低。食物过敏进行免疫治疗过程中,Ba对相应食物变应原的反应性在治疗期间降低,因而可作为食物过敏免疫治疗的临床反应的监测手段。在毒液特异性免疫治疗中,患者外周血Ba对相应毒素的敏感性显著下降,而Ba敏感性持续维持高水平患者在停止免疫治疗后出现过敏风险显著增加[52]。
生物制剂是过敏性疾病治疗的重要手段。研究发现BAT在监测生物制剂治疗反应中有着显著临床价值。研究发现在使用奥马珠单抗治疗期间,反映Ba敏感性的指标CD-sens显著下降,而停止治疗后恢复到预处理水平。在奥马珠单抗治疗牛奶过敏的儿童中Ba 对牛奶敏感性的改善可预测其对牛奶耐受结局[53]。在哮喘患者,Ba敏感性还可用于识别对该治疗有反应的患者和评估治疗效果。
嗜碱性粒细胞作为生物标记物其在哮喘管理中的作用仍在探索中。喘息症状在儿童时期十分常见,其中既有急性呼吸道感染诱发的哮喘急性发作,也有单纯呼吸道感染诱发的喘息性支气管炎,临床上无法通过喘息症状来诊断哮喘[54-55]。目前小年龄儿童哮喘诊断、治疗主要基于其喘息发作频率以及按改良哮喘预测指数(mAPI)预测是否存在哮喘高危风险而做出[56-58]。然而基于mAPI的哮喘预测阳性率为60%~70%,有较高的漏诊率[59-61]。为此笔者团队通过建立反复喘息儿童的队列,探讨外周血嗜碱性粒细胞活化状态在早期诊断哮喘中的价值。通过2年随访笔者团队发现诊断哮喘的喘息儿童中以CD63或CD203c为标记的嗜碱性粒细胞活化试验阳性率(CD63-BAT或CD203c-BAT)显著高于未诊断哮喘的喘息儿童,哮喘阳性预测值均高于传统API的阳性预测值[62]。当然,由于研究是小样本探索性研究,研究结论有待大样本临床研究进一步确定。
2.6 BAT在过敏性疾病中应用的优点和不足
BAT 的优势十分明显,如需要血标本量少;检测时间短,适合快速诊断报告;灵敏度和特异度高;结果直观,可动态监测;体外模仿过敏反应过程,结果可靠且可避免过敏原激发造成的风险等。BAT的缺点在于检测费用高,临床尚不能普及;嗜碱性粒细胞易受外界因素干扰,操作要求高;不适合多种过敏原筛查;缺乏充分临床研究数据以确定正常范围;约 5%~10%人群嗜碱性粒细胞对刺激物反应等。因而BAT 适合以下情况:①已知SPT 引起假阳性;②缺乏相应试剂用于SPT 或sIgE 检测;③症状和SPT 结果不一致;④SPT 可能会导致严重过敏反应;⑤激发试验前评估可能变应原。
3 总结与展望
Ba是一类含量较少的重要免疫细胞,其在Th2免疫应答和过敏性疾病中起着重要作用,但是其是否具备专业抗原递呈细胞功能仍有争议。目前认为Ba可能通过单独或与DCs相互配合(分泌IL-4及通过细胞啃作用从DCs获得MHC-II类分子)参与Th2免疫应答的始动环节。另外Ba在体内外均有增强记忆性Th2、Th17细胞现象,但具体机制仍未阐明,有待进一步研究明确。作为过敏反应的重要效应细胞,嗜碱性粒细胞在临床中的应用价值越来越引起关注。BAT目前处于临床应用前的探索阶段,尚未广泛应用于临床。临床研究发现BAT在多种过敏性疾病的诊断中有着敏感性和特异性高且可避免过敏原激发造成的风险的独特优势,有望在不久的将来成为诊断过敏性疾病的重要手段(图1)。而基于BAT 原理发展而来的CD-sens在监测过敏性疾病进程、SIT和生物制剂疗效中具有作为生物学标记的潜在价值,但仍然需要大样本临床研究明确。
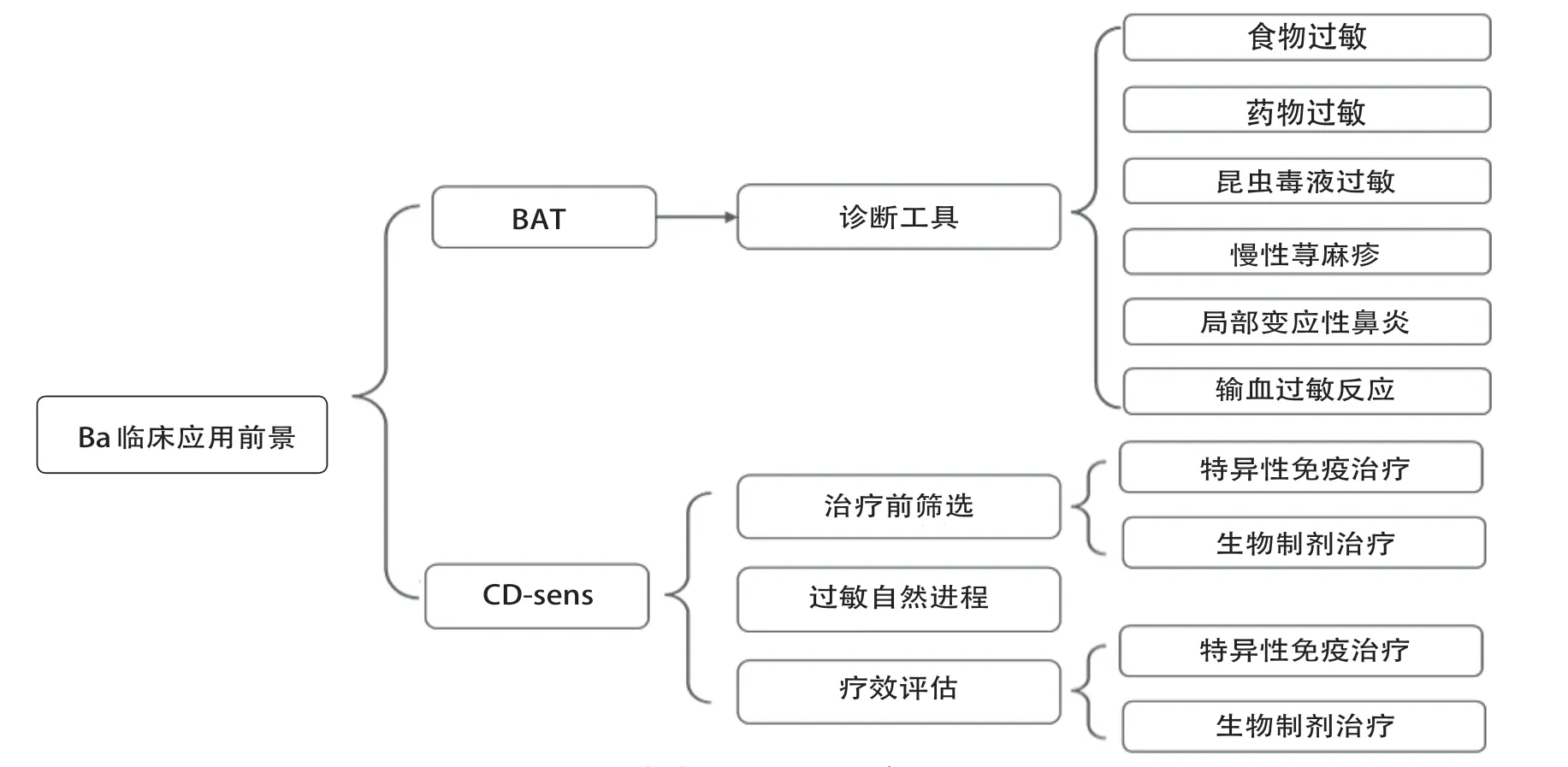
图1 嗜碱性粒细胞临床应用前景

