马铃薯氮代谢对低氮胁迫的响应及转录组分析
张婷婷,孟丽丽,刘晓蕊,陈有君,刘坤雨,袁昊田,蒙美莲
(1内蒙古农业大学 a农学院,b生命科学学院,内蒙古 呼和浩特 010018;2内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031;3沧州师范学院 生命科学学院,河北 沧州 061001)
氮(N)是作物生长发育的必需元素,氮肥可以促进农作物的生长,提高产量。但无节制地追求高产,投入的氮肥逐渐增多,不但会造成氮效率降低、生产成本增加,还会引起环境污染[1]。因此迫切需要降低氮肥施用量,提高氮效率。马铃薯作为重要的粮食兼经济作物,对我国粮食安全的作用不容忽视。缺氮会导致马铃薯生长发育迟缓、产量降低[2],但由于马铃薯根系较浅,不易吸收根层以下的氮肥,大量施氮又极易造成硝酸盐淋失风险[3],因此培育氮效率高、耐低氮能力强的马铃薯品种成为研究热点[4-7]。
利用马铃薯固有的生物学特性,深入研究植株体内氮循环过程,挖掘其自身高效吸收利用氮素的潜力,对实现马铃薯氮素资源高效利用具有重要意义。不同品种之间的氮效率存在显著差异,这与马铃薯植株对氮的吸收和利用能力不同有关[6-7]。参与马铃薯氮吸收、同化、再利用的关键酶/基因主要是硝酸盐转运蛋白 (NRT)、硝酸还原酶(NR)、亚硝酸还原酶(NiR)、谷氨酰胺合成酶(GS)、谷氨酸合成酶(GOGAT)等[8]。前人研究表明,氮高效品种的NR和GS活性高于氮低效品种,减少施氮量,酶活性降低,但不同品种下降的幅度不同[8-9]。低氮胁迫下,NRT表达量上调,NR、NiR、GS、GOGAT等表达量下降[8,10-12]。这些研究结果表明,植株可通过调节氮代谢相关基因的表达来实现植株适应低氮胁迫的不利环境。
此外,RNA测序技术已在多种作物中被证明可以挖掘参与氮基因网络的基因及转录因子,前人已对水稻、玉米、小麦等作物从氮源、品种、组织器官等方面进行了大量的研究[13-18]。与之相比,马铃薯的相关研究还较少,针对马铃薯响应低氮胁迫相关潜在基因的知识非常有限[19]。随着测序技术的进步和测序成本的降低,系统全面揭示与氮素相关的功能基因、了解不同氮效率品种各器官响应低氮的分子机制成为可能。因此,本研究以氮高效马铃薯品种冀张薯12号和氮低效马铃薯品种尤佳70为材料,采用盆栽试验方式,研究低氮胁迫下不同氮效率品种的生物量和氮代谢生理的变化,探究不同氮效率马铃薯品种氮代谢对低氮胁迫的响应及分子机制,以期进一步挖掘马铃薯氮效率相关基因,为其氮高效育种及高产栽培提供理论依据。
1 材料与方法
1.1 试验材料
供试材料为内蒙古农业大学马铃薯作物栽培研究组选出的氮高效马铃薯品种冀张薯12号和氮低效马铃薯品种尤佳70[20],种薯分别由内蒙古铃田生物技术有限公司和内蒙古坤元太和农业科技有限公司提供。
1.2 试验处理
试验在内蒙古农业大学防雨棚进行。将冀张薯12号和尤佳70种薯种植于装有9 L蛭石与珍珠岩(体积比5∶1)混合物的专用盆(高27 cm,直径30 cm)中,每盆播种大小均匀的微型薯3粒。出苗前每隔3 d浇1 000 mL水,出苗后浇灌改进的MS营养液,对照组营养液中含纯氮15 mmol/L(正常施氮,N),处理组营养液中含纯氮3 mmol/L(低氮胁迫,L),2种氮处理中氮源均为NH4NO3,其他成分相同,每3 d浇1 000 mL。试验共4个处理,每个处理种植30盆,共种植120盆。
1.3 马铃薯茎叶和根系干质量、氮积累量及氮代谢相关酶活性的测定
马铃薯出苗后30 d取样,每处理3次重复,每重复3株。将茎叶和根分开,在105 ℃条件下杀青后,70 ℃烘干至恒质量测定干质量。采用凯氏定氮法测定样品氮含量,计算氮积累量。
采集倒四叶顶小叶和根系(顶端2 cm),用于氮代谢相关酶(NR、NiR、GS、GOGAT)活性的测定,每处理3次重复,每重复10株。NR活性测定采用活体法[21],NiR活性测定采用索莱宝公司试剂盒,GS和GOGAT活性测定采用文献[21]的方法。
1.4 马铃薯转录组测序
1.4.1 cDNA文库的构建及转录组测序 出苗后30 d取倒四叶顶小叶、根系(顶端2 cm)用于构建cDNA文库及转录组测序。样本共24个(2个氮水平×2个器官(叶片、根系)×2个马铃薯品种×3次重复),样品编号规则为氮水平-器官-品种,其中氮水平中L代表低氮,N代表正常施氮;部位中L代表叶片,R代表根系;品种中Y代表尤佳70,J代表冀张薯12号。样品cDNA由北京诺禾致源生物科技有限公司制备,然后进行转录组测序。所得原始数据(raw reads)经过滤得到有效数据(clean reads),利用ToPHat2软件与已公布的马铃薯基因组比对得到总映射(total mapped)和唯一映射(uni-quely mapped)。
1.4.2 差异基因的筛选 利用DESeq进行差异基因分析,筛选出样本间的差异表达基因(differentia-lly expressed genes,DEGs),差异表达基因的筛选条件为padj<0.05。
1.4.3 差异表达基因的功能注释与分析 筛选到的差异表达基因利用软件GOseq进行GO富集分析,以Q值≤0.05为阈值,满足此条件的GO术语定义为显著富集的GO术语。利用KOBAS(2.0)将筛选到的差异基因,在KEGG数据库(kyoto encyclopedia of gene and genomes,京都基因与基因组百科全书)中进行注释,P值≤0.05,表示该通路显著富集。
1.5 数据统计分析
采用Excel 2016进行数据处理和绘图。应用SPSS 20.0进行数据方差分析,采用Duncan’s多重比较法检验处理间的差异显著性(P<0.05)。试验数据为3次重复的均值,用“平均值±标准误”表示。
2 结果与分析
2.1 低氮胁迫对马铃薯植株干质量和氮积累量的影响
由图1可以看出,2个施氮量下冀张薯12号茎叶和根系的干质量、氮积累量均显著大于尤佳70(P<0.05)。与正常施氮相比,低氮胁迫下2个马铃薯品种茎叶和根系的干质量、氮积累量均显著降低(P<0.05),尤佳70和冀张薯12号的茎叶干质量分别下降了67.69%和53.40%,根系干质量分别下降了36.48%和34.21%;茎叶氮积累量分别下降了71.55%和58.88%,根系氮积累量分别下降了45.03%和41.54%。

图柱上标不同小写字母表示不同处理间差异显著(P<0.05)
2.2 低氮胁迫对马铃薯氮代谢相关酶活性的影响
由表1可以看出,2个施氮量下冀张薯12号叶片和根系的4个氮代谢相关酶活性均高于尤佳70。与正常施氮相比,低氮胁迫下2个马铃薯品种叶片和根系NR、NiR活性均表现出降低趋势,其中尤佳70和冀张薯12号叶片NR活性分别显著降低17.50%和10.98%(P<0.05),根系NR活性分别降低17.25%和13.11%,叶片NiR活性分别显著降低15.91%和14.07%(P<0.05),根系NiR活性分别降低2.99%和11.05%。与正常施氮相比,低氮胁迫下尤佳70叶片GS活性显著降低24.72%(P<0.05),而冀张薯12号则提高了2.97%;尤佳70和冀张薯12号根系GS活性分别显著提高了18.67%和20.67%。与正常施氮相比,低氮胁迫下尤佳70叶片GOGAT活性显著降低36.51%(P<0.05),冀张薯12号仅下降了2.96%;尤佳70根系GOGAT活性显著降低46.91%(P<0.05),而冀张薯12号根系GOGAT活性升高8.16%,但差异未达显著水平。
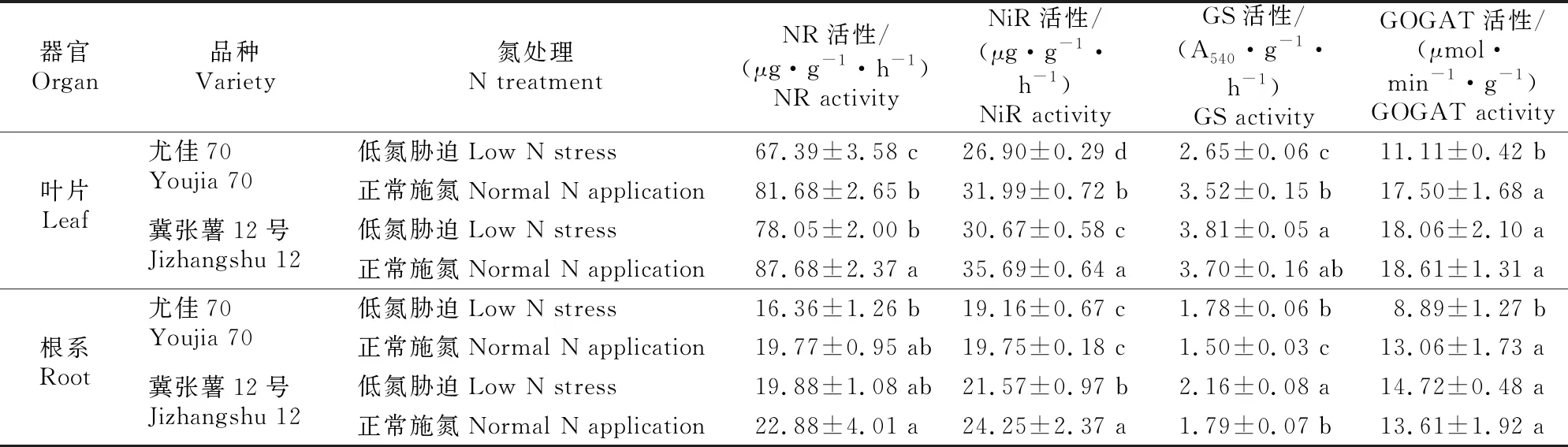
表1 不同施氮量下马铃薯氮代谢相关酶活性
2.3 马铃薯转录组测序结果评估
由表2可知,在RNA序列中,过滤后得到的有效数据为43 859 247~51 408 264,Q30比例(测序错误率<0.1%)在92.99%~93.87%,GC比例均大于42%,说明测序结果质量良好。将测定结果与已公布的马铃薯基因组数据库进行比对,结果发现有83.76%~86.50%的测序序列能映射到基因组,唯一映射率为81.36%~83.65%。

表2 马铃薯转录组数据质量统计
2.4 马铃薯氮胁迫差异表达基因分析
由图2-A可以看出,尤佳70叶片和根系中差异表达基因数分别有6 173个和249个,冀张薯12号叶片和根系中差异表达基因数分别有3 455个和1 990个。绘制韦恩图确定2个马铃薯品种响应氮胁迫共有和特有的差异表达基因数,结果(图2-B)表明,在尤佳70与冀张薯12号叶片和根系中共有的差异表达基因数分别为1 847个和163个,叶片中响应低氮处理的差异表达基因数多于根系;且2个马铃薯品种叶片和根系对低氮处理的反应有所不同,在叶片中尤佳70的差异表达基因数多于冀张薯12号,在根系中则是冀张薯12号的差异表达基因数多于尤佳70。

LLY vs NLY.尤佳70叶片;LLJ vs NLJ.冀张薯12号叶片;LRY vs NRY.尤佳70根系;LRJ vs NRJ.冀张薯12号根系
由图3和图4可以看出,在LLY vs NLY和LLJ vs NLJ 2个对比组富集最为显著的前20个“生物过程”中,小分子代谢过程、有机酸代谢过程、单一生物代谢过程、羧酸代谢过程、氧酸代谢过程、对非生物刺激的反应两组均有;另外在LLY vs NLY中显著富集的还有运输、光合作用等生物过程,在LLJ vs NLJ中显著富集的还有翻译、肽代谢过程、蛋白质代谢过程、α-氨基酸代谢过程等生物过程。在LRY vs NRY和LRJ vs NRJ对比组中,显著富集的生物过程相同的仅有单一生物过程。说明尤佳70和冀张薯12号叶片和根系均产生了一系列相同的反应以适应氮胁迫,但由于品种和器官的差异性,响应过程也有特异性。

图3 不同马铃薯品种叶片中氮胁迫差异表达基因的GO富集

图4 不同马铃薯品种根系中氮胁迫差异表达基因的GO富集
由图5可知,LLY vs NLY和LLJ vs NLJ中差异表达基因显著富集的通路分别有15条和4条,相同的有氨基酸生物合成,仅在LLY vs NLY中显著富集的有光合生物的固碳作用、碳代谢、卟啉与叶绿素代谢等。LRY vs NRY和LRJ vs NRJ中差异表达基因显著富集的通路分别有8条和12条,相同的有5条,包括类胡萝卜素生物合成、玉米素生物合成、次级代谢产物的生物合成、苯丙烷生物合成、类固醇生物合成;仅在LRY vs NRY中显著富集的有植物激素信号转导等,仅在LRJ vs NRJ中显著富集的有谷胱甘肽代谢、氮代谢等。
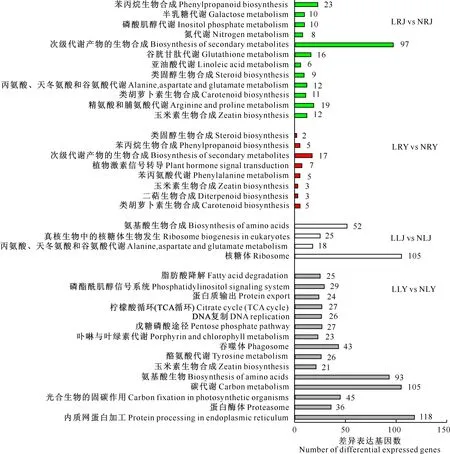
图5 不同马铃薯品种叶片和根系中氮胁迫差异表达基因显著富集的KEGG通路
2.5 马铃薯叶片和根系氮代谢途径对缺氮的响应
由图6可以看出,LRY vs NRY和LRJ vs NRJ 2个对比组中分别有1个和8个差异表达基因富集到氮代谢通路。LRY vs NRY中编码高亲和力NRT(PGSC0003DMG400019675)的基因显著上调表达。LRJ vs NRJ中编码高亲和力NRT(PGSC-0003DMG400016996)、GS(PGSC0003DMG4000-13235)、Fd-谷氨酸合成酶(PGSC0003DMG40000-9698)等的基因显著上调表达,编码NiR(PGSC-0003DMG400008262)、谷氨酸脱氢酶(PGSC0003-DMG400008344)的基因显著下调表达。LLY vs NLY和LLJ vs NLJ 2个对比组中分别有11个和8个差异表达基因富集到氮代谢通路,编码高亲和力NRT(PGSC0003DMG400006913、PGSC0003DMG-400016996)和GS(PGSC0003DMG400013-235)的3个基因在2个品种中均上调表达,其中PGSC-0003DMG400016996、PGSC0003DMG400013235在LLJ vs NLJ对比组中上调的倍数要大;编码NiR(PGSC0003DMG-400025823)的基因在2个品种中均下调表达。LLY vs NLY中编码谷氨酸脱氢酶(PGSC0003DMG-400016001)的基因显著上调表达,编码GS(PGSC0003DMG400004355)、GO-GAT(PGSC0003DMG400009698)的基因显著下调表达。LLJ vs NLJ中编码谷氨酸脱氢酶(PGSC0003DMG-400008356)、GS(PGSC0003DMG-400014592)的基因显著上调表达,编码NiR(PGSC0003DMG-400008262)的基因显著下调表达。

图中每一横排都表示1个基因,横排4个方格依次表示LRY vs NRY、LRJ vs NRJ、LLY vs NLY和LLJ vs NLJ。方格中颜色越红,代表基因上调倍数越大,方格中颜色越绿,代表基因下调倍数越大,ns代表基因变化不显著
2.6 马铃薯叶片氨基酸代谢途径对缺氮的响应
由表3可知,在氨基酸代谢中,LLY vs NLY对比组中半胱氨酸和蛋氨酸代谢的差异表达基因数量排在首位,有31个;LLJ vs NLJ对比组中精氨酸和脯氨酸代谢的差异表达基因数量最多,有22个。LLY vs NLY和LLJ vs NLJ 2个对比组中涉及上调差异表达基因最多的均是苯丙氨酸代谢(22个和16个),涉及下调差异表达基因最多的均是半胱氨酸和蛋氨酸代谢(16个和11个)。由图7可知,LLY vs NLY对比组苯丙氨酸代谢中,编码苯丙氨酸解氨酶(PGSC0003DMG400019386)、肉桂酸-4-羟化酶(PGSC0003DMG401030469)、4-香豆酸-CoA连接酶(PGSC0003DMG400008122)的基因显著上调表达;LLJ vs NLJ对比组苯丙氨酸代谢中,编码苯丙氨酸解氨酶(PGSC0003DMG400019386、PGSC-0003DMG401021549、PGSC0003DMG40202156-4、PGSC0003DMG402021549、PGSC0003DMG40002-3458、PGSC0003DMG400031457)、肉桂酸-4-羟化酶(PGSC0003DMG402030469)、4-香豆酸-CoA连接酶(PGSC0003DMG400003155)基因显著上调表达。PGSC0003DMG400019386的log 2(FoldChange)水平在LLJ vs NLJ对比组中较高。LLY vs NLY对比组半胱氨酸和蛋氨酸代谢中,编码丝氨酸O-乙酰转移酶(PGSC0003DMG400001573、PGSC0003-DMG400022181、PGSC0003DMG4000-14379)和半胱氨酸合成酶(PGSC0003DMG400-023171、Nove-l00452)的基因显著下调表达;LLJ vs NLJ对比组半胱氨酸和蛋氨酸代谢中,编码丝氨酸O-乙酰转移酶(PGSC0003DMG400014379、PGSC0003DMG-400022181)的基因显著下调表达,但编码半胱氨酸合成酶的基因未发生显著变化。

表3 低氮胁迫对尤佳70和冀张薯12号叶片氨基酸代谢相关KEGG通路的影响

A.半胱氨酸和蛋氨酸代谢差异表达基因;B.苯丙氨酸代谢差异表达基因。横排2个方格依次表示LLY vs NLY、LLJ vs NLJ,方格中颜色越红,代表基因上调倍数越大,方格中颜色越绿,代表基因下调倍数越大,ns代表基因变化不显著
3 讨 论
3.1 不同氮效率马铃薯品种响应低氮胁迫的生理特性差异
马铃薯对缺氮非常敏感,在氮胁迫下马铃薯生长受到抑制,生物量显著下降[22]。本研究结果表明,低氮条件下,2个马铃薯品种茎叶、根系干质量和氮积累量均显著下降,但不同品种、不同器官的变化幅度存在差异,茎叶的下降幅度大于根系,冀张薯12号茎叶干质量和氮积累量的降幅小于尤佳70。说明低氮条件对马铃薯氮高效品种茎叶生长的影响小于氮低效品种,氮高效品种茎叶能维持较稳定的生长状态。
氮代谢是影响植物代谢和发育的基本生理过程,NR是氮还原过程中的第一个酶,其对氮含量反应敏感[23-24]。前人研究表明,氮高效品种的NR活性高于氮低效品种,低氮胁迫下NR活性均降低[25]。本研究中,低氮胁迫下尤佳70和冀张薯12号叶片和根系的NR活性均降低,但冀张薯12号的降幅低于尤佳70。表明NR活性与马铃薯氮效率高低有关,氮高效品种通过减小低氮胁迫下NR活性的变化幅度,保持较高的NR活性,从而有利于马铃薯植株对硝态氮的利用。亚硝酸还原酶将亚硝酸盐转化为铵,用以植物吸收利用。矫娇娇[12]研究发现,氮高效品种的NiR活性高于氮低效品种,低氮胁迫下马铃薯的NiR活性降低。本研究结果显示,低氮胁迫下2个马铃薯品种叶片和根系的NiR活性也降低,冀张薯12号根系NiR活性降低的幅度较尤佳70大,这可能与其选择更高效的同化部位有关。经NiR催化后生成的铵仍需要进一步同化,GS是其中的关键酶[26-27];GS活性与作物生物量和氮效率存在显著正相关关系[28-29]。大多数研究结果表明,氮高效品种具有较高的GS,低氮处理可以显著降低GS活性[30];但也有研究表明,低氮胁迫导致大麦根系的GS活性显著增加[31]。本研究中,低氮胁迫下尤佳70叶片GS活性显著降低,而冀张薯12号则提高;尤佳70和冀张薯12号根系GS活性均显著提高,且冀张薯12号增幅较大。表明马铃薯氮高效品种在低氮胁迫条件下具有更强的氮素同化或再同化能力,有利于提高对有限氮源的利用,稳定体内的氮量,可见GS活性在一定程度上对低氮条件下提高马铃薯氮利用效率具有更重要的意义。催化生成的谷氨酰胺由GOGAT 继续催化生成谷氨酸,该反应连接了碳氮代谢。缺氮条件下棉花氮低效品种XLZ-30的GOGAT活性降低,而氮高效品种CCRI-69无显著变化[32]。本研究中低氮胁迫下尤佳70叶片和根系的GOGAT活性显著降低,冀张薯12号的GOGAT活性变化未达差异显著水平。可见马铃薯氮高效品种在低氮胁迫条件下具有更强的氮素同化能力,可生成更多的氨基酸。
3.2 不同氮效率马铃薯品种响应低氮胁迫的转录水平差异
在本研究中,氮胁迫条件下2个马铃薯品种涉及上调差异表达基因最多的均是苯丙氨酸代谢,在冀张薯12号叶片中发现6个编码苯丙氨酸解氨酶的基因上调表达,尤佳70中只有1个,且上调倍数小于冀张薯12号。苯丙氨酸解氨酶是连接初级代谢和次级代谢的关键酶,是苯丙烷生物合成的限速酶,其在植物发育中具有重要作用,有助于植物抵抗逆境胁迫[36]。苯丙氨酸解氨酶调控介导的苯丙烷类生物合成途径,可能与低氮条件下不同品种马铃薯的氮效率差异有关。在类似的研究中,棉花CCRI-69的氮高效归因于氮缺乏条件下增强的苯丙烷类生物合成[32],所以与冀张薯12号叶片苯丙氨酸代谢途径相关的差异表达基因的上调,可能有助于提高其氮利用效率。2个马铃薯品种涉及下调差异表达基因最多的均是半胱氨酸和蛋氨酸代谢,编码丝氨酸O-乙酰转移酶的基因均显著下调表达;尤佳70中编码半胱氨酸合成酶的基因也显著下调表达,但在冀张薯12号中并未观察到显著变化。丝氨酸O-乙酰转移酶、半胱氨酸合成酶在半胱氨酸合成中起着关键作用。谷氨酸和半胱氨酸是谷胱甘肽合成的前体物质,谷胱甘肽在植物代谢和抗逆性中发挥着重要作用。低氮胁迫下,冀张薯12号叶片中氮代谢和半胱氨酸代谢途径受到的影响小于尤佳70,使得冀张薯12号谷胱甘肽的量能维持在较高水平,因此氧化还原能力增强,抗逆性提高。

