达沙替尼纳米结构脂质载体的制备与体外评价
侯甲福,刘世娟,耿艳萌,杨琦,胡泽香,谢舒,张颖*
(1.牡丹江医学院,黑龙江 牡丹江 157011;2.牡丹江医学院附属红旗医院,黑龙江 牡丹江 157011)
0 引言
虽然近十年来已经发现了大量具有多种治疗潜力的新药分子,但其中大多数仍处于研发过程中。主要是因为这类化合物的水溶性较差,从而限制了药物的生物利用度。达沙替尼(DST) 就属于这类化合物。在不影响治疗效果的情况下,开发DST 的制剂必须克服这些问题。DST 在水中溶解很差,在水中最大溶解度约为10 μg/mL[1],过低的水溶性导致生物利用度差并且不稳定[2],DST 的口服生物利用度仅为14%~34%[3]。药物溶解性差,使得对潜在药物效应的产品进行高通量筛选非常困难。因此,迫切需要改善DST 的溶解性,从而提高生物利用度。克服难溶性药物的溶解度问题有很多种方法,包括增溶、形成包合物或络合等方法,其中目前最先进的技术是纳米制剂技术。
由于纳米药物制剂有独特的优势,纳米制剂技术在世界各地蓬勃发展,各大药品生产公司生产的纳米制剂产品在不断增长,开发了大量生物相容性纳米系统,如纳米颗粒、纳米胶囊、胶束系统和偶联物。根据Noyes-Whitney 方程,纳米化的优点是通过增加难溶性化合物的表面积和浓度差,然后增加了化合物的溶解速率。此外,纳米化后饱和溶解度也增加了[4]。这些增强药物通过肠壁进入体循环,有利于水溶性差的药物的口服生物利用度。
纳米结构脂质载体(NLC)作为传统聚合物纳米颗粒的替代药物传递系统,纳米颗粒在亚微米尺寸范围内(50~1 000 nm),由可生理相容的脂质成分组成,室温情况下颗粒处于固态,结合了聚合物纳米颗粒、脂肪乳剂和脂质体的优点。
本研究采用NLC 解决难溶性药物的吸收,并提高生物利用度。而且NLC 可以通过高压均质化技术进行大规模的工业生产。NLC 像乳剂和脂质体一样具有高度的生物相容性,同时固体基质产生缓释,可以在非肠道给药后有效地靶向特定组织,并可以改善难溶性药物[5-6]口服生物利用度。通过将DST 制备成NLC 来增强溶解度,DST 加载NLC 作为靶向递送系统,可以产生更高的肿瘤细胞特异性,同时降低药物的毒副作用[5]。
1 仪器与试药
安捷伦LC1260 高效液相色谱仪;JY92-Ⅱ型细胞破碎仪(宁波新芝生物科技股份有限公司);达沙替尼(上海MACKLIN 公司);单硬脂酸甘油酯(GMS,德国BASF 公司);辛癸酸甘油酯(MCT,法国Gattefosse公司);吐温80(Tween-80,国药集团化学试剂有限公司);聚氧乙烯(35)蓖麻油(EL-35,德国BASF 公司)。
2 方法
2.1 DST-NLC 的制备
采用热熔—超声乳化法制备DST-NLC,具体操作如下:取处方量的单硬脂酸甘油酯、辛癸酸甘油酯、吐温80 置于水浴上加热75 ℃至脂质熔融,将DST 加入熔融脂质液中,搅拌溶解形成有机相,75 ℃水浴下,取处方量的聚氧乙烯蓖麻油加入蒸馏水中形成水相。然后,在磁性搅拌下,将水相滴加入油相中形成初乳。5 min 后,将溶液混合物超声15 min,然后在冰浴中快速冷却。随后,样品以15 000 r/min 离心5 min,然后用0.22 μm 微孔滤膜过滤,以去除未封装的药物。
2.2 含量测定方法
色谱条件:色谱柱Aglient HC-C18(250 mm×4.6 mm, 5 μm);柱温:35 ℃;检测波长:322 nm;流动相:乙腈-磷酸二氢钾水溶液(0.01 mol/L,NaOH 溶液调至pH=5.0)(40∶60,V/V);流速:1.0 mL/min;进样量20 μL。
方法学考察:
按规定方法操作,得线性方程y=1 578x-1 263 (r=0.999 9),在该色谱条件下本品在0.01~0.20 mg/mL 浓度范围内线性关系良好;稳定性:0 h、2 h、4 h 内稳定性良好,RSD=0.56%;精密度实验RSD=0.18% (n=6);重复性实验RSD=0.21%(n=6);加样回收率实验,高中低浓度平均回收率分别为99.67%、101.37%、99.48%,方法学考察均符合要求。
载药量与包封率测定:
精密吸取DST-NLC 样品混悬液2 mL 置于超速离心管中,12 000 r/min 高速离心40 min,取滤液,进HPLC 测定游离达沙替尼的量(C)。另取DST-NLC 混悬液2 mL,转移至50 mL 的容量瓶中,再加入30 mL乙腈超声8 min,用流动相定容至刻度,高效液相色谱法测定药物总含量(C0)。按下式计算DST-NLC 的载药量与包封率。
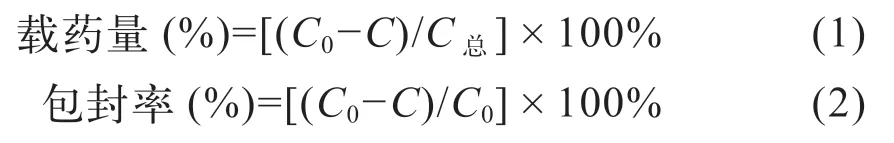
式(1)~(2) 中:C 为溶液中游离达沙替尼的量;C0为溶液中总达沙替尼的量;C总为脂质载体和总达沙替尼的量。
2.3 处方优化
在单因素考察的基础之上并结合预实验,以包封率为评价指标,以对DST-NLC 包封率影响较大的因素,固/ 液脂质比(A,单硬脂酸甘油酯/ 新癸酸甘油酯)、乳化剂用量(B)、药/ 脂比(C)、超声时间(D) 为考察因素,进行4 因素3 水平L9(34) 正交试验,筛选最佳处方,因素水平表如表1 所示。
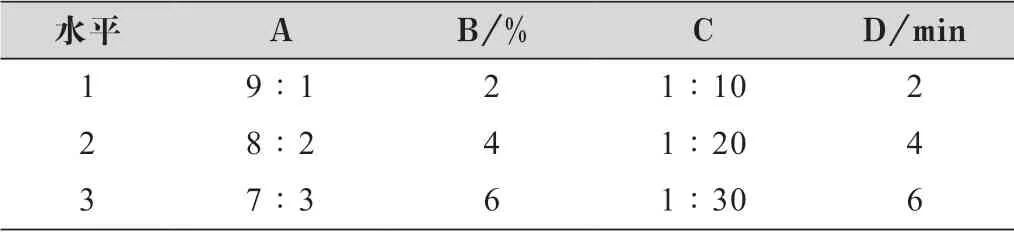
表1 DST-NLC 处方优化因素水平表
2.4 DST-NLC 体外释放度试验
采用膜透析法测定DST 混悬液、DST-NLC 的体外释放特性。分别精密量取DST 混悬液、DST-NLC 混悬液3 mL,移至透析袋(截留相对分子质量12 000~14 000)中,两端扎紧,将此透析袋置于37 ℃透析介质(磷酸盐缓冲溶液,pH=7.4)中,100 r/min。定时取样5 mL,同时补加相同量的等温释放介质,样品用0.45 μm 微孔滤膜过滤,取续滤液1 mL 加入适量流动相稀释,采用高效液相色谱法测定DST 浓度,计算DST 累计释放度(%)。
3 结果
3.1 处方优化
以DST-NLC 包封率为考察指标,处方优化正交实验设计及结果如表2 所示。
由表2 可知,根据R 数值的大小可知,该试验中各因素对包封率的影响顺序为A>B>D>C,各因素在不同水平的分析结果为A:2>3>1;B:3>2>1;C:3>1>2;D:2>3>1。根据K1、K2、K3结果中数值大小,可知最佳组合为A2B3C3D2,即最优处方是,单硬脂酸甘油酯与新癸酸甘油酯比为8∶2,乳化剂用量为6%,药/脂比为1∶30,超声时间为4 min。
3.2 体外释放度试验
DST-NLC 的体外释放曲线如图1 所示。由图可知,DST-NLC 在0~4 h 释放药物较快,能在短时间内使药物浓度升高,0~12 h 的累积释放量以达到75% 左右,对比DST 原料药,DST-NLC 溶出药量显著提高。而且,DST-NLC 前期释放较快,后期释放缓慢,具有显著的缓释特性,无论从释放速度还是缓释效果,DST-NLC 均优于DST。
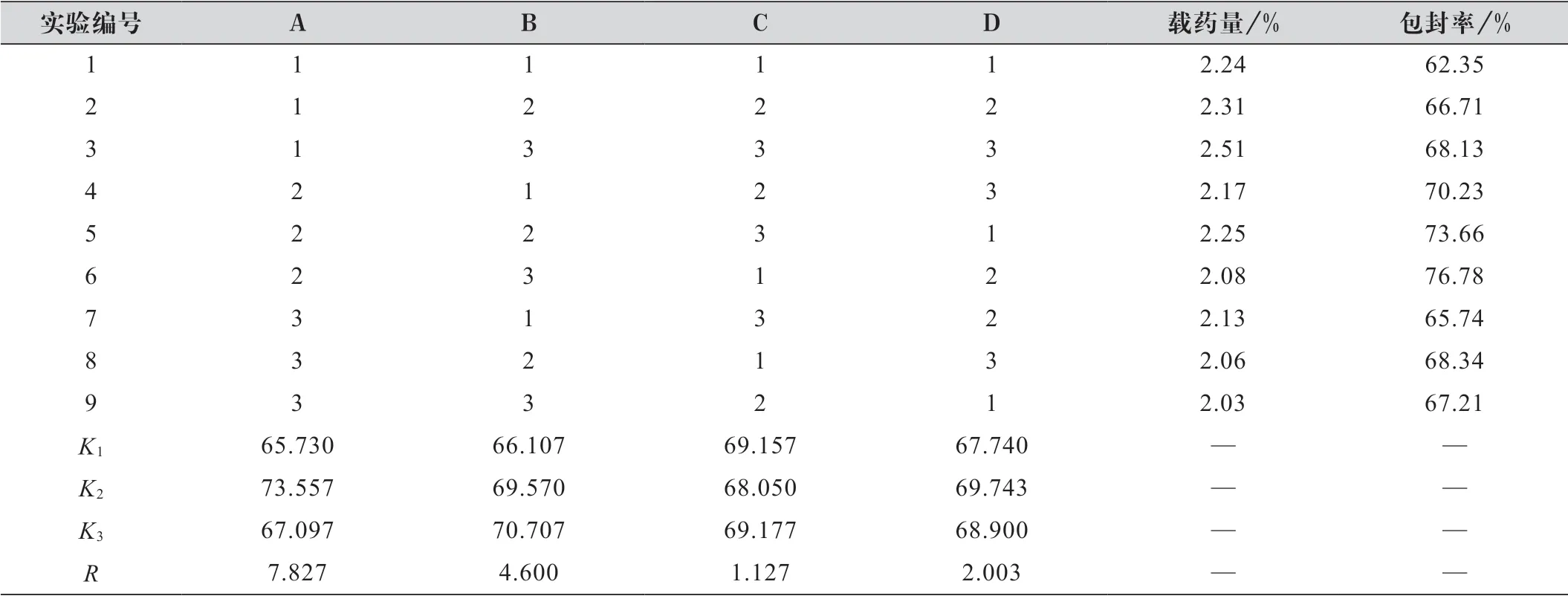
表2 DST-NLC 正交实验结果
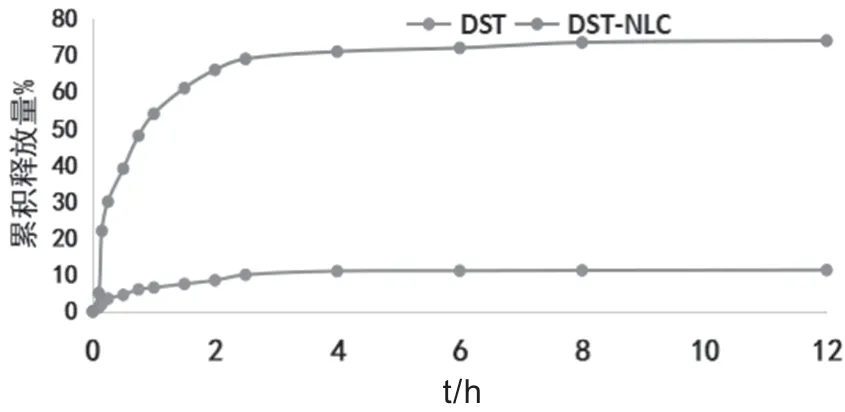
图1 DST 与DST-NLC 体外释放药物曲线
4 结语
药物的疗效有时因为各种传递不畅从而无法发挥良好药效,如药物溶解性差、药物清除速度快和各种生物屏障,可以应用各种现代制剂技术来提高药物的溶解度。然而,应谨慎避免达沙替尼的浓度依赖性毒性,通常具有缓释特性的药物传递系统可以减轻毒性。在这项研究中,达沙替尼被封装在NLC 中,NLC是一种以增强溶解度、缓释和良好的眼部生物相容性而闻名的药物传递系统。本项目采用熔融乳化超声法制备DST-NLC,在实验前期摸索中制备的NLC 相当不稳定的,并在第二天沉淀。该NLC 的不稳定性是由于zeta 电位的绝对值较小造成的,由于zeta 势意味着粒子间的斥力强度,因此zeta 势的绝对值越高,表明纳米颗粒具有更好的抗聚集性和稳定性。一般控制在约30 mV 的绝对值时是最为稳定的,足以保证NLC 的稳定性。吐温80 是一种良好的表面活性剂,在处方中添加吐温80 以增加绝对含量提高了NLC的稳定性,同时吐温80 可以极大地提高NLC 的稳定性和粒径。当加入20 mg 吐温80 后,NLC 前两天未见沉降,第三天只有少量沉降,说明NLC 的稳定性有所提高,但是吐温80 的含量仍然有些不足。因此在处方中继续增加吐温80,产品连续7 天无沉淀,第7 天的平均粒径与第1 天无显著差异[6]。
近年来,NLC 纳米结构脂质载体的潜力逐渐实现,成为一种很有前景的药物传递系统。许多具有治疗活性的药物在本质上具有高度的亲脂性。这种亲脂性活性成分在药物递送位点和靶位点的掺入和递送一直是一个值得关注的问题。结果表明,采用熔融乳化超声法将DST 制备成纳米结构脂质载体,能有效克服DST 水难溶性的问题。此外,可以推测,如果获得纳米范围的颗粒,生物利用度可能会增加。因此,NLC 被用作亲脂性药物的药物载体,通过纳米颗粒提高水难溶性的药物DST 的生物利用度。

