间充质干细胞外泌体通过TGF-β信号通路抑制成骨分化
郝铖 牟晶晶 赵彬 赵晶晶 方真华*
1.武汉市第四医院 华中科技大学同济医学院附属普爱医院,湖北 武汉 430000 2.湖北省肿瘤医院,湖北 武汉 430079
间充质干细胞(mesenchymal stem cell,MSC)是一种可分化为骨细胞、软骨细胞、脂肪细胞和内皮细胞等多种组织的多能干细胞[1]。MSC可分化为成骨细胞和内皮细胞,影响骨修复和血管生成,并可产生生长因子,通过旁分泌作用促进坏死区的血液供应[2-3]。MSC不仅在疾病的发展中起着非常重要的作用,而且还是再生治疗种子细胞的主要来源,目前认为激素性股骨头坏死(steroid-induced osteonecrosis of femoral head,SANFH)的发病机制与MSC有关[4]。外泌体是直径小于150 nm的细胞外囊泡,内容物主要有蛋白质、miRNA及脂质等[5-6]。近年来,MSC来源的外泌体可在多种组织和器官中发挥作用[1]。Guo等[7]研究证实人滑膜来源的MSC外泌体可通过增强增殖和抗凋亡作用来预防糖皮质激素诱导的大鼠SANFH。但MSC外泌体在SANFH中的作用机制仍需进一步研究。研究发现,TGF-β信号通路参与细胞增殖、分化及细胞外基质的合成等,并可调节MSC的谱系选择和向特定细胞分化的进程[8]。本研究从MSC外泌体对MSC成骨分化的影响着手,探究其与TGF-β信号通路的关系。
1 材料与方法
1.1 材料
人骨髓间充质干细胞(中国科学院上海细胞库);hMSC无血清培养液套装(中科院);DMEM-LG(HyClone公司);地塞米松(Sigma公司);成骨诱导分化基础培养基(Cyagen公司);碱性磷酸酶试剂盒(南京建成);AnnexinV-FITC/PI凋亡检测试剂盒(BD公司);SYBR FAST qPCR Master Mix(KAPA Biosystems公司);RIPA(强)组织细胞快速裂解液和BCA蛋白浓度测定试剂盒(Solarbio公司);PVDF转移膜和化学发光试剂(Millipore公司);兔抗转化生长因子-β(transforming growth factor-β,TGF-β)抗体、兔抗Smad3抗体和Runt相关转录因子2(runt-related transcription factor 2,RUNX2)抗体(Bioswamp公司)。
1.2 细胞复苏与培养
将冻存于液氮罐中的MSC置于37 ℃水浴中至完全融化。将细胞悬液转移至离心管中,400 g离心3 min,弃上清,加入1 mL培养液后转移至培养瓶中。加入4 mL完全培养基,置于37 ℃、5 % CO2培养箱内培养。MSC用hMSC无血清培养液套装培养。
1.3 外泌体提取及鉴定[9]
将MSC按5 000 cells/cm2的浓度接种于十二孔板内,在不含胎牛血清的DMEM-LG完全培养基培养48 h后,将MSC分为两组:对照组和地塞米松干预组。地塞米松干预组将10 μmol/L地塞米松[10]加入细胞培养基中,37 ℃ 5% CO2培养箱内培养72 h。
收集上述两组培养基,500 g离心10 min,收集上清。2 000 g离心20 min,收集上清,1×105g离心70 min。20 mL PBS重悬后,1×105g离心70 min。所得沉淀与PBS按照1∶20比例稀释,2 000 g离心200 min。40%蔗糖梯度1×105g离心70 min;收集上清。1×105g离心70 min,收集沉淀。最终得到两种外泌体:Exo-1(对照组MSC分泌的外泌体)和Exo-2(地塞米松干预组MSC分泌的外泌体)。电镜下观察到提取得到的细胞外囊泡形态特征为茶托样结构,且Western blot检测到外泌体标志物CD63的表达,说明分离得到了外泌体。
1.4 细胞分组与处理
取对数生长期MSC细胞在不含胎牛血清的DMEM-LG完全培养基培养24 h后,更换为成骨诱导培养基(含10%胎牛血清、0.1 μmol/L地塞米松、10 mmol/L β-甘油磷酸钠、50 mg/L L-抗坏血酸、1%青霉素及2.5 mg/L链霉素的DMEM培养基)。将MSC分为3组:对照组、Exo-1组和Exo-2组。外泌体处理组分别加入20 μg/mL Exo-1或Exo-2[11],进行成骨诱导分化培养7 d。对照组加入等量PBS正常成骨诱导分化培养7 d。
1.5 生化检测碱性磷酸酶活性
严格按照碱性磷酸酶(alkaline phosphatase,ALP)试剂盒说明书进行实验。
1.6 流式检测细胞凋亡
收集各组细胞,取约1×106个重悬,400 g、4 ℃离心5 min,弃上清。加入1 mL预冷PBS,轻轻吹打混匀,400 g、4 ℃离心5 min,弃上清。将细胞重悬于200 μL PBS,加入10 μL Annexin V-FITC和10 μL PI,轻轻混匀,4 ℃避光孵育30 min。加入300 μL PBS,随即进行流式检测。
1.7 qRT-PCR检测炎症因子及TGF-β信号通路相关基因表达
取细胞约1×106个,加1 mL Trizol提取总RNA,反转录合成cDNA,以cDNA为模板,GAPDH为内参,进行qRT-PCR检测。每组实验设3个重复,得到的数据采用2-△△Ct计算细胞中TGF-β、Smad3和RUNX2的相对表达量。引物序列见表1。
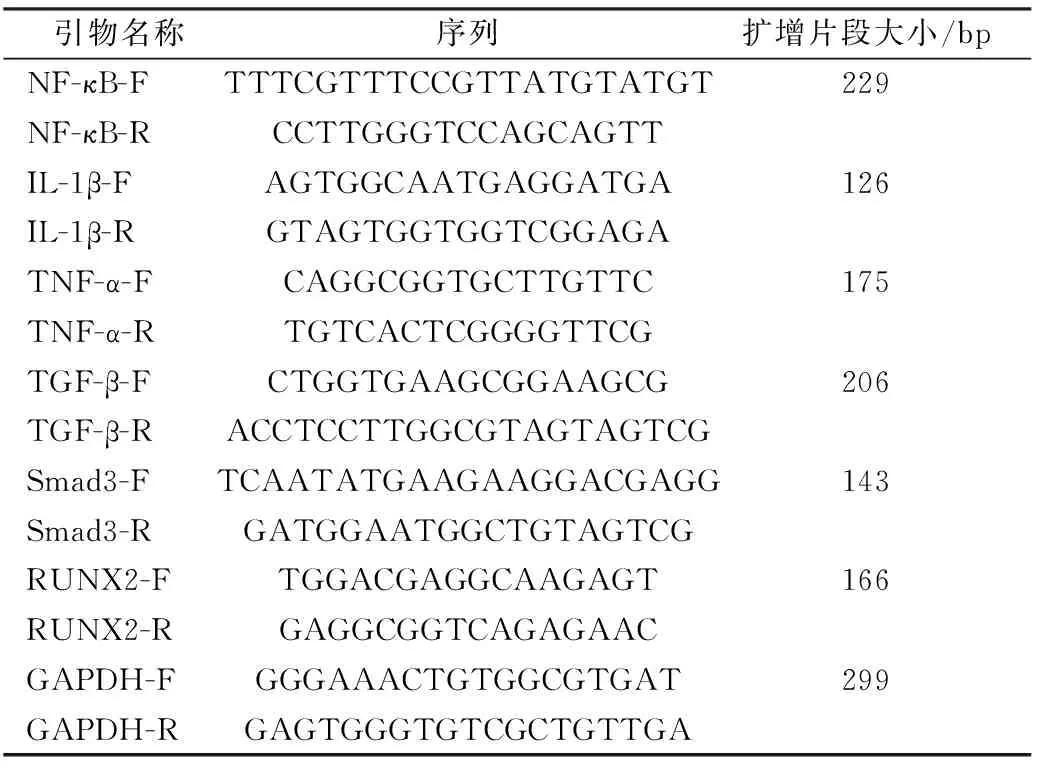
表1 引物序列Table.1 Primer sequences
1.8 Western blot检测TGF-β信号通路相关蛋白表达
收集各组细胞,用RIPA裂解液提取总蛋白,BCA蛋白浓度测定试剂盒测定蛋白浓度。以每孔20 μg蛋白上样量进行SDS-PAGE电泳。然后将蛋白转移至PCDF膜上。使用5%脱脂奶粉4 ℃封闭过夜,加入一抗TGF-β、Smad3和RUNX2(稀释比1∶1000)室温孵育1 h。用PBST洗膜,加HRP标记的二抗室温孵育1 h,用PBST漂洗后,加入化学发光试剂,曝光显影后,读取蛋白条带灰度值。
1.9 统计学分析
采用统计学软件SPSS 19.0对所得实验数据进行统计分析,结果以均值±标准差表示,多组间数据比较采用单因素方差分析(one-way ANOVA),P<0.05表示差异具有统计学意义。
2 结果
2.1 对ALP活性的影响
生化检测MSC细胞中ALP活性,结果见图1。对照组与Exo-1组ALP活性无显著差异(P>0.05)。与对照组和Exo-1相比,Exo-2组MSC细胞ALP活性显著降低(P<0.05)。表明经地塞米松(10 μmol/L)干预的MSC外泌体可显著抑制MSC成骨分化。

图1 ALP试剂盒检测ALP活性(*P<0.05 vs. Control/Exo-1)Fig.1 ALP activity was assessed with ALP kit (*P<0.05 vs Control/Exo-1)
2.2 对细胞凋亡的影响
流式检测MSC细胞凋亡率,结果见图2。对照组与Exo-1组细胞凋亡率无显著差异(P>0.05)。与对照组和Exo-1相比,Exo-2组MSC细胞凋亡率显著升高(P<0.05)。表明经地塞米松(10 μmol/L)干预的MSC外泌体可显著促进MSC凋亡。
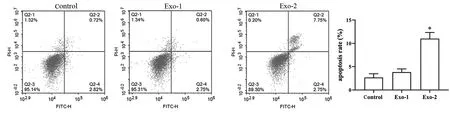
图2 流式检测细胞凋亡率(*P<0.05 vs. Control/Exo-1)Fig.2 Apoptosis rate was detected with flow cytometry (*P<0.05 vs Control/Exo-1)
2.3 对炎症因子表达的影响
qRT-PCR检测MSC细胞中炎症因子NF-κB、IL-1β和TNF-α mRNA表达量的变化,结果见图3。对照组与Exo-1组细胞中NF-κB、IL-1β和TNF-α mRNA表达量无显著差异(P>0.05)。与对照组和Exo-1相比,Exo-2组MSC细胞中NF-κB mRNA表达量显著降低(P<0.05),IL-1β和TNF-α mRNA表达量显著升高(P<0.05)。表明经地塞米松(10 μmol/L)干预的MSC外泌体可显著促进MSC炎症反应。
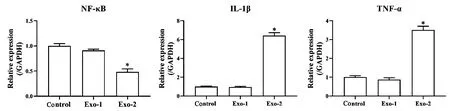
图3 qRT-PCR检测炎症因子表达(*P<0.05 vs. Control/Exo-1)Fig.3 qRT-PCR was used to detect the expression of inflammatory factors (*P<0.05 vs Control/Exo-1)
2.4 对TGF-β信号通路相关基因和蛋白表达的影响
qRT-PCR和Western blot检测TGF-β、Smad3和RUNX2 mRNA和蛋白表达量的变化,结果见图4、5。对照组与Exo-1组细胞TGF-β、Smad3和RUNX2 mRNA和蛋白表达量无显著差异(P>0.05)。与对照组和Exo-1相比,Exo-2组MSC细胞中TGF-β mRNA和蛋白表达量显著升高(P<0.05),Smad3和RUNX2 mRNA和蛋白表达量显著降低(P<0.05)。
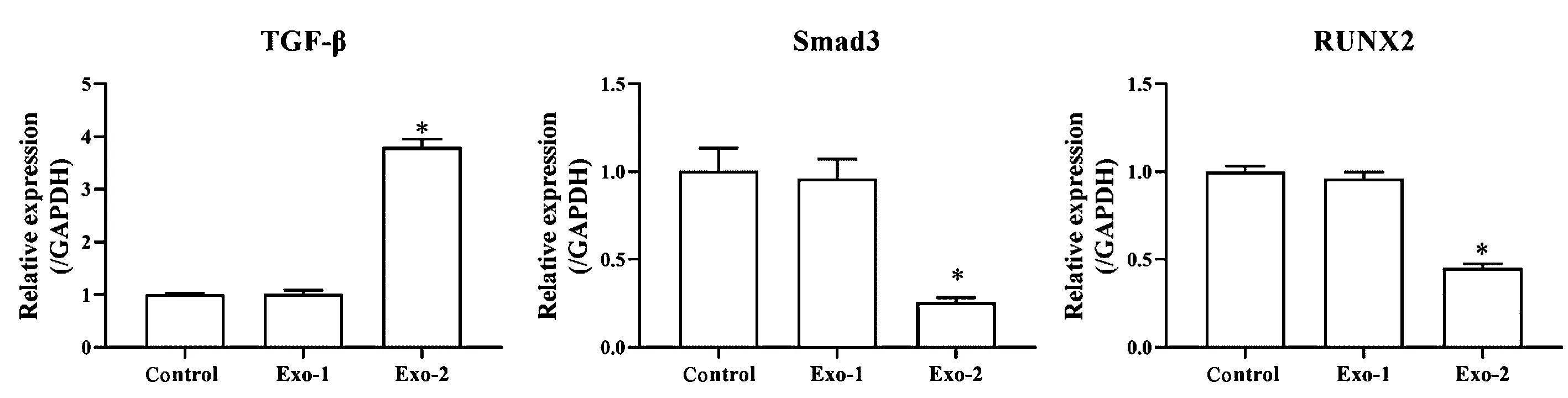
图4 qRT-PCR检测TGF-β、Smad3和RUNX2 mRNA表达(*P<0.05 vs. Control/Exo-1)Fig.4 The mRNA expressions of TGF-β, Smad3, and RUNX2 were detected with qRT-PCR (*P<0.05 vs Control/Exo-1)
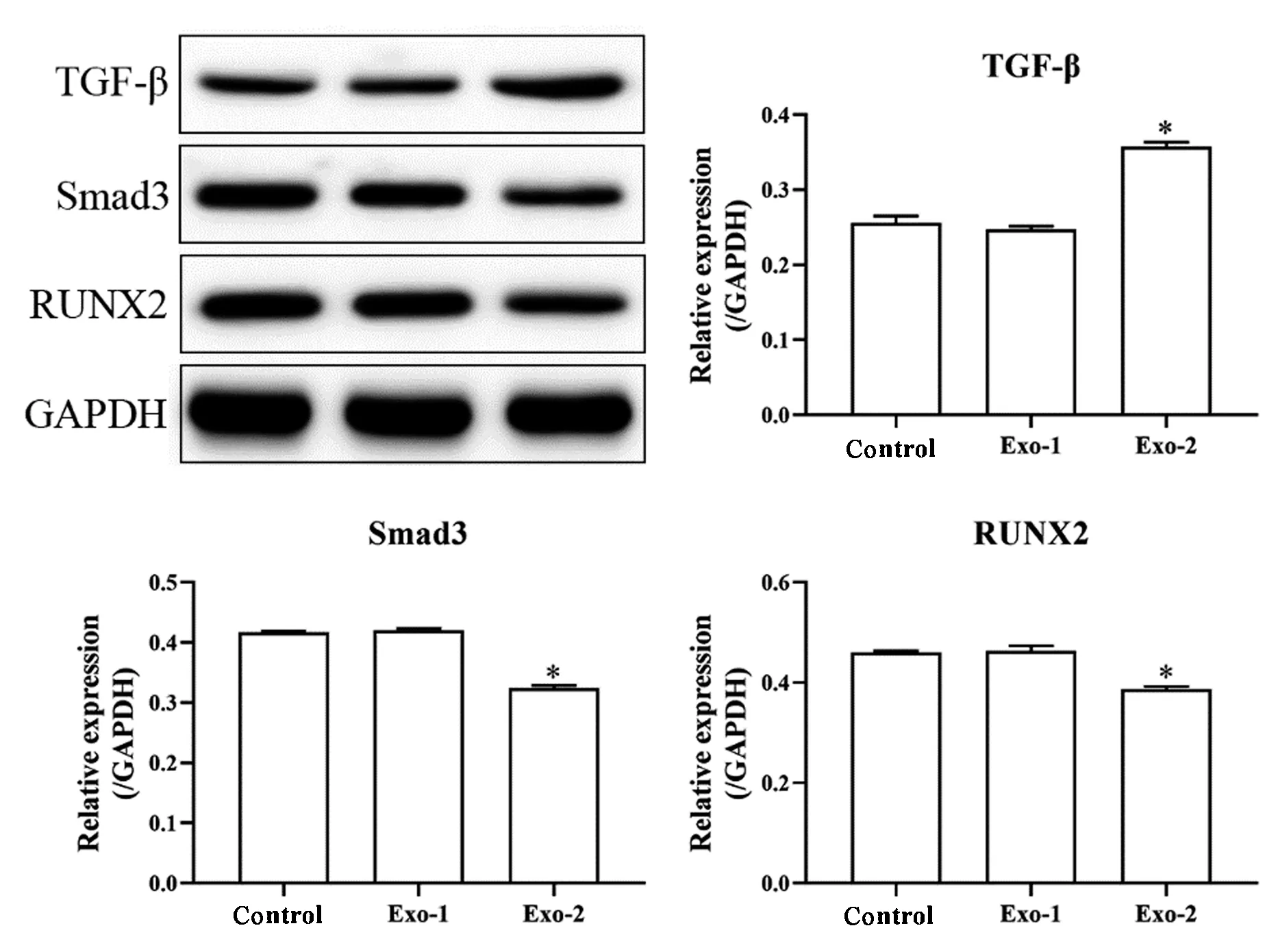
图5 Western blotting 检测TGF-β、Smad3和RUNX2蛋白表达(*P<0.05 vs. Control/Exo-1)Fig.5 The protein expressions of TGF-β, Smad3, and RUNX2 were detected with Western blotting (*P<0.05 vs Control/Exo-1)
3 讨论
SANFH是临床上应用糖皮质激素引起的一种严重的骨科疾病,其病理特征是骨细胞和骨髓逐渐发生坏死,最终导致股骨头结构改变甚至塌陷[12]。SANFH的发病机制复杂多样,主要包括MSC成骨与成脂分化失衡理论、脂肪代谢紊乱理论、骨质疏松理论、炎症与细胞凋亡理论和血管内凝血理论等,其中,MSC成骨和成脂分化失衡被认为是SONFH发生和发展的主要机制[13-14]。地塞米松是最常用的糖皮质激素药物之一,长期使用糖皮质激素会产生许多不良反应,例如骨质流失、低骨量、脆性骨折和骨坏死等[15-16]。已有许多研究报道证明了地塞米松对MSC的作用具有时间和剂量依赖性,如短时间和低剂量地塞米松处理MSC可促进成骨,而长期暴露在高剂量(10-6mol/L)的地塞米松下会诱导细胞凋亡并抑制MSCs的增殖,导致骨质疏松和SONFH[17]。研究表明,高浓度地塞米松(10-5mol/L)可导致MSC功能障碍,从而导致MSC成骨和成脂分化失衡[18]。近年来,许多研究表明外泌体在MSC成骨分化中起着重要作用。Fang等[19]研究了MSC外泌体对SANFH的成骨作用,结果显示经MSC外泌体处理的SANFH细胞中有11个基因表达上调,9个基因表达下调;这些差异表达基因主要参与成骨分化、免疫应答和TGF-β/BMP信号通路等,从而影响SANFH的成骨作用。本研究探讨用地塞米松(10 μmol/L)干预的MSC来源外泌体是否通过TGF-β/Smad3信号通路对MSC成骨分化产生影响。
ALP富含于成骨细胞胞质中,是反映成骨细胞活力的功能酶之一,ALP活性水平是成骨细胞分化和矿化的指标[20]。本研究结果显示,与对照组和和Exo-1相比,Exo-2组MSC细胞中ALP活性显著降低,这表明经10 μmol/L地塞米松干预的MSC来源外泌体可显著抑制MSC成骨分化。研究表明,长期过量使用激素会引起股骨头成骨细胞微环境的改变,导致细胞色素C、Bax、C-caspase3和C-caspase9等凋亡相关因子过度表达,这些因子通过一系列反应导致细胞凋亡和组织破坏[21]。本研究通过流式细胞术检测了MSC凋亡率,结果显示,与对照组和和Exo-1相比,Exo-2组MSC细胞凋亡率显著升高,这表明经10 μmol/L地塞米松干预的MSC来源外泌体显著促进MSC凋亡。NF-κB是最具代表性的炎症因子,是炎症反应的中心介质,研究表明,TLR/NF-κB过度激活可能会相互抑制Wnt/β-catenin通路并诱导SANFH[22]。IL-1β和TNF-α均为促炎因子,研究表明,SANFH大鼠血清中IL-1β和TNF-α浓度显著升高[23]。本研究结果显示,与对照组和和Exo-1相比,Exo-2组MSC细胞中NF-κB mRNA表达量显著降低,IL-1β和TNF-α mRNA表达量显著升高,这表明经10 μmol/L地塞米松干预的MSC来源外泌体可显著促进MSC炎症反应。
MSC成骨分化过程是通过一系列信号转到途径实现的,TGF-β蛋白家族的信号转导在调节MSC成骨分化中起着重要作用[8]。Smads蛋白家族是TGF-β信号通路中的重要组成部分,TGF-β通过丝氨酸/苏氨酸受体激酶启动信号转导,随后使Smad2/3磷酸化,磷酸化的Smad2/3与Smad4结合,并将其转运至细胞核中,激活的Smads蛋白通过与转录因子结合调控生物学过程[24-25]。RUNX2是MSC成骨分化的关键特异性细胞因子,在TGF-β信号通路的介导下,Smad3可调控RUNX2的表达水平进而影响MSC的功能[26]。本研究结果显示,与对照组和和Exo-1相比,Exo-2组MSC细胞中TGF-β mRNA和蛋白表达量显著升高,Smad3和RUNX2 mRNA和蛋白表达量显著降低,这表明经10 μmol/L地塞米松干预的MSC来源外泌体可能通过TGF-β信号通路对MSC成骨分化产生影响。
综上所述,用10 μmol/L地塞米松干预的MSC来源外泌体可能通过TGF-β信号通路抑制MSC成骨分化,促进细胞凋亡和炎症反应,参与SANFH的发生发展。
——外泌体与老年慢性疾病相关性的研究进展

