蝴蝶兰PhPP2Aa基因作为低温胁迫内参基因的研究
梁 芳,许申平,张 燕,王默霏,崔 波
蝴蝶兰基因作为低温胁迫内参基因的研究
梁 芳,许申平,张 燕,王默霏,崔 波*
郑州师范学院生物工程研究中心,河南郑州 450044
实时荧光定量PCR(qPCR)技术因其具有简单灵敏、准确高效等诸多优点,成为目的基因表达水平研究最常用的技术手段。而结果的可靠性取决于很多因素,其中使用合适的内参基因是qPCR技术最基本的应用前提。许多研究表明没有一种内参基因可以在任何条件下都能稳定地表达。目前尚未见到关于蝴蝶兰低温生长条件下最佳内参基因选择的有关报道。蛋白磷酸酶2A(PP2A)是真核生物体内一种主要的细胞内源丝氨酸/苏氨酸蛋白磷酸酶。本研究根据蝴蝶兰低温转录组测序结果克隆得到1个PP2A的A亚基基因,其cDNA开放阅读框(ORF)长度为1764 bp,编码1个含有587个氨基酸的蛋白,将该基因命名为,GenBank登录号为MW847782。序列分析结果表明,该基因与其他植物核苷酸序列相似性均在80%以上,氨基酸序列与小兰屿蝴蝶兰PP2A序列相似性为99.66%。基于氨基酸序列进化分析结果表明,蝴蝶兰PhPP2Aa与小兰屿蝴蝶兰和铁皮石斛的亲缘关系最近。将蝴蝶兰与其他7种候选内参基因(、、、、、及)进行实时荧光定量PCR,用3种常用内参基因分析软件对各个基因值进行稳定性分析,结果表明蝴蝶兰8个候选内参基因在低温胁迫条件下表达水平最稳定的内参基因为,其次为;最不稳定的基因为,其次为。以蝴蝶兰作为内参基因探讨低温胁迫响应基因的表达情况,结果显示蝴蝶兰的表达模式符合低温胁迫条件下的表达特性。该结果表明蝴蝶兰基因可作为低温胁迫条件下目的基因转录水平研究的内参基因。
蝴蝶兰;蛋白磷酸酶2A;内参基因;低温胁迫;序列分析
蛋白磷酸酶2A(protein phosphatase 2A,PP2A)是真核生物体内一种主要的细胞内源丝氨酸/苏氨酸蛋白磷酸酶。PP2A在植物体内参与多种激素信号转导途径,由PP2A介导的蛋白去磷酸化在植物生物、非生物胁迫调控中发挥重要作用[1-4]。此外,PP2A还参与植物细胞的油脂代谢[5]和氮代谢[6]、光信号途径[7]及开花时间调控过程[8]等。PP2A由65kDa结构亚基A、36kDa催化亚基C和多种功能特异的调节亚基B组成,保守的A亚基和C亚基形成二聚体核心酶,再与高度变异的B亚基构成具有生物活性的全酶[9]。每个亚基都有多个基因编码,在拟南芥中,有3种A亚基、17种B亚基和5种C亚基[10]。A亚基由一系列保守的α螺旋重复序列组成,而且提供与B亚基和C亚基的结合位点[11]。在植物中A亚基(PP2Aa)由一到数个基因编码,在拟南芥中编码A亚基的基因有3个,分别为、和,其中在ABA信号转导的早期起正调控作用,并影响生长素的转运[12]。有研究表明参与植物胁迫响应[13],当功能缺失时,和才发挥生物学作用[14]。
蝴蝶兰(spp.)原产于热带亚热带地区,性喜暖畏寒,在我国北方地区种植时,低温成为影响其正常生长的重要环境因子。因此,耐冷性资源和基因挖掘是蝴蝶兰育种工作的重要目标之一。在蝴蝶兰耐冷性基因筛选过程中,实时荧光定量PCR(qPCR)是较为常用的技术手段,而qPCR技术的应用前提之一是合适内参基因的选择。目前在蝴蝶兰内参基因筛选及低温条件下目的基因表达水平研究中,尚未见到关于低温生长条件下最佳内参基因选择的有关报道。传统的内参基因很多,本研究从低温转录组文库中,筛选表达相对稳定的3个常用内参基因、、及5个新型内参基因、、、和作为候选内参基因,采用3个常用内参基因分析软件geNorm[15]、NormFinder[16]和BestKeeper[17]对这8个候选内参基因的表达稳定性进行分析,并用蝴蝶兰低温胁迫响应基因作为验证[18]。该结果为蝴蝶兰低温胁迫条件下基因表达分析及功能研究奠定基础。
1 材料与方法
1.1 材料
以正常生长温度的叶片为对照1(CK1)取样,16℃/11℃处理3 d后为对照2(CK2)取样,于11℃/6℃处理后1 d(T1)、2 d(T2)、3 d(T3)、5 d(T5)和7 d(T7)取样。
1.2 方法
1.2.1 蝴蝶兰基因序列分析 根据蝴蝶兰低温胁迫条件下叶片转录组测序结果,获得一条蝴蝶兰基因,在其ORF区两端设计引物并克隆全长序列,利用DNAMAN软件比对其推导的氨基端序列的同源性,用Clustal X和MEGA构建该基因的系统进化树分析进化关系。
1.2.2 候选内参基因的实时荧光定量分析 根据低温转录组测序结果,挑选8个候选内参基因,其readcount值在不同处理时间中相对稳定。分别设计qPCR引物,如表1所示。利用SYBR®Premix Ex TaqTMII对不同高温胁迫处理时间后各基因表达情况进行qPCR反应检测,反应总体系为20.0 μL,其中2×SYBR Premix ExII 10.0 μL,引物F和R各0.8 μL,cDNA 模板2.0 μL;ddH2O 6.4 μL;反应条件为:95℃预变性30 s;95℃变性15 s,58℃退火15 s,72℃延伸15 s,共40个循环。qPCR反应在Eppendorf Mastercycler ep realplex2荧光定量PCR仪上进行,每个样品3次重复,并做阴性对照。PCR反应完成后,经仪器自动分析,查看每个基因的扩增情况,并导出相应的值。

表1 引物序列及用途
1.2.3 候选内参基因表达稳定性分析 根据得到的各个候选内参基因的值,利用分析软件GeNorm、Bestkeeper和NormFinder对8个候选内参基因的表达稳定性进行分析,筛选蝴蝶兰低温生长条件下的最适内参基因。
1.2.4 内参基因标准曲线的制作 取等量不同低温处理时间叶片的7个cDNA样品,混合均匀作为标准品,分别稀释10倍、100倍、1000倍和10 000倍及未稀释样品作为5个梯度,分别以5个梯度的cDNA为模板,以表1中设计的引物进行qPCR反应,20.0 μL反应体系配置及反应条件同1.2.2。
1.2.5 蝴蝶兰基因在低温条件下的表达 以蝴蝶兰基因作为内参基因,以为对照,检测NAC域蛋白基因在蝴蝶兰低温胁迫条件下不同处理时间叶片中的表达特性分析。
2 结果与分析
2.1 蝴蝶兰PhPP2Aa基因的克隆与序列分析
以蝴蝶兰叶片提取的cDNA第一链为模板,克隆得到基因目的片段1859 bp,ORF区全长为1764 bp,编码587个氨基酸。将蝴蝶兰基因序列进行BLAST比对分析,结果发现蝴蝶兰与小兰屿蝴蝶兰(,XM_ 020743358.1)核苷酸序列有31个不同碱基,序列相似性为99.15%;与铁皮石斛(,XM_020819773.1)序列相似性为93.82%;与油棕(,XM_ 010943973.2)、凤梨(,XM_0202 44641.1)、海枣(,XM_0087 84816.3)等植物序列相似性均在80%以上。表明该基因为编码PP2A的A亚基的β基因,因此命名为,GenBank登录号为MW847782。
将该基因推导的氨基酸序列与NCBI中其他9种相似度较高的植物PP2A蛋白进行多序列比对,结果发现PhPP2Aa与小兰屿蝴蝶兰PP2A氨基酸序列有1个不同,序列相似性为99.66%,在第353位的氨基酸由D(天冬氨酸)变为E(谷氨酸)。与其他8种植物的氨基酸序列有多个位点不同,其中在第55位氨基酸由E变为D,第314位氨基酸由Q(谷氨酰胺)变为E,第322位氨基酸由P(脯氨酸)变为T(苏氨酸)(图1)。
在NCBI上下载了其他19种植物基因的氨基酸序列与蝴蝶兰的序列共同构建系统进化树,结果见图2。由图2可知,这些植物的PP2A氨基酸序列明显分为2个大分支,蝴蝶兰PhPP2Aa(hydrid,MW847782)与小兰屿蝴蝶兰(,XM_020743358.1)的PP2A进化关系最近,其次是兰科植物的铁皮石斛(,XM_020819771.2),三者处于同一个进化分支;与玉米(,XM_008650108.2)、水稻(,AJ243828.1)、油棕(,XM_010930760.2)等单子叶植物均处于一个大分支;而另一个大分支为罂粟(,XM_026547132.1)、莲(,XM_010266882.2)、葡萄(,XM_002276144.4)、陆地棉(,XM_016854089.1)等双子叶植物。表明基因的进化在单双子叶植物中具有高度的保守性。
以药物不良反应这一节为例,该章节的重点在于掌握药物不良反应分类及发生机制,难点在于诊断药物不良反应的主要依据,在教学中教师需重点突出本章与医院临床药学实践紧密相结合的特点,争取将学生的思维引导到如何在实践中发现、判断ADR。笔者在该部分内容的教学设计中引入BOPPPS模式,具体设计见表1、表2。

图1 蝴蝶兰PhPP2Aa基因编码的氨基酸序列与其他植物PP2A的多序列比对

图2 蝴蝶兰PhPP2Aa与其他PP2A蛋白系统进化树
2.2 蝴蝶兰候选内参基因的表达稳定性分析
由图3可知,蝴蝶兰的8个候选内参基因PCR结果条带单一,扩增产物大小位置与预期结果一致,且扩增曲线显示均为单峰,表明所设计的引物可用于目的基因的qPCR分析。
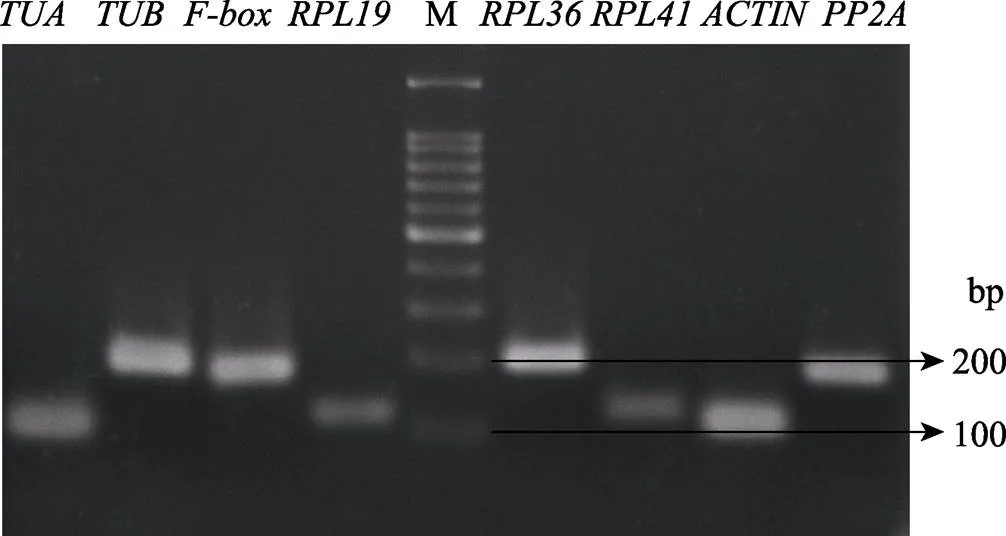
图3 蝴蝶兰候选内参基因的qPCR扩增结果
8个候选内参基因在蝴蝶兰低温处理不同时间下的表达值在19.11~27.55之间(图4A),其中以的值最小,表达丰度最高;的值最大,表达丰度最低(图4B)。
采用3个常用软件geNorm、NormFinder和BestKeeper对8个候选内参基因的表达稳定性进行分析。geNorm和NormFinder是根据值判断,值越小,表明基因稳定性越高;值越大,稳定性越低。BestKeeper是根据±值来判断,值越小,表明该基因稳定性越高。如表2所示,geNorm和NormFinder分析结果均表明,和的值最小,稳定性最高,其次为。BestKeeper分析结果表明,的值最小,稳定性最高,其次为。3个软件的分析结果均表明最不稳定的内参基因是,其次是。综合分析表明,蝴蝶兰8个候选内参基因在低温胁迫条件下表达水平最稳定的内参基因是,其次是。
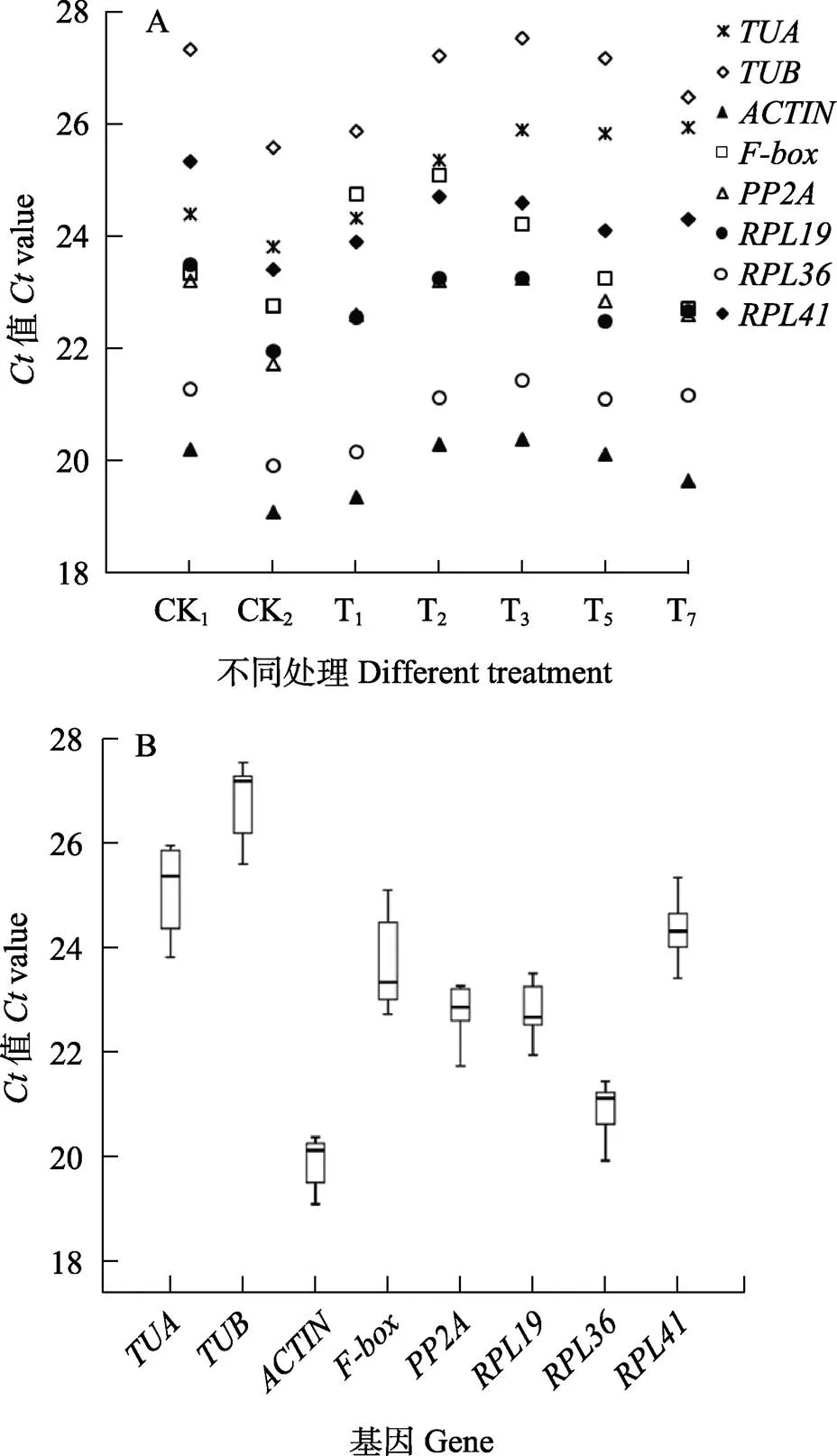
A:Ct平均值分布图;B:Ct平均值箱式图。
periods of cold treatment
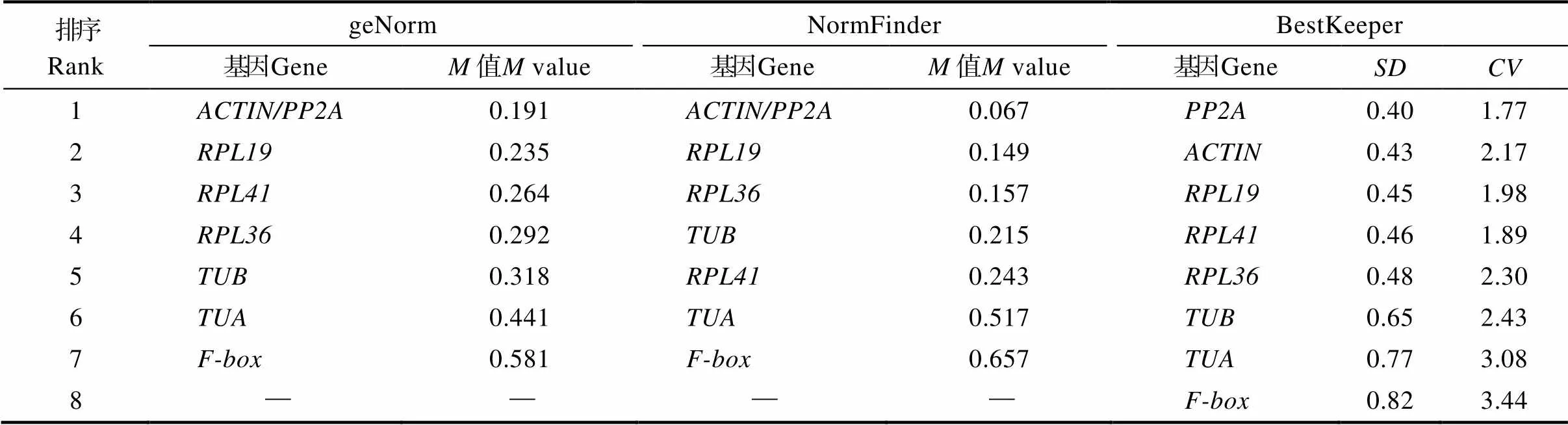
表2 蝴蝶兰候选内参基因稳定性分析
2.3 蝴蝶兰PP2A基因标准曲线的制作
由实时荧光定量PCR仪自动生成熔解曲线和标准曲线。结果显示,基因的qPCR熔解曲线均为单峰,表明所设计的引物具有特异性,产物单一;基因的qPCR标准曲线为= –3.299+20.17,扩增效率为101%,相关系数为0.999。
2.4 蝴蝶兰PP2A基因作为内参基因检测低温下PhNAC1表达量
以蝴蝶兰为内参基因,检测基因在低温处理不同时期叶片中的表达情况,以常用的基因为对照。结果表明,蝴蝶兰在11℃/6℃低温处理条件下,基因相对表达量在CK2(低温驯化阶段后)中明显上升;当逐步降温过程结束进行11℃/6℃处理1 d后(T1),表达量开始下降,之后又逐渐升高,第5天时(T5)达到最高。基因在2个蝴蝶兰品种中不同低温处理时间下的相对表达水平,与以为内参基因时基因表达量变化总体趋势基本一致(图5)。表明以为内参基因进行相关基因分析结果是可靠的。
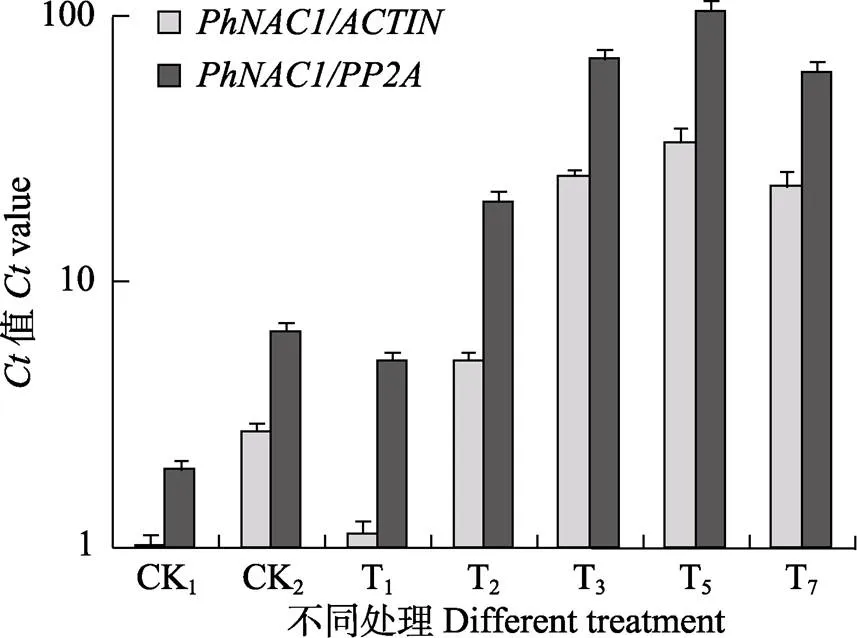
图5 蝴蝶兰PhNAC1基因在低温胁迫条件下的表达特性
3 讨论
由于qPCR具有简单、灵敏度高、准确、快速等优点被广泛应用于目的基因转录水平研究[19]。应用过程中为了保证结果的可重复性和准确性,有很多需要遵循的原则,其中最基本的先决条件就是使用可靠的内参基因[20]。理想的内参基因要求能不受RNA量及各种实验条件和环境的影响,但是大量研究表明即使是被广泛运用的内参基因,其表达水平也会随着物种、组织及处理的不同而不同,没有一种内参基因被证明可在任何条件下均表达稳定[21]。因此,在进行目的基因表达水平研究时,首先筛选在特定条件下合适的内参基因是一项重要的任务。虽然蝴蝶兰的内参基因研究已有报道[22],但只研究了蝴蝶兰在正常温度下营养生长及生殖生长过程中目的基因研究的最适内参基因,尚未见到温度胁迫下内参基因研究的相关报道。
较早使用的内参基因主要是看家基因,如、、等,近年来又有很多新的内参基因的相关研究,如、、等。有报道表明在甘草及海州常山干旱条件下[23-24]、板蓝根ABA处理条件下[25]及冬油菜冷胁迫条件下的表达均最为稳定[26]。和在香蕉温度胁迫时表达最稳定[27];在早熟禾低温胁迫下的根中表达最稳定[28]。在甘薯、黄梁木及海州常山盐胁迫条件下的研究表明的表达最稳定[24, 29-30],并指出和虽然被广泛使用,但在甘薯不同品种中的研究表明其表达并不是最稳定的[20]。大豆在镉胁迫条件下,、及的表达最稳定,表达最不稳定[31];在山胡椒中的研究表明,和在不同组织及果实发育期表达最稳定[32]。作为内参基因的应用已有许多报道,如作为油菜成熟胚中目的基因表达研究的内参基因[33]、橄榄的中果皮[34]、鹰嘴豆不同组织中[35]、生菜生长发育过程中[36]、鼠尾草的生殖阶段[37]、狗尾草[38]、白杨的不定根再生阶段[39]。由此可见,不同物种、不同条件或组织,最佳内参基因是不同的。因此,本研究从8个候选内参基因中,利用常用的3种内参基因分析软件,筛选出基因作为研究蝴蝶兰在低温条件下目的基因表达功能研究的内参基因,其次为基因。也有相关报道作为低温胁迫条件下的最佳内参基因,如对葡茎剪股颖在冷胁迫条件下内参基因表达情况的研究表明,最佳内参基因为和的联合使用[40]。
本研究获得了蝴蝶兰基因的全长序列,经BLAST比对发现与其他植物核苷酸序列相似性在80%以上。系统进化分析表明,蝴蝶兰与小兰屿蝴蝶兰的基因氨基酸序列完全相同,与兰科植物铁皮石斛的亲缘关系最近,三者处于同一进化分支。以往的研究表明,蝴蝶兰基因在低温胁迫条件下表达量会逐渐升高,本研究用基因验证作为内参基因的稳定性,同时以常用内参基因为对照,结果发现,以和为内参基因时,基因在蝴蝶兰不同低温处理时间下的相对表达水平变化总体趋势基本一致,表明以为内参基因进行相关基因分析结果是可靠的。综上所述,通过对蝴蝶兰基因的表达稳定性分析及验证,表明该基因在蝴蝶兰正常生长温度及低温胁迫条件下,不同时间的叶片中均能稳定表达,说明基因可作为蝴蝶兰低温胁迫条件下的内参基因使用,为研究蝴蝶兰低温胁迫条件下相关基因的表达特性分析、耐冷性资源及基因挖掘奠定基础。
[1] THAKORE C U, LIVENGOOD A J, HENDERSHOT III J D, CORUM J W, LATORRE K A, RUNDLE S J. Characterization of the promoter region and expression pattern of threeprotein phosphatase type 2A subunit genes[J]. Plant Science, 1999, 147: 165-176.
[2] DURIAN G, RAHIKAINEN M, ALEGRE S, BROSCHÉM, KANGASJÄRVI S. Protein phosphatase 2A in the regulatory network underlying biotic stress resistance in plants[J]. Frontiers in Plant Science, 2016, 7: 812.
[3] XU P, YONG B, SHAO H H, SHEN J B, HE B, MA Q Q, YUAN X H, WANG Y. Cloning and characterization of a serine/threonine protein phosphatase 2A-encoding genefrom(L.) Lam.[J]. Turkish Journal of Biology, 2017, 41: 148-157.
[4] LIU D, LI B, FENG G, MAO X G, LI A, CHANG X P, JING R L. TaPP2AbBʺ‑γ, a wheat regulatory subunit of PP2A enhanced abiotic stress tolerance[J]. Plant Growth Regulation, 2019, 89: 345-355.
[5] HEIDARI B, MATRE P, NEMIE-FEYISSA D, MEYER C, ROGNLI O A, MOLLERØ S G, LILLO C. Protein phosphatase 2A B55 and a regulatory subunits interact with nitrate reductase and are essential for nitrate reductase activation[J]. Plant Physiology, 2011, 156: 165-172.
[6] KATAYA A R, HEIDARI B, HAGEN L, KOMMEDAL R, SLUPPHAUG G, LILLO C. Protein phosphatase 2A holoenzyme is targeted to peroxisomes by piggybacking and positively affects peroxisomal betaoxidation[J]. Plant Physiology, 2015, 167: 493-506.
[7] TSENG T S, BRIGGS W R. Thercn1-1 mutation impairs dephosphorylation of Phot2, resulting in enhanced blue light responses[J]. Plant Cell, 2010, 22: 392-402.
[8] HEIDARI B, NEMIE-FEYSSSA D, KANGASJÄRVI S, LILLO C. Antagonistic regulation of flowering time through distinct regulatory subunits of protein phosphatase 2A[J]. PLoS One, 2013, 8: e67987.
[9] YU S H, LEI H Y, CHANG W Z,SÖLL D, HONG G F. Protein phosphatase 2A: identification in Oryza sativa of the gene encoding the regulatory A subunit[J]. Plant Molecular Biology, 2001, 45: 107-112.
[10] LILLO C, KATAYA A R A, HEIDARI B, CREIGHTON M T, NEMIE-FEYISSA D, GINBOT Z, JONASSEN E M. Protein phosphatases PP2A, PP4 and PP6: mediators and regulators in development and responses to environmental cues[J]. Plant Cell and Environment, 2014, 37(12): 2631-2648.
[11] BOOKER M A, DELONG A. Atypical protein phosphatase 2A gene families do not expand via paleopolyploidization[J]. Plant Physiology, 2017, 173(2): 1283-1300.
[12] KWAK J M, MOON J H, MURATA Y, KAZUYUKI K, LEONHARDT N, DELONG A, SCHROEDER J I. Disruption of a guard cell-expressed protein phosphatase 2A regulatory subunit,, confers abscisic acid insensitivity in[J]. Plant Cell, 2002, 14(11): 2849-2861.
[13] BLAKESLEE J J, ZHOU H W, HEATH J T, SKOTTKE K R, BARRIOS J A R, LIU S Y, DELONG A. Specificity of RCN1-mediated protein phosphatase 2A regulation in meristem organization and stress response in roots[J]. Plant Physiology, 2008, 146(2): 539-553.
[14] ZHOU H W, NUSSBAUMER C, CHAO Y, DELONG A. Disparate roles for the regulatory A subunit isoforms inprotein phosphatase 2A[J]. Plant Cell, 2004, 16(3): 709-722.
[15] VANDESOMPELE J, DE PRETER K, PATTYN F, POPPE B, VAN ROY N, DE PAEPE A, SPELEMAN F. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J]. Genome Biology, 2002, 3: RESEARCH0034.
[16] ANDERSEN C L, JENSEN J L, ØRNTOFT T F. Normalization of real-time quantitative reverse transcription-PCR data: a model-based variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer data sets[J]. Cancer Research, 2004, 64: 5245-5250.
[17] PFAFFL M W, TICHOPAD A, PRGOMET C, NEUVIANS T P. Determination of stable housekeeping genes, differentially regulated target genes and sample integrity: BestKeeper-Excel-based tool using pair-wise correlations[J]. Biotechnology Letters, 2004, 26: 509-515.
[18] 梁 芳, 张 燕, 牛苏燕, 袁秀云, 崔 波. 蝴蝶兰基因序列分析及对低温胁迫的响应[J]. 广西植物, 2020, 40(6): 845-853.
LIANG F, ZHANG Y, NIU S Y, YUAN X Y, CUI B. Sequence analysis ofgene fromand its response to cold stress[J]. Guihaia, 2020, 40(6): 845-853. (in Chinese)
[19] SHUKLA P, REDDY R A, PONNUVEL K M, ROHELAG K, SHABNAM A A, GHOSH M K, MISHRA R K. Selection of suitable reference genes for quantitative real-time PCR gene expression analysis in mulberry (L.) under different abiotic stresses[J]. Molecular Biology Reports, 2019, 46: 1809-1817.
[20] GUTIERREZ L, MAUIAT M, POLLOUX J, BELLINI C, VAN WUYTSWINKEL O. Towards a systematic validation of references in real-time RT-PCR[J]. Plant Cell, 2008, 20: 1734-1735.
[21] ARGYROPOULOS D, PSALLIDA C, SPYROPOULOS C G. Generic normalization method for real-time PCR application for the analysis of the mannanase gene expressed in germinating tomato seed[J]. FEBS Journal, 2006, 273: 770-777.
[22] YUAN X Y, JIANG S H, WANG M F, MA J, ZHANG X Y, CUI B. Evaluation of internal control for gene expression inby quantitative real-time PCR[J]. Applied Biochemistry and Biotechnology, 2014, 173(6): 1431-1445.
[23] MAROUFI A. Selection of reference genes for real-time quantitative PCR analysis of gene expression inunder drought stress[J]. Biologia Plantarum, 2016, 60(4): 645-654.
[24] HUA Y J, YUE Y Z, CHEN G W, YAN T T, DING W J, SHI T T, HU D, WANG L G, YANG X L. Selection of appropriate reference genes for quantitative real-time PCR in[J]. BioRxiv,2019. doi: org/ 10.1101/625145.
[25] QU R, MIAO Y, CUI Y, CAO Y, ZHOU Y, TANG X, YANG J, WANG F. Selection of reference genes for the quantitative real-time PCR normalization of gene expression infortune[J]. BMC Molecular Biology, 2019, 20(1): 9.
[26] MA L, WU J, QI W, COULTER J A, FANG Y, LI X, LIU L, JIN J, NIU Z, YUE J, SUN W. Screening and verification of reference genes for analysis of gene expression in winter rapeseed (L.) under abiotic stress[J]. PLoS One, 2020, 15(9): e0236577.
[27] CHEN L, ZHONG H Y, KUANG J F, LI J G, LU W J, CHEN J Y. Validation of reference genes for RT-qPCR studies of gene expression in banana fruit under different experimental conditions[J]. Planta, 2011, 4(2): 377-390.
[28] NIU K, SHI Y, MA H. Selection of candidate reference genes for gene expression analysis in kentucky bluegrass (L.) under abiotic stress[J]. Frontiers in Plant Science, 2017, 8: 193.
[29] ZHANG D, LI J, LI B, LI C, CHEN X, OUYANG K. Internal reference gene selection under different hormone stresses in multipurpose timber yielding tree[J]. Forests, 2020, 11: 1014.
[30] PARK S C, KIM Y H, JI C Y, PARK S, JEONG J C, LEE H S, KWAK S S. Stable internal reference genes for the normalization of real-time PCR in different sweetpotato cultivars subjected to abiotic stress conditions[J]. PLoS One, 2012, 7(12): e51502.
[31] WANG Y, YU K, POYSA V, CHUN S, ZHOU Y. Selection of reference genes for normalization of qRT-PCR analysis of differentially expressed genes in soybean exposed to cadmium[J]. Molecular Biology Reports, 2012, 39(2): 1585-1594.
[32] LIN L, HAN X, CHEN Y, WU Q, WANG Y. Identification of appropriate reference genes for normalizing transcript expression by quantitative real-time PCR in[J]. Molecular Genetics and Genomics, 2013, 8(12): 727-737.
[33] CHEN X, TRUKSA M, SHAH S, WESELAKE R J. A survey of quantitative real-time polymerase chain reaction internal reference genes for expression studies in[J]. Analytical Biochemistry, 2010, 405(1): 138-140.
[34] RAY D L, JOHNSON J C. Validation of reference genes for gene expression analysis in olive () mesocarp tissue by quantitative real-time RT-PCR[J]. BMC Research Notes, 2014, 7: 304.
[35] REDDY D S, BHATNAGAR-MATHUR P, REDDY P S, SRI CINDHURI K, SIVAJI GANESH A, SHARMA K K. Identification and validation of reference genes and their impact on normalized gene expression studies across cultivated and wildspecies[J]. PLoS One, 2016, 11(2): e0148451.
[36] SGAMMA T, PAPE J, MASSIAH A, JACKSON S. Selection of reference genes for diurnal and developmental time-course real-time PCR expression analyses in lettuce[J]. Plant Methods, 2016, 12: 21.
[37] GOPALAM R, RUPWATE S D, TUMANEY A W. Selection and validation of appropriate reference genes for quantitative real-time PCR analysis in[J]. PLoS One, 2017, 12(11): 0186978.
[38] NGUYEN D Q, EAMENS A L, GROF C P L. Reference gene identification for reliable normalisation of quantitative RT-PCR data in[J]. Plant Methods, 2018, 14: 24.
[39] TANG F, CHU L, SHU W, HE X, WANG L, LU M. Selection and validation of reference genes for quantitative expression analysis of miRNAs and mRNAs in Poplar[J]. Plant Methods, 2019, 15: 35.
[40] CHEN Y, HU B, TAN Z, LIU J, YANG Z, LI Z, HUANG B. Selection of reference genes for quantitative real-time PCR normalization in creeping bentgrass involved in four abiotic stresses[J]. Plant Cell Reports, 2015, 34(10): 1825-1834.
as Reference Gene inunder Low-temperature Stress
LIANG Fang, XU Shenping, ZHANG Yan, WANG Mofei, CUI Bo*
Bioengineering Research Center, Zhengzhou Normal University, Zhengzhou, Henan 450044, China
Quantitative real-time polymerase chain reaction (qPCR) analysis, with the benefits of simplicity, high sensitivity, accuracy and high-throughput characteristics, has been used in many fields to quantify the transcript levels of target genes. There are many rules that must be followed to ensure the reproducible and accurate expression profiles of target genes using qPCR. Among them, the use of a reliable internal control known as a reference gene for data normalization is the elementary prerequisite for valid results and proper analysis. Numerous studies have suggested that no single reference gene is always expressed stably under any condition. There are no reports on the selection of optimal reference genes forunder low temperature conditions. Protein phosphatase 2A (PP2A) is a major intracellular serine / threonine protein phosphatase in eukaryotes.A subunit gene of PP2A was cloned by the results of the transcriptome sequencing ofhybrid under cold stress, which was namedand the GenBank accession number was MW847782. The coding region (ORF) ofwas 1764 bp, encoding 587 amino acids. Homologous alignment showed that it shared over 80% nucleotide sequence similarity within other plants, and that it shared 99.66% amino acid sequence similarity with. The phylogenetic tree analysis based on the amino acid suggested that the relationship of PP2A betweenhybrid,andwas close, which belonged to the same branch. Three conventional software (geNorm, NormFinder, BestKeeper) were used to analyze the expression stability of 8 candidate reference genes (,,,,,,and) from. The results showed that the most stable reference gene was, followed by. And, the most unstable was, followed by. Usingof() as the reference gene to explore transcriptional profile of the target gene, the results demonstrated that the expression pattern ofwas consistent with its characterize under cold stress. Therefore,can be used as the internal reference gene for the analysis of target gene inunder low-temperature stress.
; protein phosphatase 2A; internal reference gene; low-temperature stress; sequence analysis
Q785;Q786
A
10.3969/j.issn.1000-2561.2022.07.004
2022-02-10;
2022-03-19
河南省科技攻关计划项目(No. 212102110116,No. 222102110470);河南省高校重点科研项目(No. 22A210025)。
梁 芳(1982—),女,博士,讲师,研究方向:花卉分子育种。*通信作者(Corresponding author):崔 波(CUI Bo),E-mail:cuibo@zznu.edu.cn。

