不同花性分化时期顶坛花椒花芽激素、多胺和C/N变化规律
周朝彬,饶茂霞,胥国楠,王志琴,龚 伟,杨永建,田正友,曾伯平
(1.遵义师范学院生物与农业科技学院,遵义 563006,贵州;2.四川农业大学林学院,林业生态工程省级重点实验室,成都 611130;3.九龙县农牧农村和科技局,九龙 626200,四川)
花椒为芸香科(Rutaceae)花椒属(Zanthoxylum)植物,该植物根系发达、喜钙耐旱,可作为生态树种应用于植被恢复实践。花椒果实(果皮)主要用作香料[1]。同时,花椒含有萜类、甾醇、类黄酮、生物碱、皂苷和香豆素等活性成分[2],常作药用,可用作驱蛔虫、治疗哮喘、支气管炎、消化不良、静脉曲张、腹泻、风湿和牙痛等多种疾病的中药制剂[3],明确列入中华人民共和国药典[4],具有显著经济效益。
贵州是我国花椒主产区之一,20世纪90年代在贵州贞丰县北盘江镇和关岭县花江镇大量种植的顶坛花椒(Zanthoxylum planispinum var.dingtanen⁃sis),在石漠化治理和促进农民增收方面发挥了重要作用。2007年12月31日,贞丰县被中国经济林协会授予“中国花椒之乡”称号。前期调查发现,关岭县和贞丰县种植的顶坛花椒出现以开黄色雄花为典型特征的衰退特征,相关学者也报道了此现象[5]。黄色雄花不结实,严重影响经济产出、降低农户种植积极性、威胁石漠化治理成效的巩固。花椒花器官类型有雌花、雄花和两性花,正常花椒以雌花为主,占90%以上。调查发现,一些顶坛花椒树体开雄花比例超80%,表明花椒花性分化过程发生了变化。
植物花性分化过程受内源激素调控[6]。目前,已有的研究除了一致认同乙烯(ethylene,Eth)促进雌花分化的作用外[7-8],大多数内源激素对植物花性分化的作用尚未取得一致的认识。核桃(Juglans regia)雄花成花比例与赤霉素(gibberellin,GA)含量正相关[9]。然而GA3含量增加有利于软枣猕猴桃(Actin⁃idia arguta)雌花的发育[10]。生长素类物质可以促进荔枝(Litchi chinen)雌蕊的发育[11]。但柿子(Diospyros kaki)雄花的发育与相对较高的吲哚乙酸(indole-3-acetic acid,IAA)含量相关[12]。一些研究发现,高浓度的玉米素(Zeatin,ZR)促进麻疯树(Jatropha curcas)雌花分化[13],然而,在柿子花性分化的研究上则发现,高浓度的ZR促进两性花分化[12]。脱落酸(abscisic acid,ABA)在不同植物上对花性分化的调控作用也不一致[12,14]。
多胺是具有生物活性的低分子量脂肪含氮碱,主要有腐胺(putrescine,Put)、尸胺(cadaverine,Cad)、亚精胺(spermidine,Spd)和精胺(spermine,Spm)等。荔枝雌蕊的发育与高Spd和Spm含量相关联,Put与雄蕊的发育相关联[11]。然而黄连木(Pistacia chinen⁃sis)雌株叶片的Put含量在不同时期均高于雄株[15]。在陕西大红袍花椒(Zanthoxylunm bungeanum)花芽分化过程中,Put和Spd含量的增加有利于雌蕊分化[16]。由此表明,多胺在性别分化过程中的作用也因植物而异。C/N对植物花性分化的作用方面,锥栗(Castanea henryi)两性花序C/N在大多数时期均显著高于雄花序[17],而C/N则与柿子花性分化无关,高的C/N仅与雌蕊和雄蕊的长度有关[18]。
目前,花椒的研究主要集中在栽培管理[19]、花芽分化[20]、果实性状以及有效成分提取和活性[21-22]等方面。对花椒花性分化的生理机制研究极少。本研究测定了顶坛花椒不同花性分化时期花芽内源激素、多胺以及C/N比变化,以期为顶坛花椒花性分化机制及调控技术研究提供理论依据。
1 材料和方法
1.1 试验材料
顶坛花椒花芽采自贵州省关岭布依族苗族自治县板贵乡(25.676°N,105.657°E),该区域属于典型的亚热带湿润季风气候,年均降雨量1 100 mm,年均温18.4℃。样地海拔530 m,石漠化严重,基岩裸露率50%~80%,土壤以石灰土为主。花椒树龄大部分为10~12 a生。在花椒人工林内随机选择样树8株,在树冠中部外围的东南西北4个方向进行取样。采样时期分别为:2020年11月4日采集花序轴分化期的花芽,2021年2月26日采集雄花,2021年3月13日采集雌花。部分花芽湿巾包裹后,置于4℃冷藏箱带回实验室采用DMSZ8视频一体机拍照(图1Ⅰ,Ⅱ和Ⅲ)。同时在野外对雌雄花序拍照观察(图1Ⅳ,Ⅴ和Ⅵ)。另一部分立刻放入液氮中带回实验室,置于-80℃冰箱中保存,用于激素、多胺、可溶性糖和可溶性蛋白指标分析。

图1 不同花性分化时期顶坛花椒的花芽形态特征Figure 1 Morphological characteristics of Z.planispinum var.dintanensis flower buds in different floral sex differentiation stages
1.2 花芽激素、多胺、可溶性糖和可溶性蛋白测定
1.2.1 激素含量测定
采用酶联免疫分析中的双抗体夹心法测定顶坛花椒花序轴分化期的花芽(Ⅰ)、雄花(Ⅱ)和雌花(Ⅲ)的GA3、IAA、Eth、ABA和ZR含量,试剂盒由中国农业大学生物技术实验室提供,具体方法参照试剂盒使用说明书。
1.2.2 多胺含量测定
多胺提取:样品于液氮中研磨后混匀,转入离心管中,加入5 mL 5%高氯酸溶液超声提取30 min,6 000 r/min离心5 min,取上清,重提一次,合并两次清液定容至9 mL;用1 mL正己烷净化2次,取提取液3 mL,加入0.2 mL 2 mol/L的NaOH和100µL苯甲酰氯溶液,涡旋20 s后40℃下保温30 min,然后向混合液里加入甲醇定容至4 mL并终止反应,过0.22µm滤膜后进样分析。
多胺测定:采用高效液相色谱测试花芽多胺含量,多胺种类包括Put、苯乙胺(phenylethylamine,Pea)、Cad、Spd、Spm、色胺(tryptamine,Try)、组胺(histamine,His)和酪胺(tyramine,Tyr)。高效液相色谱仪(Thermo,U3000)的色谱柱为syncronis C18(250 mm×4.6 mm×5 µm),紫外检测器检测波长254 nm,柱温35℃,流动相A:90%乙腈/10%(含0.1%乙酸的0.01 mol/L乙酸铵溶液),流动相B:10%乙腈/90%(含0.1%乙酸的0.01 mol/L乙酸铵溶液),流速1.0 mL/min,进样量20µL。
1.2.3 可溶性糖和可溶性蛋白含量测定
采用蒽酮比色法测定可溶性糖含量[23],采用考马斯亮蓝法测定可溶性蛋白质含量[24],可溶性糖和可溶性蛋白的比值为C/N。
1.3 数据分析
采用Microsoft Excel 2007整理数据,SPSS 19.0对不同花性分化时期花芽生理指标进行单因素方差分析(one-way ANOVA),采用Duncan新复极差进行多重比较,采用Pearson相关性分析各指标间的关系,采用主成分分析,通过降维中的因子分析,提取主成分后,将主成分得分做散点图,研究不同花性分化时期花芽激素、多胺和C/N的可能组合。采用OriginPro 8.0绘图。
2 结果与分析
2.1 不同花性分化时期顶坛花椒花芽激素含量变化
顶坛花椒花性分化不同时期中,不同激素含量的变化规律不一。花序轴分化期的花芽、雄花以及雌花间的IAA含量和ABA含量差异显著(P<0.05),均表现为雌花>雄花>花序轴分化期的花芽的规律,雌花的IAA含量分别是雄花和花序轴分化期的花芽的1.11和1.14倍,雌花的ABA含量分别是雄花和花序轴分化期的花芽的1.05和1.10倍。Eth和ZR在3个时期则均无显著差异(P>0.05)。GA3含量表现出在花序轴分化期花芽为最低,仅(4 534.94±77.17)pg/g,分别比雄花和雌花低5.55%和4.15%(P<0.05),而雄花和雌花间差异不显著(P>0.05)(图2)。
2.2 C/N比
顶坛花椒不同花性分化时期的C/N存在显著差异。C/N表现为雄花>雌花>花序轴分化期的花芽的特征(P<0.05,图2),雄花的C/N分别是雌花和花序轴分化期的花芽的2.04和4.18倍。
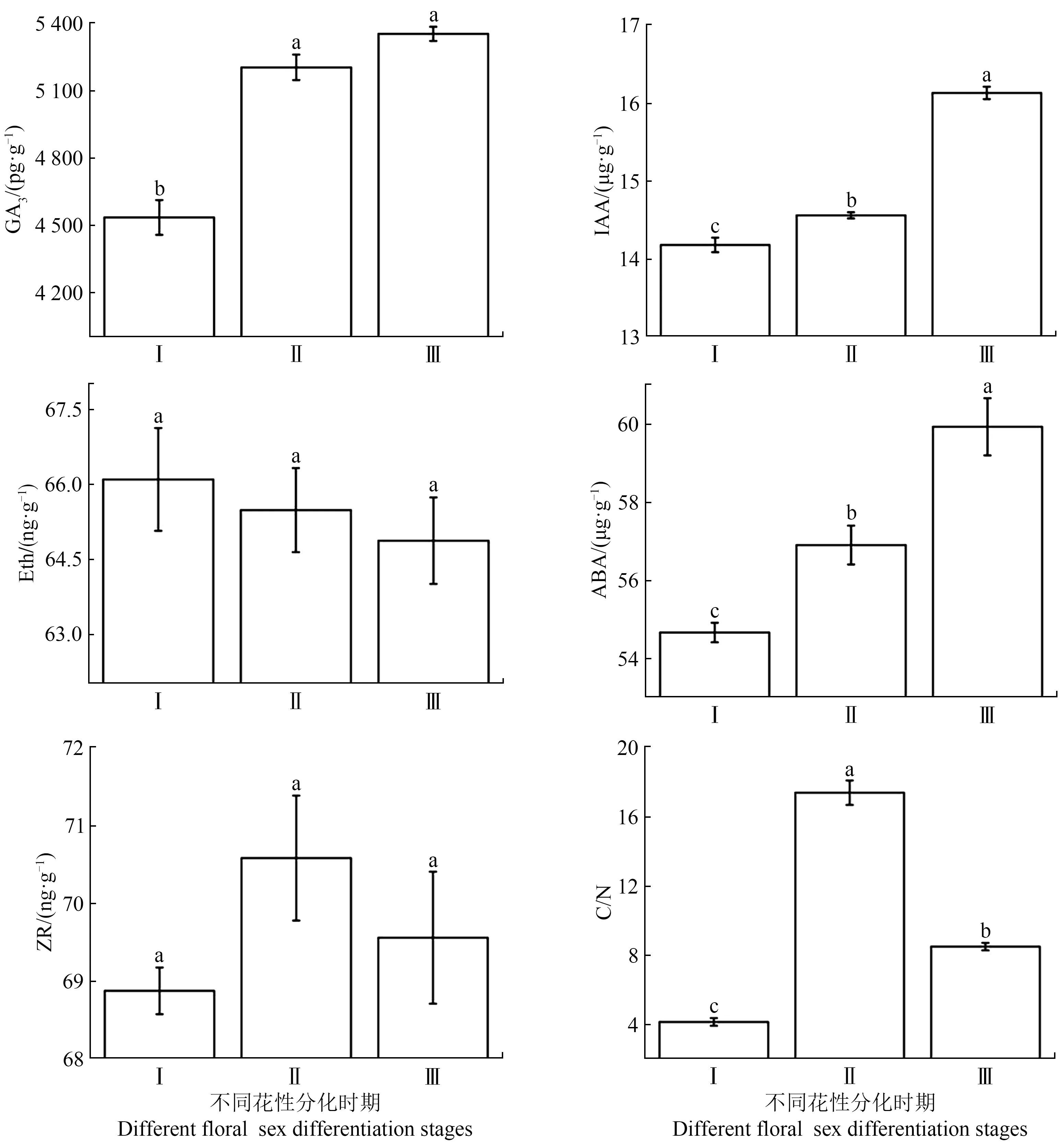
图2 顶坛花椒不同花性分化时期的激素和C/N特征Figure 2 The hormones and C/N characteristics of Z.planispinum var.dintanensis flower buds during different floral sex differentiation stages
2.3 多胺
本试验中,Put和Pea在3个时期的样品中均未检出,因此,仅分析Cad、Spd、Spm、Try、His和Tyr含量变化规律。6种多胺含量在不同时期的差异特征表明,低含量的Cad和高含量的Tyr有利于雄花发育,而低含量的Spd、Try和Tyr,以及高含量的Spm则有利于雌花的形成(表1)。
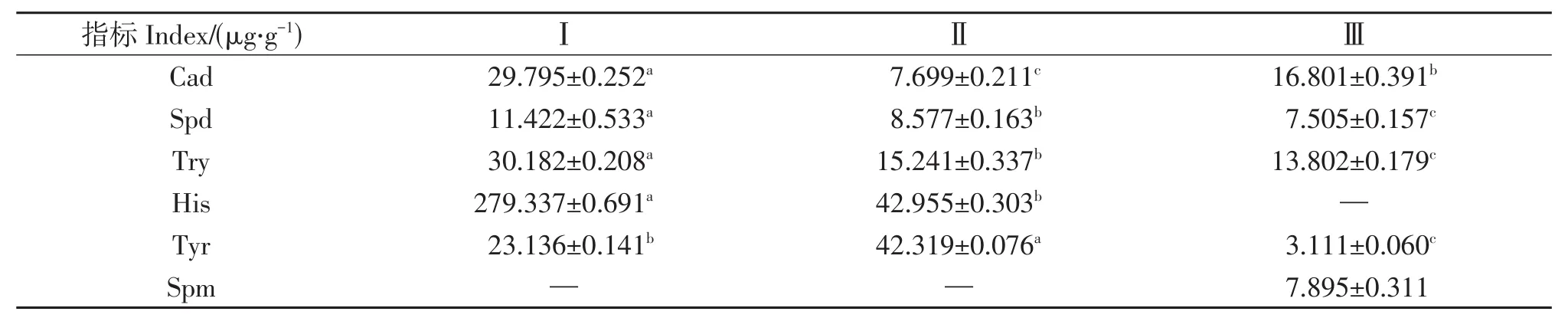
表1 顶坛花椒不同花性分化时期的多胺特征Table 1 The polyamine characteristics of Z.planispinum var.dintanensis flower buds during different floral sex differentiation stages
2.4 生理指标间相关性
回归分析表明以下生理变量间存在极显著相关(P<0.01):GA3和ABA呈正相关,和Cad、Spd、Try以及His呈负相关;IAA和ABA以及Spm呈正相关,和Spd呈负相关;ABA和Spm呈正相关,和Spd、Try、His呈负相关;C/N与Cad呈负相关;Cad和Try以及His呈正相关;Spd和Try以及His呈正相关;Try和His呈正相关,Tyr和Spm呈负相关(表2)。
以下生理变量间存在显著相关(P<0.05):GA3和IAA呈正相关;IAA和Try、His以及Tyr呈负相关;C/N和Try呈负相关;Cad和Spd呈正相关;Spd和Spm呈负相关(表 2)。
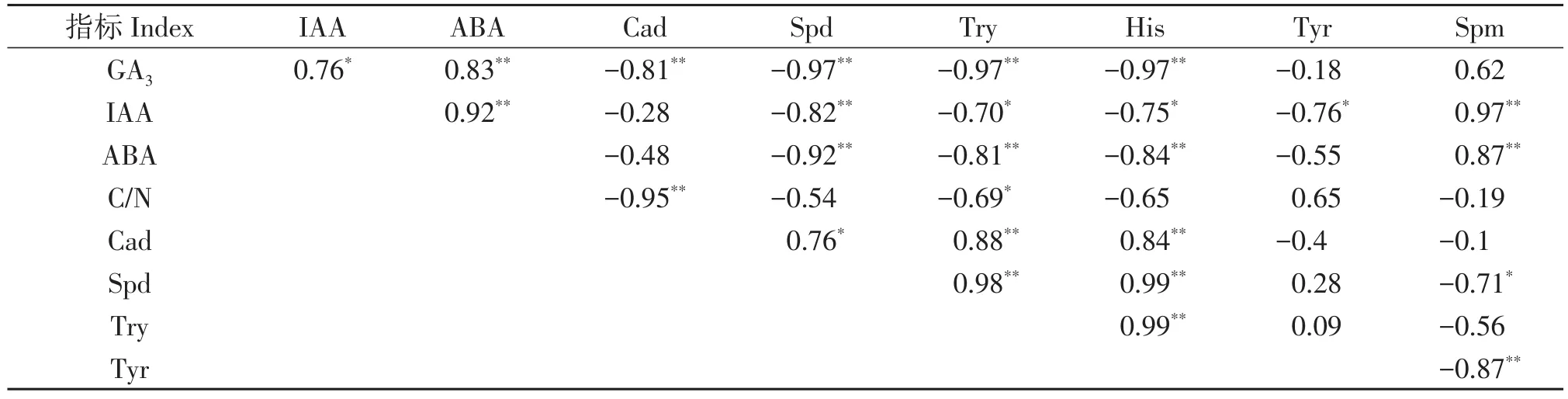
表2 花芽生理指标间相关性Table 2 Correlation matrix between physiological indexes of flower buds
2.5 主成分分析
主成分分析结果展示了不同花性分化时期激素、多胺和C/N的分类特征(图3a)。PC1轴划分了雄花和雌花(得分为正)以及花序轴分化期的花芽(得分为负)的生理特征,PC2轴划分了花序轴分化期的花芽和雌花(得分为正)以及雄花(得分为负)的生理特征。
部分顶坛花椒生理指标的主成分分析结果很好区分了不同花性分化时期(图3b):Spm、IAA、ABA、GA3和C/N对应PC1正值梯度。Cad、Try、His、Spd和Tyr对应PC1负值梯度。Cad、Try、His、Spm、IAA、ABA和Spd对应PC2正值梯度,Tyr、GA3和C/N对于PC2负值梯度。
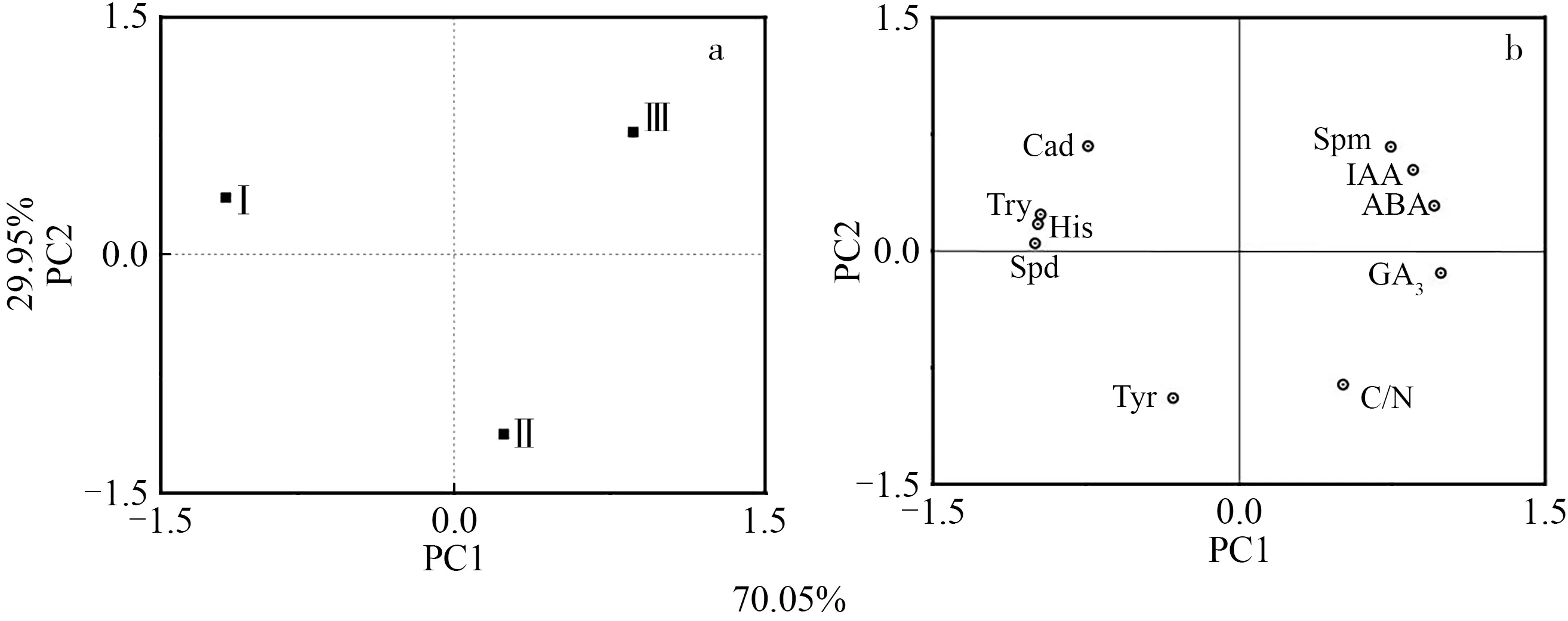
图3 不同花性分化时期顶坛花椒花芽生理指标的主成分分析Figure 3 Principal component analysis(PCA)of physiological indexes in Z.planispinum var.dintanensis flower buds during different floral sex differentiation stages
3 讨论
内源激素对植物花性分化的作用研究报道较多,已有的研究表明,GA、IAA、Eth、ABA和ZR都可能对花性分化有影响[12,25]。在本研究中,测定的5种内源激素中,顶坛花椒花性分化不同时期的Eth和ZR间无显著差异(P>0.05),雄花和雌花间GA3含量无显著差异(P>0.05),但均显著高于花序轴分化期的花芽的GA3含量,表明较高的GA3含量有利于雌花和雄花的发育。仅IAA和ABA在3个时期差异显著,且均分别表现出雌花含量最高,花序轴分化期的花芽含量最低的规律(图2),表明IAA和ABA是影响顶坛花椒花性分化的主要内源激素类型。
IAA被认为与花粉内源物质和能量的代谢有关,高IAA含量导致百合(Lilium)花粉败育[26],并对瘿椒树(Tapiscia sinensis)雌配子体发育至关重要[27]。短日光周期处理下丝瓜(Luffa cylindrica)幼苗叶片较低的IAA含量与雌花分化相关[28]。IAA应答转录因子ARF6和ARF8可以通过剂量效应调节拟南芥(Arabidopsis thaliana)雄蕊和雌蕊的成熟[29]。在麻疯树雄性和雌性器官成熟阶段,IAA相关基因均有上调[30]。本研究中,顶坛花椒雌花中IAA含量为(16.13±0.08)µg/g,比雄花IAA含量显著高出10.78%,表明较高的IAA浓度与顶坛花椒的雌花发育相关联,这与前人的研究结果一致[10,31]。
ABA对不同植物的花性别分化具有不同的调控作用[32-33]。中等含量水平的ABA有利于枣(Ziziphus jujuba)花芽分化[34]。高水平ABA可刺激柿树雄蕊原基的败育而促进雌蕊原基的发育[31],对文冠果(Xan⁃thoceras sorbifolium)花性分化研究发现,高水平的ABA具有促雌作用[14]。棕榈(Trachycarpus fortunei)雌花的ABA含量在相对应的时期均高于雄花,表明较高浓度的ABA更有利于雌花的发育与成熟[35]。我们的研究也发现,顶坛花椒雌花的ABA含量为(59.93±0.73)µg/g,显著高于雄花中ABA含量(P<0.05,图2),表明高浓度ABA有利于雌花发育。
多胺在植物体内的生理代谢中起着类似于“钙调素”的关键调节作用[36]。生理分化期的Spd含量可能与蒿柳(Salix viminalis)的花性分化有关[37]。Zhu L.H.等[38]的研究表明,苹果的花芽形成与Spm含量呈正相关。Spm还可和Spd共同作用,促进砂梨花芽分化[39]。我们的研究结果发现,顶坛花椒仅在雌花中可检测出Spm,含量达(7.89±0.31)µg/g,而在花序轴分化期的花芽和雄花中均未检出(表1),表现出Spm与顶坛花椒雌花发育强烈的关联性。这与学者在荔枝、烟草上的研究结果一致[11,40]。另外,研究发现随着顶坛花椒花性分化过程的进行,从花序轴分化期的花芽到雄花和雌花发育,Cad含量呈现先降低后升高的趋势,雄花和雌花的Cad含量均比花序轴分化期的花芽的Cad含量低,但比较雌花和雄花的Cad含量发现,雌花的Cad含量是雄花的2.18倍,二者差异显著(图2),表明较高的Cad含量可能有利于雌花发育。陈学好等[41]对黄瓜雌雄花不同发育时期多胺研究也发现,雌花从大孢子母细胞时期到花器官成熟,整个过程Cad含量均高于雄花。与Cad变化规律不同的是,随着花性分化过程的进行,Spd、Try和His则表现为持续降低的规律,进一步比较雄花和雌花后发现,雄花中Spd、Try和His含量均显著高于雌花(图2),尤其是雌花中检测不出His,表明较高的Spd、Try和His含量可能有利于雄花发育。另外,雄花中Tyr含量分别是花序轴分化期的花芽以及雌花中Tyr含量的1.83和13.60倍,表明Tyr强烈的促进雄花发育的特性。
碳水化合物和蛋白质等为植物提供营养物质,促进植物花芽分化[42]。大量研究表明,营养物质中的C和N含量决定的C/N是决定花性分化的关键。锥栗两性花的C/N比在大部分时期均显著高于雄花[17],表明高的C/N促进雌花发育。而在柿子花器官发育中,高的C/N比仅与雌蕊和雄蕊的长度相关联,与花性分化无关[18],表明C/N对花性分化是否起作用取决于植物种类。我们研究发现,花序轴分化期的花芽的C/N比较低,仅4.16±0.22。雄花和雌花的C/N则显著升高,且雄花的C/N远高于雌花,雄花的C/N是雌花的2.04倍(图2),凸显出高C/N与雄花发育之间的关联。
通过生理指标间相关性分析发现,与雄花发育密切关联的生理指标(Spd、Try、His、Tyr)和与雌花发育密切关联的生理指标(IAA、ABA、Spm)间大多数呈显著负相关(表2),表明这些生理指标与顶坛花椒雄花或雌花发育关系间的区别性。大多数生理指标在雌花或雄花中均能检出(除了雌花中未检出His,在花序轴分化期的花芽和雄花中未检出Spm),表明生理指标促进雄花或雌花发育的剂量效应。进一步采用主成分分析结果表明,花序轴分化期的花芽的PC1值最小,对应的Try、His和Spd的PC1值最低(图3),表明Try、His和Spd值较高有利于花序轴分化期的花芽发育。雌花的PC1和PC2值为正,对应Spm、IAA和ABA的PC1和PC2值为正,而雄花的PC2值为负且PC1值为正,对应象限的生理指标为C/N(图3),表明调控顶坛花椒雌花和雄花分化的生理因子明显不同,较高的Spm、IAA和ABA值是有利于雌花分化的主要生理因子,而较高的C/N值是有利于雄花发育的主要生理因子。在顶坛花椒雌花中,Spm、IAA和ABA含量显著高于雄花,雄花中C/N显著高于雌花也印证了该结果(图2,表1)。
本试验研究结果表明较高含量的IAA、ABA和Spm促进雌花分化,未来可进一步研究外源激素或多胺对花椒花性分化的调节作用,为生产实践中雄花控制提供理论基础。同时,本研究发现较高的Tyr和C/N有利于雄花发育,通过人工施用多胺或矿质养分,能否调控顶坛花椒开雄花,尚需进一步研究。

