儿童胃重复畸形的影像学表现
李辛子 王春祥 赵滨 孙焱
胃肠道重复畸形是一种罕见的先天性畸形,可发生于口腔至肛门间的胃肠道任意部位,以回肠末端相对常见,而胃重复畸形(gastric duplication cyst,GDC)仅占全部胃肠道重复畸形的2%~9%[1]。GDC病变发生部位不同,其临床表现多样且缺乏特异性,使该病诊断具有一定挑战性。本文回顾性分析经手术病理证实的5 例儿童GDC 的临床和影像学表现,结合文献资料分析该病的诊断和鉴别诊断要点,以期提高对儿童GDC 的认识和影像诊断水平。
1 资料与方法
1.1 一般资料 回顾性分析2017 年1 月—2021年8 月于天津市儿童医院经手术病理证实为GDC的患儿 5 例,男 1 例,女 4 例,年龄 10 d~6 岁。其中2 例无症状,为产前检查提示存在GDC 或在查体中偶然发现,体格检查无阳性体征;3 例因相关临床症状就诊,其中1 例体格检查存在阳性体征。患儿临床资料及所行影像检查方法详见表1。

表1 GDC 患儿的临床资料与影像检查方法
1.2 设备与方法
1.2.1 CT 检查 采用 GE revolution CT 或 Philips Brilliance iCT 设备进行腹部扫描。患儿经镇静深睡眠后平躺于检查床,双臂上举,足先进,扫描范围从右膈顶至耻骨联合,非检查区域做好辐射防护。扫描参数:管电压80 kV,自动管电流调节50~300 mA,螺距 0.992∶1,旋转时间 0.5 s/r,层厚 5 mm,层间距0。增强检查采用高压注射器经肘前静脉注射对比剂碘海醇(含碘 300 mg/mL,GE Healthcare),注射剂量1.5 mL/kg 体质量,流率0.5~3 mL/s。于腹主动脉起始部使用团注追踪阈值触发扫描,阈值220 HU,触发后分别采集动脉期、静脉期及平衡期影像。5 例GDC患儿中有4 例因年龄小、配合度差,检查前20 min口服6.5%水合氯醛(0.8 mL/kg 体质量)予以镇静。
1.2.2 MRI 检查 采用 Siemens Avanto 1.5 T MR 扫描设备,体线圈。患儿取仰卧位,扫描范围自右膈顶至耻骨联合。扫描序列及参数:横断面及冠状面抑脂 T2WI 序列,TR 6 000 ms,TE 85 ms,激励次数(NEX)2,矩阵 288×192,FOV26 cm×26 cm,层厚3.0~5.0 mm,层间距1.0 mm;横断面及冠状面T1WI序列,翻转角 80°,TR 255 ms,TE 2.4 ms,NEX 1,其余参数同抑脂T2WI 序列。增强扫描采用容积内插快速扰相梯度回波序列,FOV 同平扫。
1.2.3 上胃肠道造影检查 采用Siemens Luminos Select X 线诊断设备,检查前至少禁食4 h,常规仰卧位摄片观察胸腹部情况,口服造影剂为硫酸钡(Ⅱ型)干混悬剂30~80 mL[质量浓度1 kg/L,山东胜利药业有限公司]或复方泛影葡胺30~50 mL(含碘760 mg/mL,湖南汉森制药有限公司),于透视下转动体位依次观察食管、胃腔、十二指肠各段至空肠近端。
1.3 影像分析 由2 名具有20 年腹部影像诊断经验的放射科医师独立阅片,意见不一致时商讨确定。观察CT 和MRI 影像上病变的数量、位置、形态、密度或信号特点、与胃壁的关系、病变周围情况以及增强后强化特点等。上胃肠道造影动态观察胃肠道形态、走行、肠管蠕动、管腔充盈情况和造影剂通过情况,以及是否存在梗阻及充盈缺损等异常征象。
2 结果
2.1 影像学表现
2.1.1 CT 表现 5 例中2 例病变位于左上腹(小网膜区1 例,胃底贲门区1 例),3 例位于右上腹。5 例病变均表现为单发类圆形低密度囊性包块,囊壁均未见钙化。增强后可见囊壁强化而囊腔内均未出现明显强化,其中2 例无症状患儿的病变呈薄壁,与周围结构分界清晰;有临床症状的3 例病变均呈厚壁,其中2 例病变与周围结构分界清晰,1 例与周围肠管分界不清,肠系膜肿胀、模糊;边界清晰的病变与其毗邻的胃壁紧密连接表现为共壁(图1A-C、图2A-C)。
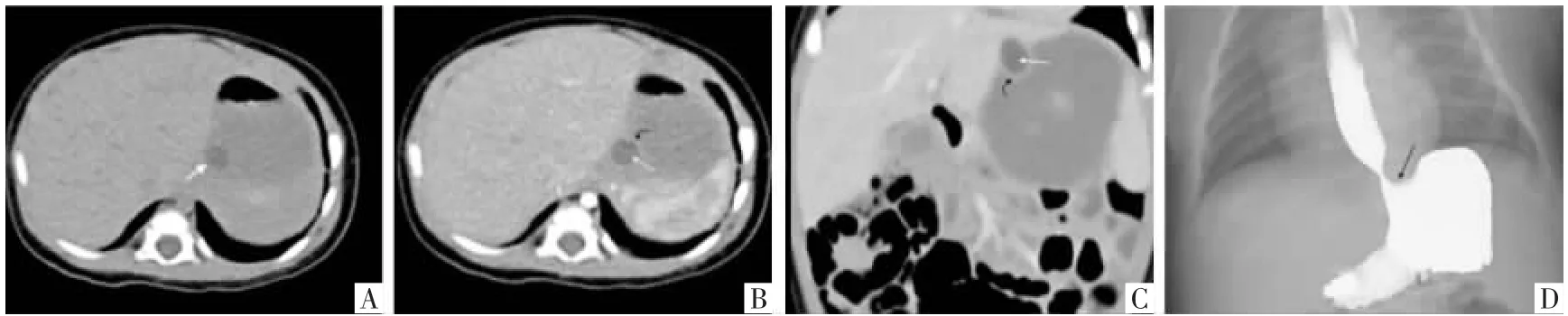
图1 患儿女,1 个月,无临床症状,出生后检查发现GDC。A 图,CT 平扫横断面影像示胃底贲门区单发边界清晰的类圆形囊性肿物,部分突向胃腔(白箭)。B、C 图,增强CT 横断面及冠状面重组影像示该病变薄壁环形强化(黑弯箭),与邻近胃壁连接紧密,病变内未见明显强化(白箭)。D 图,上胃肠道造影仰卧位像示胃底贲门区类圆形突向胃腔外压性切迹(黑箭),食管内造影剂下行尚未受阻。
2.1.2 MRI 表现 2 例无症状患儿接受MRI 检查,可见病变呈单发类圆形囊性包块,边缘见等信号薄壁,病变内部信号均匀,T1WI 呈低信号,T2WI 呈高信号。增强后囊壁呈环形均匀强化,而病变内部未见明显强化。病变边界清晰,张力较大,对胃腔有轻微推挤(图3)。
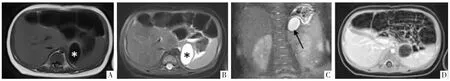
图3 患儿女,2 个月,无症状,产检发现GDC。A-D 图依次为MRI 横断面平扫T1WI 及T2WI 序列、冠状面抑脂T2WI序列及横断面抑脂增强T1WI 序列,显示脾胃间隙单发类圆形囊性包块,于T1WI 呈低信号,T2WI 呈高信号(*),囊壁(黑箭)与胃壁呈等信号,增强后囊壁可见强化。
2.1.3 上胃肠道造影 2 例患儿行上胃肠道造影检查,其中1 例为腔外型病变,表现为胃底贲门区凸面向下的光滑压迹,贲门开放尚未受影响;另1 例为少见的腔内型病变,病变位于胃窦部,表现为一体积巨大的类圆形充盈缺损区,其周围可见线样环形对比剂环绕,病变阻塞胃窦部,管腔继发高位梗阻导致胃腔显著扩张,对比剂下行困难,延迟观察仅少量对比剂进入十二指肠和近端小肠(图1D、图 2D)。
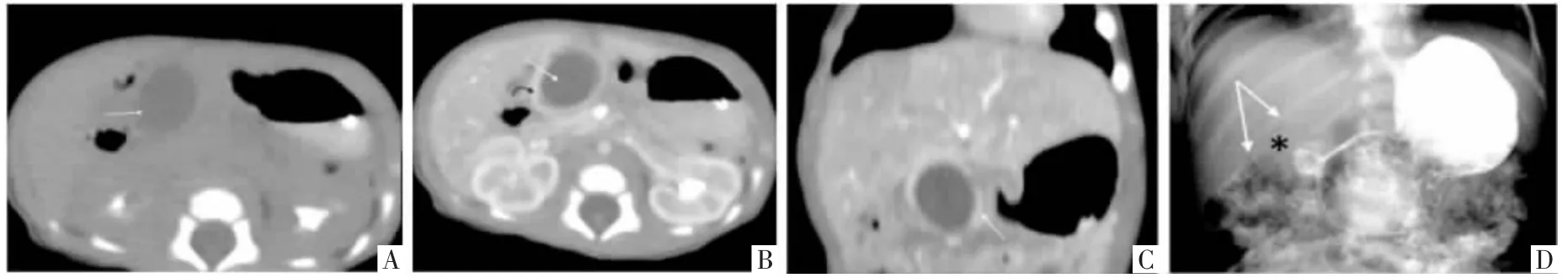
图2 患儿男,10 d,间断呕吐,诊断为GDC。A 图,CT 平扫横断面影像示右上腹低密度囊性包块,与周围结构分界不清晰(白箭)。B、C 图,增强CT 横断面像及冠状面重组影像示病变囊壁厚且呈明显强化(B 图黑弯箭,C 图白箭),囊腔内未见明显强化(B 图白箭)。D 图,上胃肠道造影仰卧位像示胃窦部巨大类圆形充盈缺损(*),周围见少量对比剂环绕(白箭),近端胃腔显著扩张,胃内容物潴留,病变以远肠管仅见少量对比剂通过。
2.2 手术及病理学表现 5 例GDC 均行手术切除,均为单发囊性病变,经术后病理证实均为GDC。4 例腔外型GDC 中有1 例与网膜组织及邻近肠管严重粘连,周围组织水肿明显,周围淋巴结肿大,术后病理证实该例GDC 伴有异位胰腺组织并纤维组织增生及慢性细胞浸润,符合病变穿孔并炎性组织包绕。1 例腔内型GDC 继发胃肠道梗阻,于镜下可见肠上皮化生。
3 讨论
3.1 发病机制及流行病学特点 关于GDC 的形成学说众多,如脊索-原肠分离障碍、原始消化管的再管腔化异常及宫内胃肠道血管意外等,但均不能完整确切解释其病因,GDC 可伴发脊柱、泌尿系统等畸形,提示该病的发生受多因素调控[2-4]。儿童GDC少见,发生率约为17/100 万[2]。女孩相对多见[5]。本研究中女童占比4/5。
3.2 病理学表现及临床特点 GDC 附着于胃,含有胃肠道平滑肌和胃肠道上皮,囊壁具分泌功能,并同正常胃组织一样可发生炎症、溃疡、穿孔,甚至癌变等病理性改变[6-7]。本研究中有1 例继发囊壁穿孔,1 例术后病理发现伴有肠上皮化生,但尚未发现确切肿瘤细胞。Kim 等[8]研究显示GDC 病变可伴发异位胰腺,发生率高达37%;本研究中有1 例GDC伴异位胰腺,与上述研究结果基本相符。
患儿多在1 岁内出现症状,也有病变于成人阶段才被发现。目前多数体积较大的GDC 可在产前发现,本研究中有1 例患儿于产前筛查发现病变。GDC 多发生于胃大弯侧,偶见于胃前后壁及胃窦部,少数位于贲门部[5]。尽管有研究[9]报道多灶性GDC,但多数GDC 为单发性病变。本研究中5 例GDC 均为单发病变。有研究[2]报道根据发病部位GDC 可分为腔内型及腔外型,也可根据是否与胃腔相通分为交通型和非交通型,其中非交通腔外型占全部GDC 的80%以上,本研究中腔外型与腔内型的比为4∶1,与上述文献[2]研究结果基本一致。GDC临床表现多样,可无症状,也可出现呕吐、腹痛、纳差及体质量减轻等非特异性表现,少数可继发胃肠道出血、穿孔等[9]。婴幼儿胃幽门部GDC,尤其是腔内型病变,可致不同程度的胃出口梗阻,出现非胆汁性呕吐,临床表现与常见的先天性肥厚性幽门狭窄和胃窦隔膜相似。年长儿多因腹痛、纳差就诊,常已继发感染。本研究中,1 例新生儿腔内型GDC 以呕吐就诊,而发病年龄相对较大的患儿以腹痛就诊,这基本与GDC 的临床表现特点相符合。
3.3 影像学特点 影像学上GDC 可分为圆形、管形和圆形-管形复合型,以圆形居多。CT 平扫表现为边界清晰的圆形或卵圆形低密度薄壁囊性包块,大小不一,一般囊壁光滑,与相邻胃壁厚度相似,囊内无分隔。当囊壁增厚或与周围边界模糊时患儿多有临床表现,提示可能有继发感染[9-10]。本研究中3例厚壁病变均继发感染或穿孔并已出现临床症状。有文献[2]报道成人GDC 囊壁可见钙化,可能与囊壁细胞分泌功能或病变坏死相关,而本研究中包括囊壁穿孔继发腹膜炎在内的5 例GDC 均未出现明显钙化,这与谢等[10]有关儿童的研究结果基本一致,可见囊壁钙化并非儿童GDC 的影像学特点。GDC 病变囊内多表现为均匀低密度,但继发出血或感染后囊内密度呈不均匀增高。MRI 软组织分辨力高,通过多平面成像能分辨其与相邻结构的关系,也有助于其与邻近器官原发性囊性病变鉴别。GDC 于T1WI 上呈均匀低信号,T2WI 上呈均匀高信号,囊壁与胃壁呈等信号。当继发出血、感染或含蛋白成分时,T1WI 上的病变信号可不均匀增高。CT 和MRI增强检查显示,囊壁呈轻度均匀强化,而囊内不出现明显强化。本研究中GDC 患儿MRI 表现典型,病变具有液体信号特点,病变位置与胃腔毗邻且囊壁与胃壁几乎呈等信号。
上胃肠道造影可动态观察胃肠道管腔内情况,腔内型GDC 表现为胃腔内充盈缺损,边界清晰。其中,胃贲门和胃窦部病变可因继发胃肠道梗阻而出现管腔扩张,临床表现出现得相对更早且明显[3]。本研究中腔内型GDC 发病年龄最小,呕吐症状出现早,程度重。腔外型GDC 也可能导致相应胃肠道外压性梗阻,此时上胃肠道造影检查可表现为胃壁出现压迹,胃壁蠕动减弱,胃腔体积变小等。
综上,儿童GDC 临床表现多样且无特异性,各种影像学检查方法特点不一。对于产前超声检查发现的病变可行胎儿MRI 进一步检查,或在生后行超声随访观察病变有无变化。对于出现症状的患儿,尤其是急诊就诊者多采用CT 检查以明确病变,观察病变与胃壁及周围邻近组织结构的关系。当有胃肠道症状或临床医生需要了解胃肠道情况时可行上胃肠道造影检查。
3.4 鉴别诊断
3.4.1 肠系膜淋巴管畸形 肠系膜淋巴管畸形是腹部常见的脉管畸形,其与正常淋巴管不相通,病变壁内含内皮细胞、平滑肌和淋巴间隙等。影像学上也表现为囊性病变,但多有分隔,壁菲薄,偶有钙化。增强后可出现强化,而囊内常为均匀液体密度/信号影;当含蛋白或出血时,囊内密度/信号均匀增高,但增强后无明显强化。其与肠管关系密切,可沿肠间隙塑性并包绕推挤邻近肠管,病变较大者可向上推挤胃腔,但与胃壁分界清晰[11]。
3.4.2 左侧腹膜后囊性病变 胃大弯侧GDC 需与左侧腹膜后囊性病变鉴别。儿童腹膜后囊性病变主要考虑节细胞神经瘤、囊性神经母细胞瘤、肾上腺血肿、腹膜后囊性畸胎瘤、腹膜后淋巴管畸形。节细胞神经瘤CT 平扫呈边界清晰的均匀低密度包块,因其为乏血供肿瘤,动脉期强化不明显,延迟扫描肿瘤可见轻度均匀强化;MRI 上病变T1WI 呈等-低信号,T2WI 信号多变,可呈等信号至不均匀高信号[12-13]。囊性神经母细胞瘤属新生儿非典型神经母细胞瘤,预后多良好,CT 表现为大囊性或小囊泡为主的肿块,边界可不规则,壁较厚,鲜有钙化,囊内可有分隔,增强后囊壁和囊内可轻度强化;其MRI表现在T1WI 和T2WI 上病变呈混杂信号而非典型液体信号[14-15]。新生儿期发现GDC 需要与肾上腺血肿鉴别,后者与围生期应激(如产伤、缺氧等)相关,MRI 随访可观察到典型血肿的信号及大小变化过程,可逐渐变小至消失;若形成假性囊肿,其外周多有钙化[14]。腹膜后囊性畸胎瘤常见于男婴,CT 上病变内部呈液体密度,囊壁较薄,可见分隔,囊壁钙化和囊内脂肪密度影是其特征表现;MRI 信号与囊内容物成分有关,一般呈液体信号,囊内可出现散在小片状在T1WI 和T2WI 上呈高信号,因囊内含角化鳞状上皮细胞脱落分解产物,在扩散加权成像(DWI)上呈扩散受限较具特点,增强后囊壁和分隔可见强化[16]。腹膜后淋巴管畸形与肠系膜淋巴管畸形发病部位不同,病变的影像表现相同[11]。
3.4.3 先天性胆总管囊肿 胃窦部GDC 需要与先天性胆总管囊肿鉴别。后者以Todani I 型最常见,占80%~90%,其他分型相对少见。典型临床表现包括黄疸、腹痛及腹部包块。GDC 与胃腔共壁,而胆总管囊肿与胆道系统关系密切。胃肠道造影常显示病变呈充盈缺损压迫十二指肠管腔。CT 典型表现为肝门下胰头区的囊状或梭形病变,边界清楚,病变内部呈均匀液体密度,囊壁薄而均匀。增强后病变无明显强化。少数伴有肝内胆管扩张者可显示沿左右肝管走行的多发囊状病变。MRI 上该病变具有典型液体信号特点,易于明确囊性病变,形态特征与CT 相似。而MR 胆胰管成像可显示病变与正常胆管延续,明确病变与胆道系统的解剖关系,多用于术前评估[17-18]。
3.4.4 胃肠道间质瘤 胃肠道间质瘤是一种胃肠道间叶源性肿瘤,病变呈实性或囊实性,易发生出血坏死,以胃小弯侧多见,胃窦部少见,好发年龄为10~18 岁。该病变CT 表现为突向胃腔的软组织包块,病变中央的坏死囊变区可使瘤体呈不均匀低密度;增强检查动脉期实性部分轻度不均匀强化,而静脉期及平衡期病变强化程度较动脉期更明显[19]。
综上,儿童GDC 的临床表现多样且缺乏特异性,影像检查能够清晰显示病变的位置、大小及病变本身的影像特征。术前多种影像检查综合评估对其临床诊断和治疗具有重要意义。

