颅内囊状未破裂动脉瘤MRI 影像标注专家共识
中国女医师协会医学影像专委会 中国脑动脉瘤智能影像诊治评估协作组
颅内动脉瘤是成人常见的脑血管疾病,未破裂动脉瘤占3%~5%[1],且好发于50~60 岁的中壮年人。成人自发性蛛网膜下腔出血约有85%为颅内动脉瘤破裂导致,一旦发生蛛网膜下腔出血则致死率可达35%,且大多数存活者都会遗留身体残疾或认知障碍,严重影响其生活质量[2-4]。
随着影像检查手段的不断丰富,颅内动脉瘤的检出率逐年增加。数字减影血管造影(DSA)是目前动脉瘤诊断的金标准,但其操作具有一定创伤性,且辐射问题不可避免,因而不建议作为普通人群的筛查手段。CT 检查速度快,是颅内动脉瘤筛查和随访的主要手段,但需考虑辐射和对比剂过敏的风险。而MRI 不仅可多平面显示病灶,且无辐射,其中广泛应用的磁共振血管成像(magnetic resonance angiography,MRA)对颅内动脉瘤诊断的敏感度可达95%,特异度可达89%[5]。目前最新的高分辨磁共振血管壁成像(high resolution magnetic vascular wall imaging,HR-VWI)可以观察到动脉瘤壁的变化。因此,MRI 适合作为风险人群的筛查及随访手段来推广,有利于临床更加精准地评估病灶。随着高场强MRI 技术的普及和应用,时间飞跃MRA(time of flight-MRA,TOF-MRA)已被推荐作为未治疗的颅内动脉瘤病人的筛查及定期影像随访方式[6]。
颅内动脉瘤的形态学变化可以反映动脉瘤发生、增长、破裂的过程。颅内动脉瘤多为无症状偶然发现,可长期保持静默,也可短时间内迅速增大、破裂,一旦病灶增长或出现形态不规则就意味着破裂风险显著增加[7-8]。采用包括病灶大小、部位、形态的预测模型对颅内动脉瘤进行破裂风险评估,其1 年的破裂风险为2.1%~10.6%[9]。由此可见,准确评估动脉瘤形态、精准分析影像数据是实现临床及时诊治的关键,而影像学指标获取的可操作性和可重复性对影像医生提出了更高的要求。
当前,颅内动脉瘤MRI 存在成像模式多样化、影像质量有差异、分析方法不规范且评价体系分散等问题,降低了人机结合分析的优势,导致影像大数据利用度的严重滞后。因此,标准化扫描及规范化标注路径的推行势在必行,不仅有利于大数据背景下的疾病分析和评估,还有利于减轻疾病造成的社会及家庭负担。经中国女医师协会医学影像专委会、中国脑动脉瘤智能影像诊治评估协作组联合AI产学研领域的专家多次商讨及修正,此次提出了颅内囊状未破裂动脉瘤MRI 影像标注共识,以供交流参考。
1 颅内囊状动脉瘤定义
颅内动脉瘤是颅内动脉管壁由于先天异常或后天损伤等因素而出现中膜受损或弹力层缺乏,造成局部血管壁损害,在血流动力学负荷及其他因素作用下管壁逐渐扩张形成局限性、病理性的膨出[10]。颅内动脉瘤依据形状分为囊状、梭形及夹层3 种类型。非囊状动脉瘤有其独特的发病机制,治疗方式与囊状动脉瘤不同[7]。本共识主要是针对囊状动脉瘤的MRI 影像标注的规范化。
2 颅内动脉瘤的MR 成像方法及质量评估
2.1 成像方法 目前,颅内动脉瘤常用的MR 成像方式包括MRA 和HR-VWI。
2.1.1 MRA 侧重于显示血管腔内情况,分为对比增强与非对比增强MRA。前者包括相位对比MRA(phase contrast-MRA,PC-MRA)及增强MRA(contrast enhanced-MRA,CE-MRA),但这 2 种成像方法由于参数复杂、需使用对比剂且成像时间较长等使其应用受限。目前临床中应用最为普遍的是非对比增强的TOF-MRA,即常规TOF-MRA。
本共识基于常规TOF-MRA 影像进行阐述。针对颅内动脉瘤进行的MRI 检查,建议采用1.5 T 及以上场强的设备,但对于大脑中动脉以及颅底的动脉瘤,推荐采用3.0 T 及以上场强的设备,有助于提高动脉瘤诊断的准确度[5]。常规采用3D 扫描,推荐分辨率为0.4 mm×0.4 mm×0.4 mm。
2.1.2 HR-VWI 也称为黑血成像,侧重于显示管壁情况。平扫仅能显示动脉管壁形态,而增强扫描可反映血管壁炎性改变等情况,且信号强度(signal intensity,SI)与动脉瘤破裂风险相关,可为临床制定治疗决策提供参考[11-12]。建议采用3.0 T 及以上场强的 MR 设备,可选择二维(2D)和三维(3D)2 种方式扫描。建议2D 扫描的分辨率至少达到2.0 mm×0.4 mm×0.4 mm 水平,3D 扫描的分辨率为 0.4~0.7 mm[13]。在开展多中心研究时同一型号的设备采集参数应保持一致。
2.2 数据保存 数据采集前均需通过伦理委员会批准,数据采集后需进行数据脱敏操作,从而保护病人隐私。建议以标准DICOM 格式的原始数据保存图像并无损传输,以满足放大缩小、窗宽窗位调整后图像不失真,图像浏览无缺层或错层等。针对原始图像的数据预处理操作,可根据研究需要在数据标注前或标注后进行,具体预处理方法及过程在此不做详细描述。
2.3 质量评估 影像质量关系到对颅内动脉瘤形态的准确评估。《颅内动脉瘤影像学判读专家共识》中提出:影像质量等级包括优、良、差三级[6]。用于动脉瘤形态学评估的影像质量应达到优或良等级,以确保影像评价的准确性及可重复性。
3 标注方法
所有影像标注均采用脱敏后的DICOM 数据,所有数据的标注过程和评估指标须达到各地方食品药品监督管理局文件的规范要求。标注结果以统一格式命名保存,应及时记录标注数据及其标注人员,并建立可溯源标签。
3.1 标注工具 工具选择需确保标注质量的一致性并兼顾效率,建议具备:①兼容多模态影像数据,可针对不同格式的标注数据进行读取、解析、存储、管理与脱敏加密,并能提供可溯源的操作日志;②可实现完善的图像显示、交互、多平面重建及标注操作,同时支持半自动辅助标注。推荐使用3D Slicer、MITK、ITK-SNAP 等免费影像分析软件进行操作,可将 MIMICS、DadiAnt、MUSIC Pair 等商用及付费医学图像标注工具作为备选。标注结果应以公开、可读取的格式保存,如Nifit、DICOM 等格式。
3.2 标注人员资质 所有参与标注的人员均需接受统一培训,且通过培训考核后方具备资质。推荐建立相对稳定的标注团队,以保证标注影像的质量。建议由至少2 名且具有≥3 年神经影像或神经介入经验的医师对原始图像进行逐层标注,再由≥10 年神经影像或神经介入经验的专家进行复核及校验,若有疑问则需经另外1 名具有≥15 年经验的资深专家进行评判。
3.3 标注审核 数据标注完成后,需由1 名具有≥10 年神经影像或神经介入经验的专家进行审核及确认。
3.4 标注评估 以DSA 的结果作为动脉瘤诊断的金标准。若无DSA 检查,参考2 位具有≥10 年神经影像或神经介入经验的专家一致性意见。同一批图像建议由2 组医生团队的人员共同完成,然后进行一致性评估。
4 标注内容
4.1 动脉瘤瘤腔 基于TOF-MRA 标注动脉瘤瘤腔,并行 3D 容积重建(volume reconstruction,VR)。重建影像经3D 旋转后可立体多角度观察,首先确认动脉瘤位置及载瘤动脉,在横断面、冠状面和矢状面上选择最佳显示角度和切面,选取最佳显示方位后在该2D 平面上进行逐层标注,覆盖全部瘤腔,同时在另外2 个2D 平面中进行确认及校正,尽量避开周围结构(图1)。
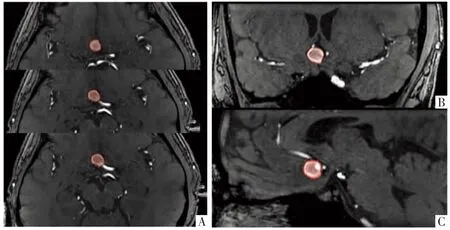
图1 TOF-MRA 的VR 影像上动脉瘤瘤腔的标注。前交通动脉瘤,经多角度观察后确认横断面(A)显示最佳,逐层勾画病灶(红色),同时在冠状面(B)和矢状面(C)中进行确认及校正,避开周围组织。
针对特殊情况,本共识做如下初步说明:①对于小动脉瘤(<3 mm)和边界灰度难以界定的动脉瘤,需结合最大强度投影(maximal intensity projection,MIP)及VR,仔细观察,并做好备注,便于后续高年资医师复核与审核。②多发动脉瘤,按照上述流程对每个动脉瘤逐一进行标注。③对于瘤颈的标注和瘤体大小的测量,本共识未做相应的讨论,推荐参考已发表的共识[6]。④对于梭形动脉瘤上伴发囊状动脉瘤生长的情况,并非本共识定义的颅内动脉瘤,待后续讨论完善。
4.2 动脉瘤瘤壁 基于黑血成像进行动脉瘤瘤壁标注。首先结合TOF-MRA 的VR 影像确认动脉瘤部位及最佳观察角度,于黑血成像原始图像上确认病灶位置,并在横断面、矢状面或冠状面上确认显示动脉瘤壁形态的最佳切面,最后在最佳2D 平面上逐层勾画,同时在另外2 个2D 平面上进行核对及校正,以完整覆盖病灶,并尽可能避开周围组织。以上操作均在增强检查的影像上进行。如遇薄壁无强化(瘤壁厚度<1 mm)的动脉瘤,对瘤壁可视部分进行线样勾画;若为环周厚壁强化的动脉瘤,则对瘤壁进行完整标注;当动脉瘤瘤壁表现为局灶性强化时,对明确强化的部分进行标注,其余瘤壁采用线样勾画即可(图2)。
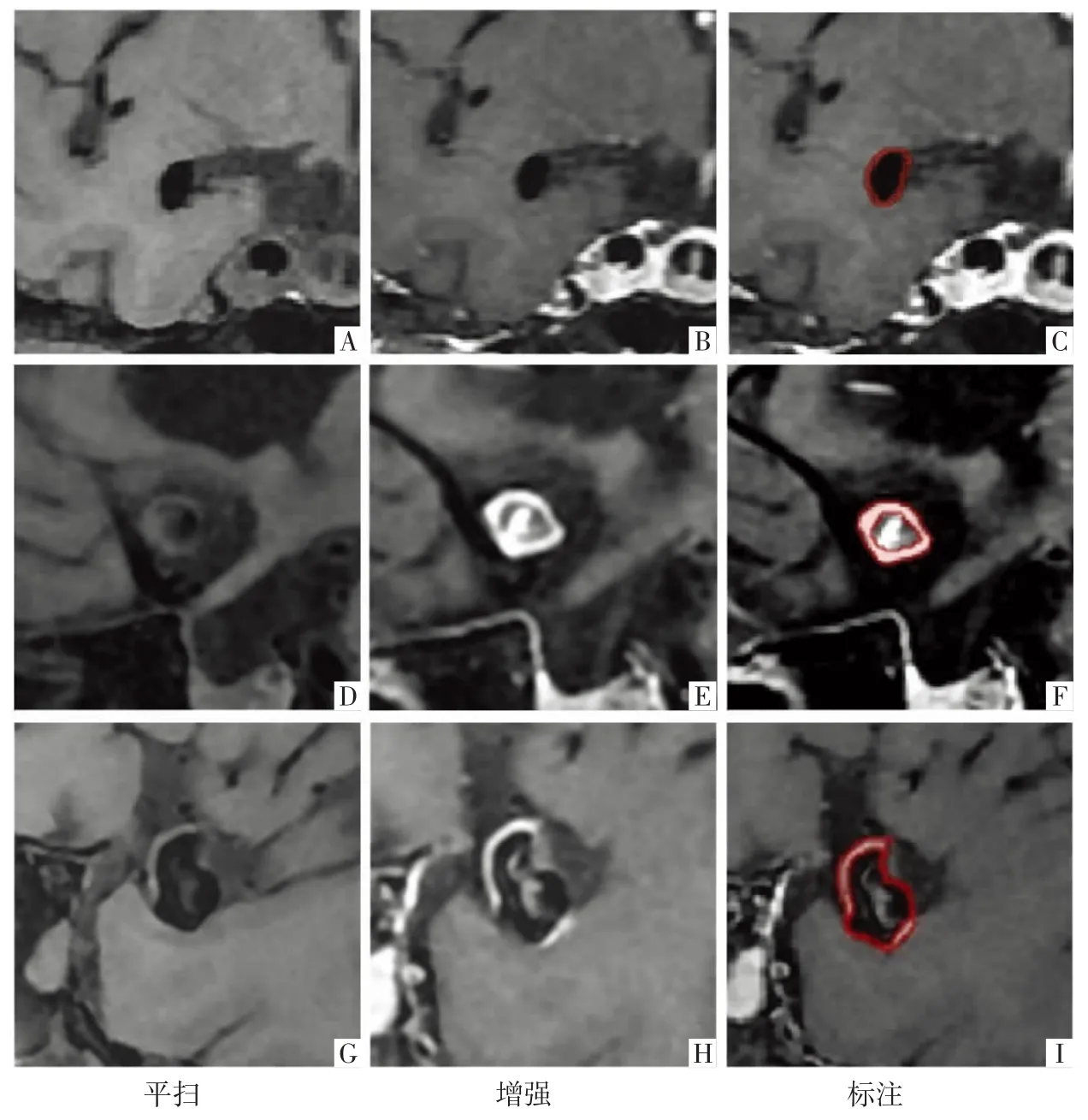
图2 TOF-MRA 的VR 影像上动脉瘤瘤壁的标注。A-C 图为薄壁无强化动脉瘤,冠状面显示病灶最佳,对瘤壁可视部分进行线样勾画(红色)。D-F 图为环周厚壁强化动脉瘤,矢状面显示最佳,对瘤壁进行完整标注(红色)。G-I 图为动脉瘤瘤壁局灶性强化,矢状面显示最佳,明显强化部分进行全层标注,薄壁无强化部分采用线样勾画(红色)。
针对特殊情况的处理方法如下:①动脉瘤腔内含附壁血栓时,需仔细甄别,建议以两侧无血栓贴附的瘤壁边缘作为参考,结合信号灰度变化趋势,沿均匀连续变化的边界区域延伸勾画。②瘤腔内出现涡流等混杂信号时,可放大紧邻瘤壁部分的影像,观察其灰阶分布后再行勾画,混杂信号位于瘤腔中央者无需特别处理。
4.3 动脉瘤壁强化判读 动脉瘤瘤壁强化程度基于黑血成像进行分析。
4.3.1 增强前后自身对照 在T1WI 增强前后的影像上,基于手动勾画的ROI 分别提取瘤壁信号强度。推荐将增强前后影像进行配准,机器可自动提取相关后影像信息。以壁强化率表示强化程度,壁强化率=(SI增强后-SI增强前)/SI增强前×100%[14]。
4.3.2 纳入标化值后判断强化程度 目前多采用垂体柄和胼胝体进行动脉瘤壁的信号强度标准化的方法[15],本共识推荐采用垂体柄作为标准化参考。以强化指数表示强化程度,强化指数=(SI动脉瘤壁增强后/SI垂体柄增强后-SI动脉瘤壁增强前/SI垂体柄增强前)/(SI动脉瘤壁增强前/SI垂体柄增强前)×100%。
4.4 载瘤动脉标注 基于TOF-MRA,由计算机对颅内动脉进行自动提取。结合动脉瘤好发部位,在对应载瘤动脉上分段提取。血管分段主要包括:双侧颈内动脉C2-C7段(C2-C5段均位于硬膜外可合并标注,或根据需要C4-C5段合并标注),双侧大脑前动脉 A1及 A2段,前交通动脉(anterior communicating artery,AcoA),双侧大脑中动脉 M1 段(分叉前、后段,分别标注),双侧大脑后动脉P1 及P2 段,后交通动脉(posterior communicating artery,PcoA),双侧椎动脉 V4 段和基底动脉(basilar artery,BA)[16]。变异动脉单独标记,并做好备注(图3)。
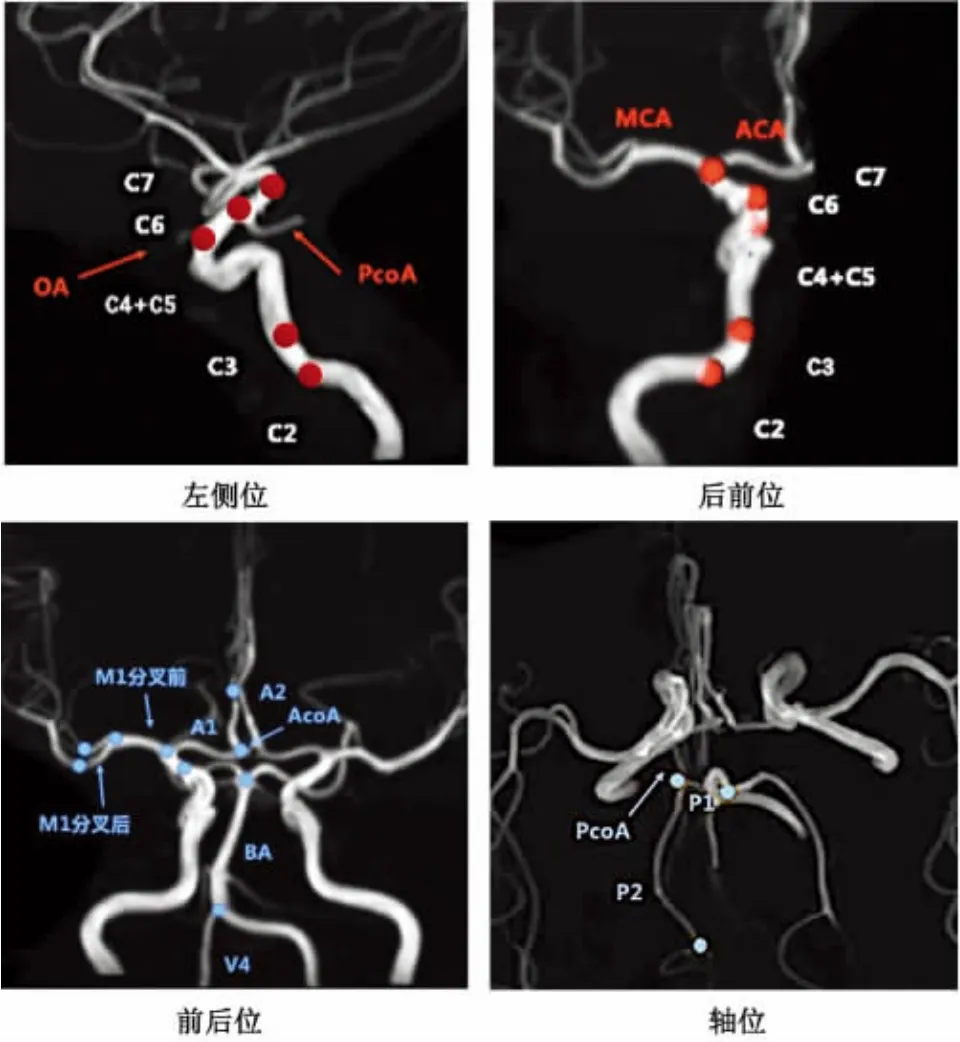
图3 TOF-MRA 影像上载瘤动脉的标注。不同方位显示颅内动脉瘤好发部位及对应的血管分段。
5 人机结合
人工智能(artificial intelligence,AI)作为医生强有力的辅助工具,在中枢神经系统疾病中的应用也日趋成熟。为了更精准地实现病灶检出、风险评估及预后判断,影像分析也逐渐从人工评价发展为人机结合的模式,以求最大程度地提取图像信息,挖掘核心指标,为疾病的诊疗方案提供有力的证据。在临床工作中,推荐基于主动学习的半自动标注。
5.1 半自动标注 相比手工标注,半自动标注可以减轻医生标注工作的负担。半自动标注时,首先由算法模型对影像中的样本进行预测,预测得到的标签会与影像一同显示在标注软件的界面上。接着由医生对模型预测的标签进行审核,对于不够准确的预测标签需要医生手动修改。修改后的标签将会进入算法模型中,重新训练模型以提升预测精度。
5.2 主动学习 由于影像数据量庞大且数据标注成本较高,即使运用了半自动标注,医生对所有数据进行一一审核仍工作量巨大。为此,引入主动学习来解决这一问题。主动学习可通过选取数据中“最不确定”或者“携带最大信息”的样本进行预测,预测后再由医生审核。如果该部分样本的审核通过率未达到阈值(根据临床实际由医生进行调整),则说明该算法模型精度未达到要求,需要重新训练后再继续预测。如果连续2 轮算法预测的结果高于阈值,则认为该算法模型的精度已达到预测的要求,可以预测其余影像数据(图4)。
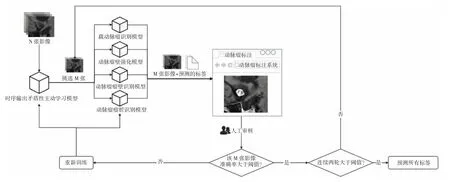
图4 人机结合主动学习流程图
6 标注参考流程
结合临床实际需求及研究目的,参照中枢神经系统肿瘤[17]、肝脏局灶性病变[18]及结直肠癌[19]标注的专家共识,颅内动脉瘤MRI 影像标注参考流程如图5 所示。
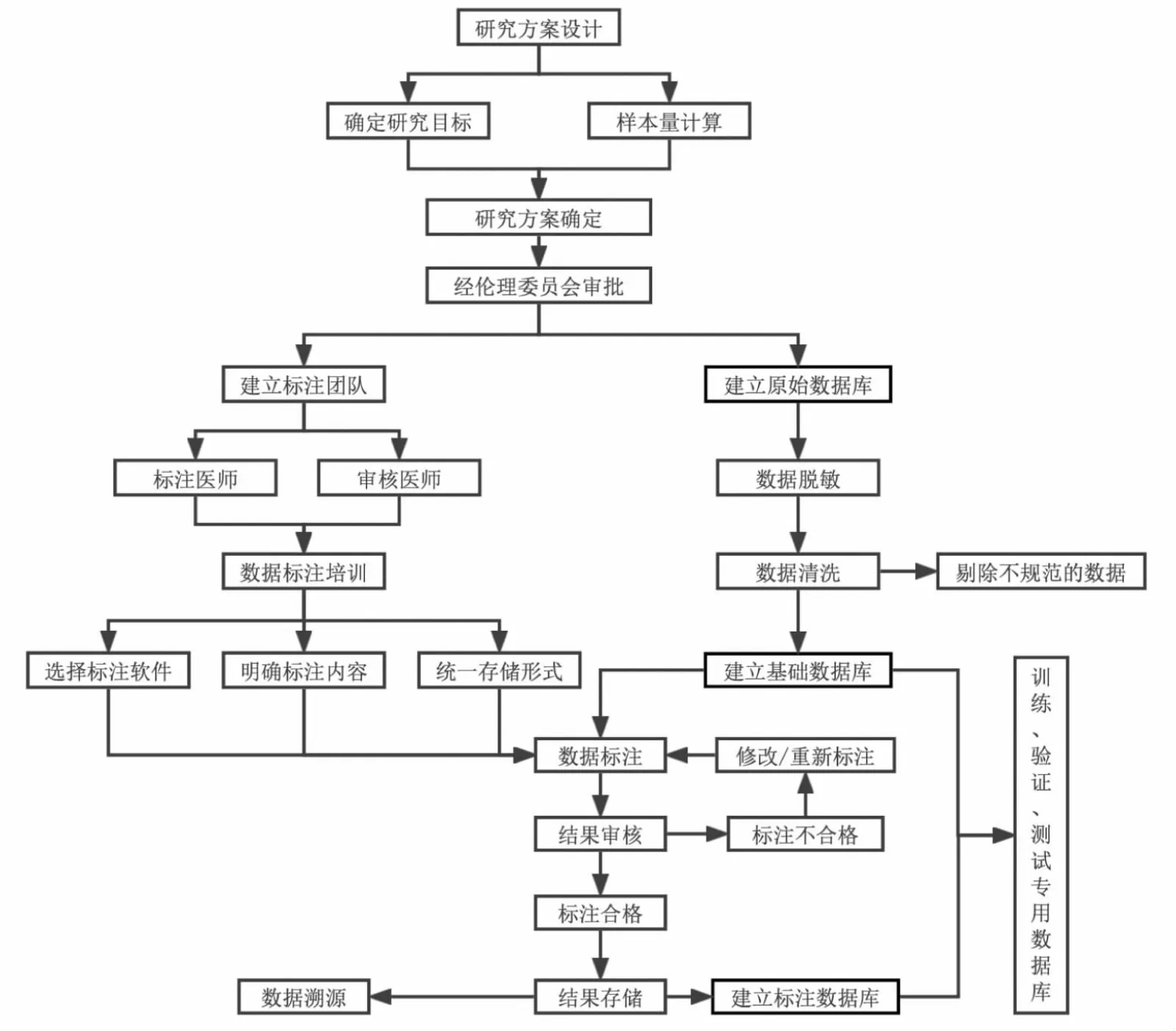
图5 颅内未破裂动脉瘤MRI 影像标注的简要流程示意图
7 小结
动脉瘤是颅内好发的血管性病变,具有较高的破裂风险。基于影像学手段和AI 技术可以及时准确地检出动脉瘤,并评估其形态特征和变化程度。本共识提出的针对颅内动脉瘤的MRI 标注流程和标准,为建设该病的影像数据库提供有力保障,从而推动AI 在临床应用的开展,最终使病人获益。
专家组成员(按姓氏笔画排序)
于泽宽(复旦大学工程与应用技术研究院),于薇(首都医科大学附属北京安贞医院),尹波(复旦大学附属华山医院),王东东(复旦大学附属华山医院),冯逢(中国医学科学院北京协和医院),冯瑞(复旦大学计算机科学技术学院),卢洁(首都医科大学宣武医院),石峰(上海联影智能医疗科技有限公司),刘先平(复旦大学附属华山医院),刘军(上海交通大学医学院附属同仁医院),刘青(天津市北辰医院),刘重生(上海市医疗器械检验研究院),刘筠(天津市第四中心医院),师毅冰(徐州市中心医院),有慧(中国医学科学院北京协和医院),朱莉(上海市胸科医院),何玲(重庆医科大学附属儿童医院),余琛林(上海深睿博联科技有限责任公司),吴世勇(湖州市第一人民医院),宋琦(上海交通大学医学院附属瑞金医院),张月浪(西安交通大学第一附属医院),张军(复旦大学附属华山医院),张晓龙(复旦大学附属华山医院),张海燕(徐州医科大学第二附属医院),张惠英(华北理工大学附属医院),张番栋(北京深睿博联科技有限责任公司),张蓓(上海交通大学医学院附属瑞金医院),李坚(福建医科大学附属第一医院),李咏梅(重庆医科大学附属第一医院),李郁欣(复旦大学附属华山医院),李海庆(复旦大学附属华山医院),李跃华(上海市第六人民医院),李璇璇(复旦大学附属华山医院),杨丽琴(复旦大学附属华山医院),汪禾青(复旦大学附属中山医院厦门医院),沈文(天津市第一中心医院),邢妩(中南大学湘雅医院),邬颖华(成都中医药大学附属医院),周书怡(复旦大学附属华山医院),周滟(上海交通大学医学院附属仁济医院),金银华(厦门大学附属第一医院翔安院区),陆建平(海军军医大学第一附属医院),陈美娟(上海辰光医疗科技股份有限公司),陈峰(海南省人民医院),陈增爱(上海交通大学医学院附属仁济医院),胡良波(重庆医科大学附属永川医院),胡喜红(复旦大学附属儿科医院),赵小虎(复旦大学附属上海市第五人民医院),赵倩茹(上海环予医疗科技有限公司),赵凌霄(中国科学院苏州生物医学工程技术研究所),赵鑫(郑州大学第三附属医院),项睿(复旦大学工程与应用技术研究院),徐凯(徐州医科大学附属医院),黄丙仓(上海市浦东新区公利医院),耿辰(中国科学院苏州生物医学工程技术研究所),耿道颖(复旦大学附属华山医院),袁慧书(北京大学第三医院),顾宇翔(复旦大学附属华山医院),曹爱红(徐州医科大学第二附属医院),曹鑫(复旦大学附属华山医院),曾延玮(复旦大学附属华山医院),程美英(郑州大学第三附属医院),隋滨滨(首都医科大学附属北京天坛医院),鲁刚(复旦大学附属华山医院),鲁宇澄(复旦大学附属华山医院),路莉(徐州医科大学附属医院),鲍奕仿(复旦大学附属华山医院),鲍海华(青海大学附属医院),薛忠(上海联影智能医疗科技有限公司)。

