脑卒中相关性肺炎的危险因素及血浆肝素结合蛋白水平对其预测价值
马玉静,张 伟,袁 欣
脑卒中是由脑部血管破裂或血管阻塞导致脑部供血不足的一种急性脑血管疾病,具有高致残率、高发病率、高病死率的特点[1]。脑卒中相关性肺炎(stroke-associated pneumonia, SAP)为其最常见的并发症之一,为继发肺实质性感染,多发生于重症脑卒中患者。脑卒中和继发肺部感染二者可相互作用,共同影响疾病预后转归[2]。因此,对SAP的危险因素和早期诊断指标进行分析有助于SAP的早期诊断与预防,从而改善临床预后。肝素结合蛋白(HBP)是中性粒细胞来源的颗粒蛋白,正常人血中含量较低,但当发生感染时,中性粒细胞受到刺激,HBP释放量增加,可作为呼吸道局部感染的诊断指标,且诊断效能较C反应蛋白和降钙素原等常用指标高[3-4]。因此,笔者对SAP的危险因素进行分析,并评估血浆HBP水平对SAP的预测价值。
1 资料与方法
1.1临床资料 回顾性分析2019年4月—2020年12月我院收治的重症脑卒中310例的临床资料。纳入标准:临床资料完整;符合1999年全国第四届脑血管病会议制定的重症脑卒中诊断标准[5],并经头颅CT、MRI等检查确诊;发病后72 h内入院;美国国立卫生研究院卒中量表(NIHSS)评分≥6分,格拉斯哥昏迷量表(GCS)评分<10分。排除标准:合并神经源性肺水肿、慢性阻塞性肺疾病、间质性肺炎或肺肿瘤者;严重心功能障碍者;肺癌、肺结核等其他肺部疾病者;卒中发病前3个月内严重感染性疾病者。根据《卒中相关性肺炎诊治中国专家共识(2019更新版)》[6]中SAP诊断标准,将重症脑卒中患者分为SAP组120例,非SAP组190例。
1.2方法 收集入组患者性别、年龄、卒中类型、卒中部位、疾病史、吸烟史、饮酒史、吞咽障碍、气管插管/切开、药物使用史、GCS、NIHSS评分等情况及HBP水平。
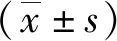
2 结果
2.1脑卒中患者SAP危险因素分析 单因素分析结果显示,SAP组年龄≥65岁、糖尿病史、慢性支气管炎、房颤、卒中史、吸烟史、吞咽障碍、气管插管/切开、使用质子泵抑制剂/H2受体阻滞剂、使用预防性抗菌药物者患者占比高于非SAP组,差异有统计学意义(P<0.01)。见表1。
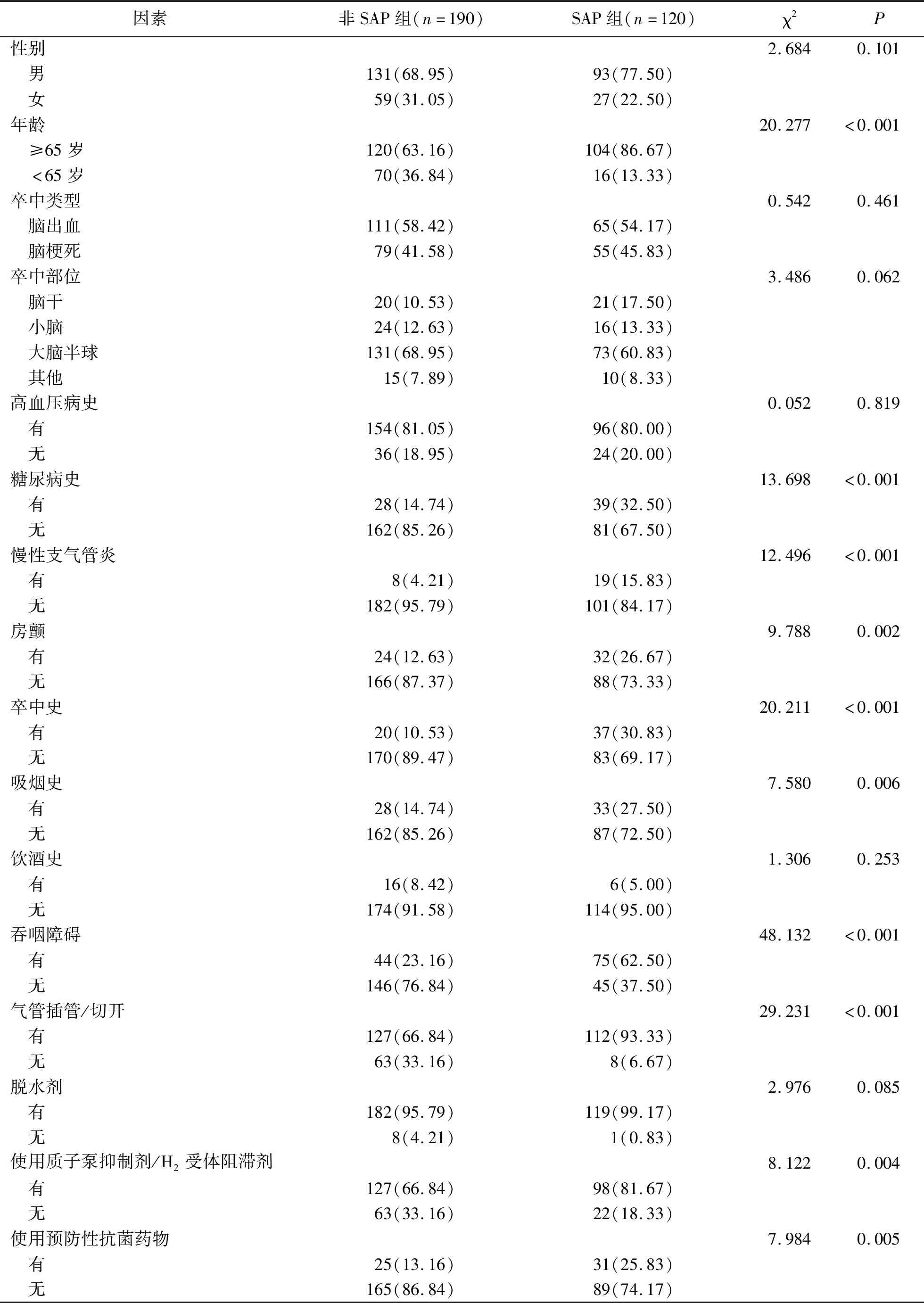
表1 重症脑卒中患者发生SAP危险因素单因素分析[例(%)]
2.2脑卒中患者发生SAP的多因素分析 以是否发生SAP为因变量,单因素分析差异有统计学意义的因素作为自变量,赋值为,性别:男=1,女=2;年龄:≥65岁=1,<65岁=2;卒中类型:脑出血=1,脑梗死=2;卒中部位:脑干=1,小脑=2,大脑半球=3,其他=4;高血压病史:有=1,无=2;糖尿病史:有=1,无=2;慢性支气管炎:有=1,无=2;房颤:有=1,无=2;卒中史:有=1,无=2;吸烟史:有=1,无=2;饮酒史:有=1,无=2;吞咽障碍:有=1,无=2;气管插管/切开:有=1,无=2;脱水剂:有=1,无=2;使用质子泵抑制剂/H2受体阻滞剂:有=1,无=2;使用预防性抗菌药物:有=1,无=2。多因素Logistic回归分析显示,年龄≥65岁、糖尿病史、慢性支气管炎、卒中史、吞咽障碍、气管插管/切开、使用质子泵抑制剂/H2受体阻滞剂、使用预防性抗菌药物是脑卒中患者发生SAP的独立危险因素。见表2。
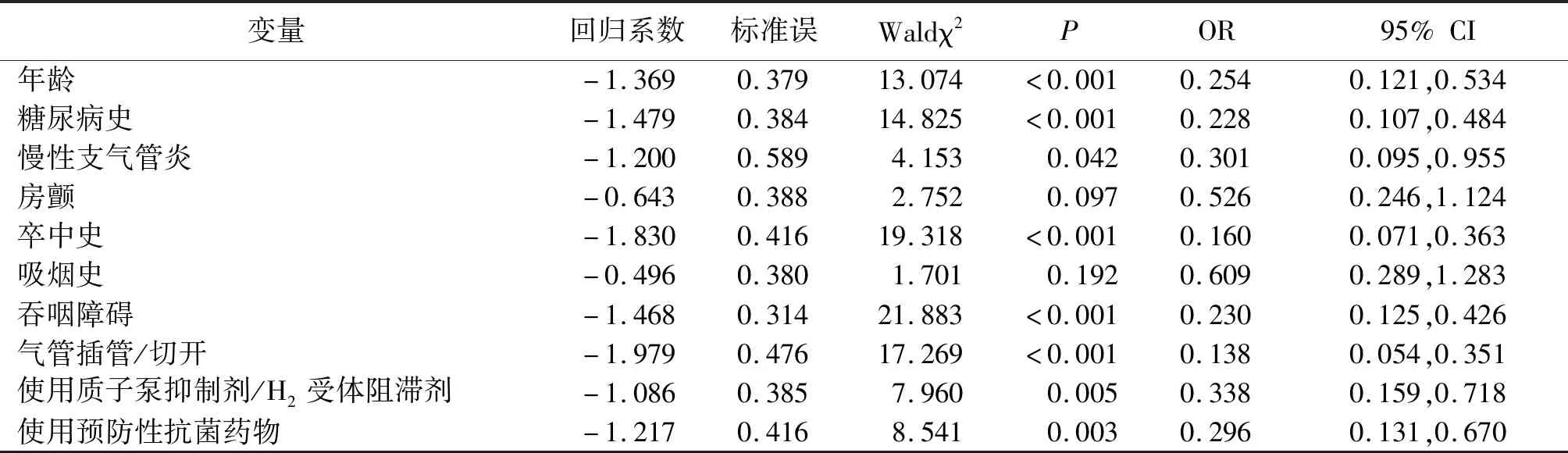
表2 重症脑卒中患者发生SAP的多因素Logistic回归分析
2.3SAP组和非SAP组HBP水平比较 SAP组HBP水平为(18.10±6.80)μg/L,非SAP组HBP水平为(7.31±2.21)μg/L。SAP组HBP水平高于非SAP组,差异有统计学意义(P<0.05)。
2.4血浆HBP对SAP的预测价值 ROC曲线分析显示,血浆HBP预测SAP的曲线下面积(AUC)为0.927,95%CI为0.885,0.969,当HBP水平>10.21 μg/L时,其敏感度为90.00%,特异度为99.50%。见图1。
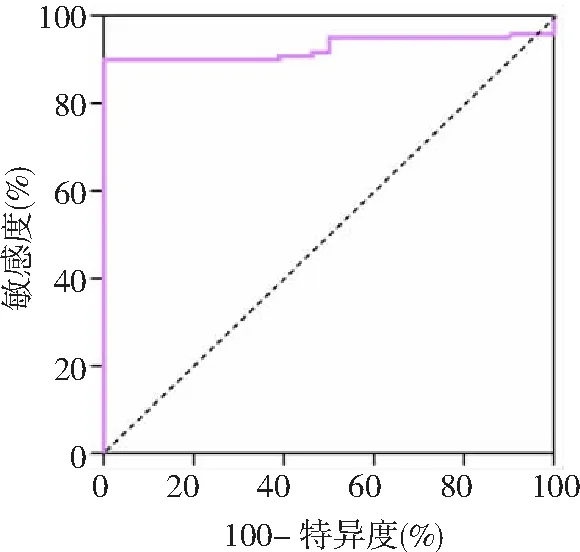
图1 血浆HBP对SAP预测价值的ROC曲线
3 讨论
肺部是重症脑卒中后首要感染部位,而SAP是导致重症脑卒中患者死亡的重要原因,存活患者也多伴随较严重的神经功能缺损,对患者预后和生活质量造成较明显的不良影响[7-8]。脑血管疾病发病率高,重症SAP患者较多,但其发病机制与诊治仍有待深入研究,因此为提高重症脑卒中患者生存率,本研究对SAP患者危险因素和早期诊断指标进行分析。
本研究经多因素Logistic回归分析显示,年龄≥65岁、糖尿病史、慢性支气管炎、卒中史、吞咽障碍、气管插管/切开、使用质子泵抑制剂/H2受体阻滞剂、使用预防性抗菌药物是重症脑卒中患者发生SAP的独立危险因素。
既往文献显示,高龄是SAP发生的独立危险因素[9],本研究结果与文献报道一致。原因为≥65岁的老年患者呼吸系统机械屏障作用减弱,清除口鼻腔分泌物的能力下降,导致误吸入肺的风险增加,从而导致SAP。已有文献报道,糖尿病史与SAP的发生有关[10],认为糖尿病引起的高糖环境不仅有利于肺部细菌繁殖,而且可抑制白细胞吞噬功能,导致机体抵御病原侵入的能力降低,造成肺部微循环障碍,从而使SAP发生率升高。慢性支气管炎控制不及时会引起肺部感染,原因是支气管感染的细菌或病毒沿气道侵入终末气道肺泡或肺间质而引起[11]。卒中史患者脑部多部位及大脑半球存在一定病变,再次发生卒中后易较早出现球麻醉,致呛咳、误吸,增加肺炎发生风险。重症脑卒中患者吞咽、咳嗽反射减弱,口鼻腔分泌物易吸入气管或下呼吸道,引起肺内感染;加上吞咽功能障碍患者早期多需要鼻饲治疗,而鼻饲会刺激食管,导致食管下括约肌松弛,咽部分泌物增加,引起胃食管反流,胃肠道和咽部细菌移位,从而导致胃肠道细菌进入肺部,增加肺部感染风险[12]。气管插管/切开会破坏下呼吸道功能,且会导致气管暴露于外界,使病原菌侵入肺部;此外气管插管会导致纤毛运动减弱,抑制气管树黏膜纤毛运动对外侵微生物的约束和清除,而气管切开则会导致营养物质摄入受限,致抵抗力降低,增加SAP的发生风险[13]。质子泵抑制剂/H2受体阻滞剂会导致胃内pH值升高,使肠道菌在胃食管内过度繁殖,而当肠道菌水平过高时,会导致胃液反流或吸入肺部,使SAP发生率增加[14]。使用预防性抗菌药物是为了预防感染,但预防性用药难以明确病原菌类型,多应用广谱抗生素,从而导致机体菌群失衡、耐药性增加,增加SAP风险。虽然对重症脑卒中患者进行SAP预防,但有些患者仍无可避免发生SAP,因此需要尽早预测,以便采取对症治疗[10]。HBP与感染性疾病有关,在SAP的病理生理过程中扮演重要角色,可作为诊断SAP的潜在指标[15]。本研究结果显示,SAP组HBP水平高于非SAP组,且血浆HBP对SAP预测的AUC为0.927,当HBP水平>10.21 μg/L时,其敏感度为90.00%,特异度为99.50%。提示血浆HBP对SAP具有较高预测价值。
综上所述,SAP的危险因素包括年龄≥65岁、有糖尿病史、有慢性支气管炎、有卒中史、有吞咽障碍、气管插管/切开、使用质子泵抑制剂/H2受体阻滞剂、使用预防性抗菌药物等,并且血浆HBP对SAP的预测价值较高。

