血清MMP-11、TGF-β1水平在胸主动脉瘤患者中的检测意义
白韬,田文海,唐康岁,彭涛,缪宜成,甘金城
胸主动脉瘤(TAA)发病率较低,但危险性较大,可进展为主动脉夹层动脉瘤或主动脉破裂,导致患者死亡,因此早期诊断胸主动脉瘤和识别其危害性具有重要意义。临床研究指出炎症反应几乎参与胸主动脉瘤的发生和发展的每个过程[1]。转化生长因子(TGF-β1)是具有调节细胞外基质代谢及炎性反应的多功能性细胞因子,在多种结缔组织相关疾病中起关键性调控作用,而基质金属蛋白酶-11(MMP-11)属于基质金属蛋白酶家族中间质溶解素类的成员之一,主要作用于丝氨酸蛋白酶抑制剂α1-抗胰蛋白酶、胰岛素样生长因子结合蛋白1的降解。文献已报道TGF-β1及MMP-11胸主动脉瘤的发生与发展密切相关[2-5],本研究通过检测胸主动脉瘤患者血清MMP-11、TGF-β1的表达,分析MMP-11、TGF-β1在胸主动脉瘤的发生发展中的相互关系。
1 资料与方法
1.1 一般资料
选用我院2020年7月~2020年12月收治的30例胸主动脉瘤患者为研究对象,将其纳入研究组。纳入标准:符合胸主动脉瘤诊断标准[5];年龄在18岁以上;患者了解并愿参与此次研究。排除标准:其他心血管疾病患者;合并代谢异常性疾病患者;其他恶性肿瘤患者。再以30例健康体检志愿者为对照,将其纳入对照组。两组临床资料具有可比性(P>0.05),见表1。
表1 两组临床资料比较[n(%),±s]
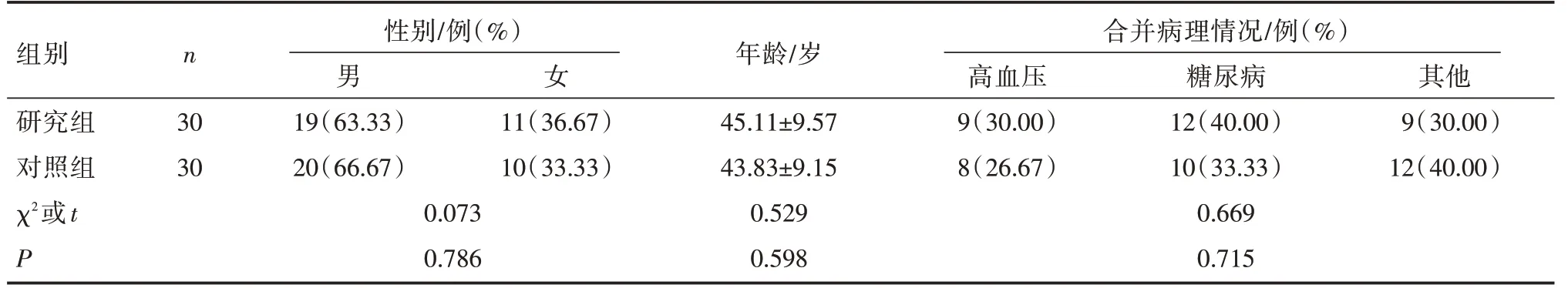
表1 两组临床资料比较[n(%),±s]
组别n 男性别/例(%)女年龄/岁高血压合并病理糖情尿况病/例(%)其他研究组3019(63.33)11(36.67)45.11±9.579(30.00)12(40.00)9(30.00)对照组3020(66.67)10(33.33)43.83±9.158(26.67)10(33.33)12(40.00)χ2或t0.0730.5290.669 P 0.7860.5980.715
1.2 检测方法
受试者初检时均于禁食8 h后采集肘前空腹静脉血2 mL放入肝素抗凝的试剂管中静置2 h,采用离心机以3000 r/min离心10 min,吸取上层血清液200μL存于试管中,并冷存备用。采用酶联免疫吸附测定法(ELISA)中的双抗体夹心法来测定MMP-11的浓度以及采用超敏免疫透射比浊法测定TGFβ1表达情况。
1.3 观察指标
对比两组受试者初检时血清MMP-11、TGF-β1表达水平差异;Pearson相关系数分析胸主动脉瘤患者血清MMP-11与血清TGF-β1水平的相关性;根据病理类型,将研究组患者分为真性动脉瘤组和主动脉夹层动脉瘤组两亚组,比较其血清MMP-11、TGF-β1水平的差异。
1.4 数据分析
采用SPSS 21.0软件进行数据分析,计量资料使用()表示,采用t检验;计数资料使用例(n)及百分数(%)表示,采用χ2检验,相关性分析采用Pearson相关系数分析模型,P<0.05表示有统计学差异。
2 结果
2.1 两组受试者初检时血清MMP-11、TGF-β1表达水平比较
研究组血清MMP-11、TGF-β1水平明显高于对照组(P<0.05),见表2。
表2 两组受试者初检时血清MMP-11、TGF-β1表达水平比较(±s)
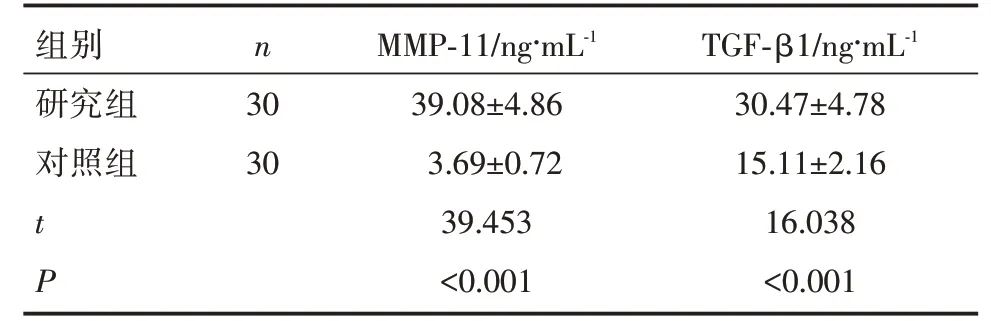
表2 两组受试者初检时血清MMP-11、TGF-β1表达水平比较(±s)
组别nMMP-11/ng·mL-1TGF-β1/ng·mL-1研究组3039.08±4.8630.47±4.78对照组303.69±0.7215.11±2.16 t 39.45316.038 P<0.001<0.001
2.2 胸主动脉瘤患者血清MMP-11与血清TGF-β1水平相关性
胸主动脉瘤患者血清MMP-11与血清TGF-β1水平呈正相关性(r=0.696,P<0.001),具体见图1。
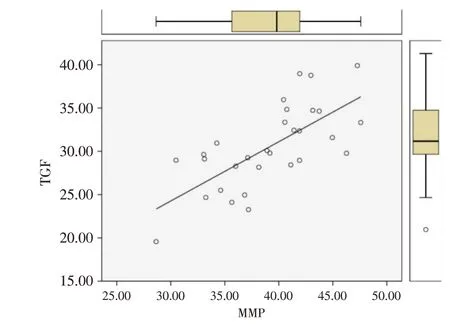
图1 胸主动脉瘤患者血清MMP-11与血清TGF-β1水平分布情况
2.3 两亚组血清MMP-11、TGF-β1表达水平比较
研究组30例患者中,真性动脉瘤21例(70.00%),纳入真性动脉瘤组;主动脉夹层动脉瘤9例(30.00%),纳入主动脉夹层动脉瘤组。真性动脉瘤组患者血清MMP-11、TGF-β1水平明显高于主动脉夹层动脉瘤组(P<0.05),见表3。
表3 两亚组血清MMP-11、TGF-β1表达水平比较(±s)
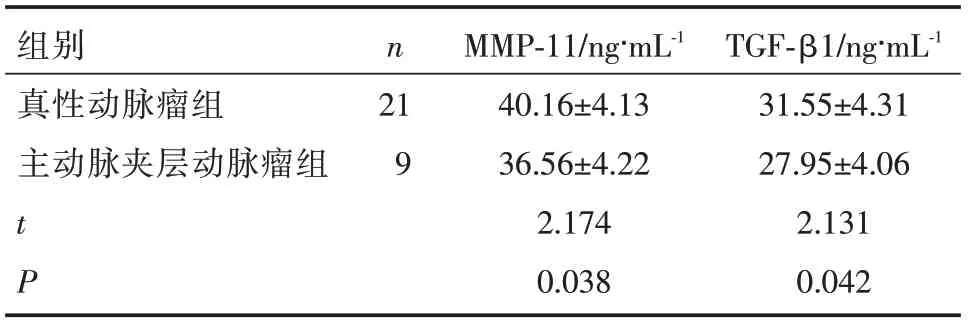
表3 两亚组血清MMP-11、TGF-β1表达水平比较(±s)
组别nMMP-11/ng·mL-1TGF-β1/ng·mL-1真性动脉瘤组2140.16±4.1331.55±4.31主动脉夹层动脉瘤组936.56±4.2227.95±4.06 t 2.1742.131 P 0.0380.042
3 讨论
胸主动脉瘤的自然病史是胸主动脉逐渐增大,可导致急性主动脉夹层和动脉瘤破裂的风险。TAA的病因多种多样,从退行性或高血压相关因素到少见的遗传性疾病,如马凡综合征、Ehlers-Danlos综合征和其他结缔组织疾病。在过去十年中,从细胞水平和分子水平方面研究TAA的发生发展如细胞信号、分子通路取得了快速进展,当今已了解人类易患主动脉瘤的基因突变因素[6,7]。
胸主动脉瘤的形成伴随着细胞外基质成分(EMC)的降解。许多基质金属蛋白酶(MMPs)参与了这一过程,基本上可以分解ECM的所有成分,其中MMP-9具有很强的分解动脉瘤壁相关弹性蛋白和大分子胶原的能力,在主动脉瘤的发生发展中占有决定性地位。在最常见的TAA发展中,MMP-1、MMP-9、MMP-12和MMP-14的表达增加[8],金属蛋白酶组织抑制剂(TIMP-1)和TIMP-2的表达减少[9,10],可见主动脉中的MMPs和TIMPs的平衡在动脉瘤的形成中起着关键作用。Jackson等研究发现MMP14和MMP19在动脉瘤中的表达增加并认为可能参与TAA形成[11]。但MMPs参与动脉瘤发生发展的很多机制尚不清楚,如TAA患者中MMPs表达与腹主动脉瘤(AAA)患者常不同,Matusiewicz等[11]研究显示TAA组织中MMP-3水平下降与AAA患者MMP-3水平不一致。
MMP-11是锌依赖性蛋白水解金属酶,可通过降解细胞外基质(ECM)蛋白、释放细胞因子、生长因子和其他细胞表面分子来促进蛋白酶依赖性肿瘤发展,并作为一种重要的蛋白酶,在肿瘤细胞、基质细胞和肿瘤周边组织中均有表达。而在肿瘤的发生发展中,MMP-11参与各种信号传导途径,在其中起着极为复杂的生理作用。本次研究显示TAA患者血清MMP-11表达水平明显增高,至少认为MMP-11可能参与TAA形成过程。
TGF-β信号在包括脉管系统在内的各种器官的发育和维持中起着至关重要的作用,TGF-β信号通路相关基因的突变导致结缔组织的遗传性疾病,如马凡氏综合征(MFS)。目前已经证实TGF-β信号的增加都有助于主动脉瘤形成,但其复杂发病机制仍缺乏全面的了解[12]。正常细胞中的TGF-β可通过其信号通路使细胞生长周期停止在G1期而抑制肿瘤细胞的增殖,但肿瘤组织中,TGF-β信号通路组成成分发生改变,多种基因突变细胞产生对TGF-β1耐受,使细胞逃避TGF-β1介导的生长抑制效应(TGF-β悖论)[12]。本次研究中,TAA患者血清TGF-β1水平明显高于对照组,可能是肿瘤组织为维持自身生长,产生大量的TGF-β1,促进肿瘤组织血管生成。
综上所述,胸主动脉瘤患者中血清MMP-11表达与TGF-β1调控关系密切,检测MMP-11、TGF-β1水平为进一步研究TAA提供数据和基础。

