淡水环境中微塑料污染及毒性效应研究进展
钱亚茹,石磊磊,沈茜,贺亚楠,贾玉巧,伍海闻,王菲菲*
1.环境基准与风险评估国家重点实验室, 中国环境科学研究院
2.包头医学院公共卫生学院
塑料制品因成本低廉,易于加工,具有耐用性和易塑性,而广泛应用于军事、航空航天、工农业生产及日常生活等各领域。全球范围内塑料的年产量已超过3亿t,且仍在不断增长[1]。塑料制品可通过物理、化学、生物等外界环境因素分解为塑料颗粒,直径小于5 mm的塑料颗粒被称为微塑料(microplastics,MPs)[2]。目前认为微塑料的来源分为初级来源和次级来源[3-4],初级微塑料是指工业制造直接排入环境中的微塑料,次级微塑料是大型塑料释放到环境中因破碎、降解形成的塑料碎片。环境中微塑料主要来源于人类活动(废水排放、工业原料及塑料垃圾的不当处理等)[5-6]。微塑料主要形状分为泡沫状、球形、纤维状、碎片状等,主要聚合物类型有聚乙烯(PE)、聚丙烯(PP)、聚苯乙烯(PS)、聚对苯二甲酸乙二醇酯(PET)、聚氯乙烯(PVC)等[7]。2015年我国海洋塑料垃圾产生量为132万~353万t/a,占全球海洋塑料垃圾产生量的27.7%,预测到2025年全球海洋塑料垃圾产生量将达2.5亿t[8]。由于塑料垃圾产生量不断增加,其破碎、降解形成微塑料,导致环境中微塑料赋存不断累积,目前已在海洋、河流入海口、湖泊等水域甚至南极、北极发现了微塑料的存在。微塑料在环境介质中的迁移主要通过淡水,且在陆地环境与海洋之间双向迁移[9],淡水是海洋环境中微塑料来源的重要途径。因此,研究淡水中微塑料的污染状况具有重大意义。
由于微塑料具有粒径小、分布广、比表面积大、光解能力弱[10]等特点,当其进入水体环境时易吸附污染物(农药、重金属及有机物等),对水体中生物造成毒性效应,并通过食物链富集,对人体健康造成潜在风险。研究显示,目前已在全球233种海洋生物的体内发现了微塑料的存在[11]。在奥斯陆峡湾内有人为活动影响的地区,选取鱼类、双壳类、棘皮类、甲壳类和多毛类等生物进行研究,发现所有生物体内均检出微塑料[12]。生物摄入体内的微塑料可以在呼吸道、胃、肠道、肝脏、肾脏等部位大量富集,可导致肠道穿孔、摄食量减少、发育异常等不良反应[13-14]。微塑料可以通过覆盖在生物表面,从而遮挡光线及氧气,阻碍营养物质交换;附着在生物体上的微塑料因其上吸附的有毒有害物质,可能危害生物正常生长发育,并对生态系统产生影响[15]。微塑料可通过食物链传递进入人体,从而可能通过引起氧化应激、代谢紊乱等毒性机制危害人体健康[16]。
笔者综述淡水水体中微塑料污染现状、毒性影响因素及其对水生生物产生的毒性效应,旨在为淡水环境中微塑料污染防治及生态风险研究提供参考,同时也为进一步评估微塑料污染的健康风险提供依据。
1 淡水环境中微塑料污染状况及影响因素
1.1 微塑料的污染状况
国内外淡水湖泊、河流中均检测到微塑料的存在。加拿大安大略湖表层水的微塑料丰度为0.8个/L[17];日本Awano 河表层水为102~146个/L,Ayaragi河表层水为86~148个/L,Asa河表层水为87~172个/L,Majime河表层水为 99~1 061个/L[18];葡萄牙Antuă河表层水为 5.8~51.7 mg/m3(10月)[19];北美的圣劳伦斯河沉积物中微塑料为(13 832±13 677)个/m2[20]。中国长江表层水的微塑料丰度为(3 407.7~13 617.5)×103个/km2[21],黄河表层水为 930个/L(旱季)和497个/L(雨季)[22];釜溪河沉积物中微塑料丰度为160~292个/kg[23];青海湖表层水的微塑料丰度高达5 000~758 000个/km2[24],洞庭湖为900~2 800个/m3[25],洪湖为1 250~4 650个/m3[25]。微塑料在不同水体中的分布及特征存在显著差异,从污染水平来看,我国淡水环境中表层水体及沉积物的微塑料赋存水平高于其他国家(表1)。
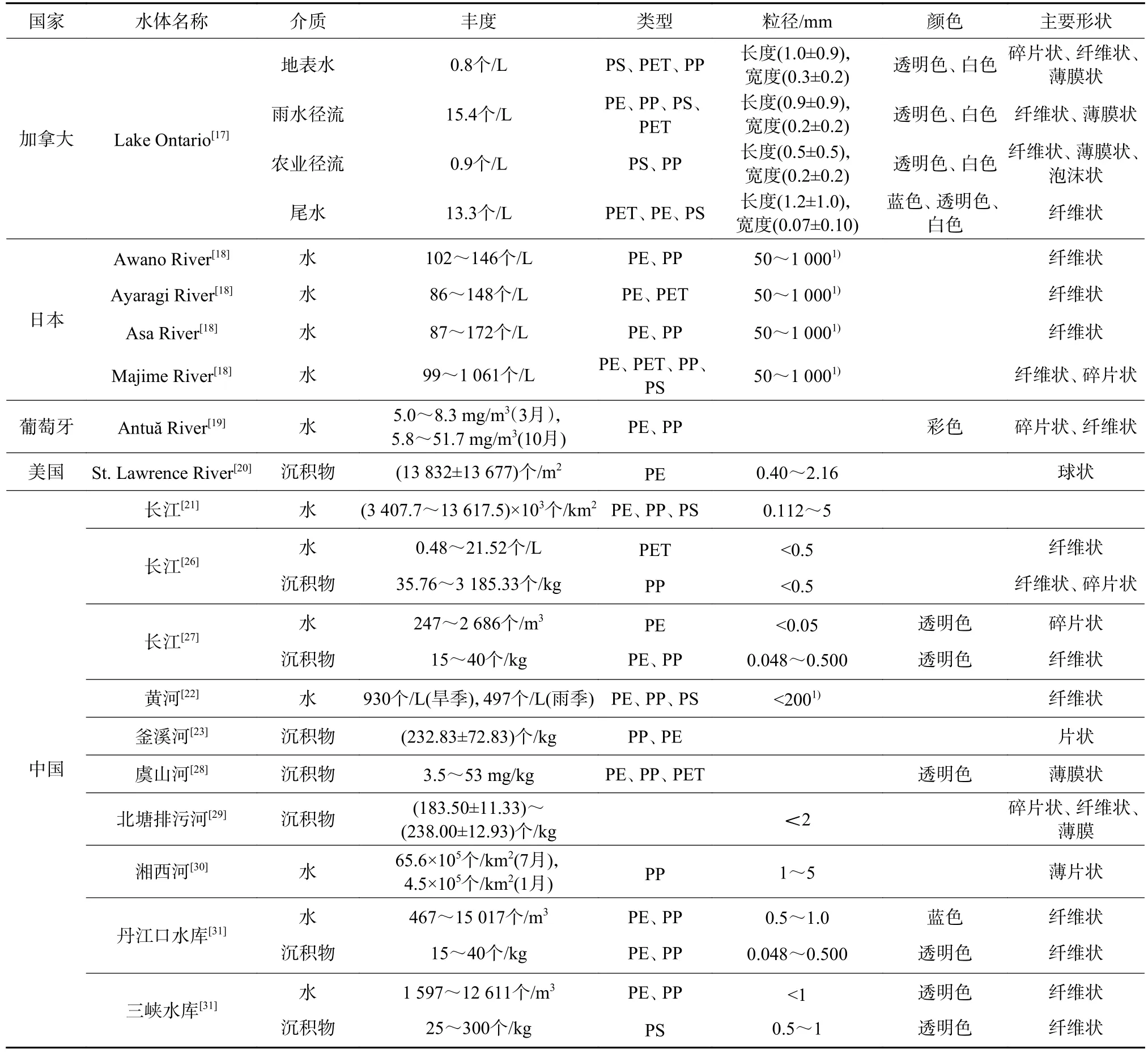
表1 淡水环境中微塑料的分布及特征Table 1 Distribution and characteristics of microplastics in freshwater environment
1.2 主要影响因素
工业、农业及生活垃圾排放等人为活动是造成淡水水体中微塑料污染的重要原因。日本小型河流Asa河与Majime河的上、中、下游均检测到微塑料,且受人口密集城区影响的下游具有比其他站点更高的微塑料丰度[18]。我国洞庭湖区水体受到微塑料的污染,呈现外河高于内渠的特征,这与外河塑料垃圾的管理相对宽松有关[32]。已有研究表明,我国长江下游沿江和河口农业区水体中微塑料污染可能与道路输入有关[33]。突尼斯Bizertexie潟湖表层水的微塑料丰度为(453.0 ±335.2)个/m3,湖周围 7条河流的表层沉积物中微塑料丰度为(2 340±227.15)~(6 920±395.97)个/kg,湖周围工业和农业活动是湖泊及入湖河流微塑料污染的原因[34-35]。加拿大安大略湖流域雨水径流具有独特的黑色橡胶颗粒成分,而污水处理厂尾水中微塑料以纤维状为主,说明微塑料污染与城市化相关[17]。
水文特征影响微塑料的分布。湖泊、河流的水动力条件存在显著差异,并影响着水体中微塑料的赋存水平。我国长江表层水体中微塑料丰度为247~2 686个/m3[27],湘西河丰水期、枯水期表层水体分别为 65.6×105、4.5×105个/km2[30],双台子河表层水体为(4.52±0.76)个/L,大辽河表层水体为(4.74±0.67)个/L[36];而三峡水库表层水体中微塑料丰度为1 597~12 611个/m3[31],丹江口水库表层水体为467~15 017个/m3[31],青海湖表层水体为5 000~758 000个/km2[24]。除湘西河外,湖泊(水库)表层水体的微塑料丰度远高于河流。
季节也是影响微塑料赋存的主要因素之一。研究表明,雨季微塑料丰度会明显高于其他季节。Rodrigues等[19]研究葡萄牙的Antuă 河微塑料赋存特征,发现表层水体中微塑料丰度在丰水期的10月最高,在枯水期的3月最低。Zhang等[30]以我国湘西河为研究对象,发现表层水体中微塑料平均丰度最高和最低的季节分别为7月和1月。Moore等[37]对美国LA河微塑料进行检测,发现雨季河流中的微塑料赋存增加。Lima等[38]对戈瓦那河口表层水体进行采样,在雨季观察到了最高浓度的微塑料赋存。较高的微塑料丰度可能与强降水期间地表径流的增加有关,径流将流域内的塑料垃圾及微塑料带入河流,导致河流水体中微塑料污染加重。
此外,微塑料的类型影响其在不同环境介质中的赋存。同一水体的表层水与沉积物中微塑料的分布与其类型密切相关,密度较小的微塑料〔如PE(0.92~0.97 g/cm3)、PP(0.90~0.91 g/cm3)、PS(1.04~1.10 g/cm3)〕大多存在于表层水中,密度大的微塑料〔如 PVC(1.16~1.5 g/cm3)、PET(1.37~1.45 g/cm3)〕易沉降到沉积物中。黄河表层水中微塑料的主要类型有PE、PP、PS,而高密度的PET检出较少[39]。Jiang等[40]对洞庭湖微塑料污染进行调查,发现地表水和沉积物样品中最常见微塑料分别为PS和PET。
2 微塑料的生物毒性效应
水体中的微塑料可对生物体造成危害,并沿着食物链不断累积,在高营养级的生物体内可能出现生物放大现象,使危害加重。图1是淡水环境中微塑料的生物摄入及食物链传递途径。

图1 淡水环境中微塑料的生物摄入及食物链传递Fig.1 Biological ingestion and food chain transmission of microplastics in freshwater environment
2.1 微塑料对浮游植物的毒性效应
浮游植物位于食物链的最底层,是水环境中重要的初级生产者,因其个体小,生命周期短,繁殖力强,对环境的变化感知十分明显,可作为监测水环境质量的指标[41]。微塑料的聚合物类型、浓度、粒径等因素均会影响浮游植物的生长发育及生理特征,毒性效应主要体现在光合作用减弱、呼吸作用效率降低从而影响其生长发育(表2)。不同聚合物类型对藻类的影响具有明显差异,如PE和PVC微塑料通过黏附在藻类细胞表面影响其光合作用,从而抑制斜生栅藻(Scenedesmus obliquus)的生长,PE对斜生栅藻的生长抑制毒性略大于PVC[42]。Wang等[43]证实了老化PVC比原始PVC对莱茵衣藻(Chlamydomonas reinhardtii)的生长抑制作用更大。微塑料的浓度增加,毒性效应也会随之增加。Wu等[44]的研究发现,PVC和PP对蛋白核小球藻和水华微囊藻的光合作用均有负面影响,较高浓度的PVC和PP抑制作用更加明显,且PVC抑制作用高于PP。Schiavo等[45]研究微塑料对特氏杜氏藻(Dunaliella tertiolecta)的生长抑制作用及DNA损伤,发现低浓度的PS、PP、PE均抑制藻类生长,抑制作用为PP>PS>PE,并且高浓度的PP具有遗传毒性效应。另外,微塑料粒径较小时,可穿过植物细胞壁,影响植物体营养及水分的吸收,导致气体交换受阻并增强光衰减,从而影响生长发育,如PVC800(1 μm)对藻类生长的抑制率大于 PVC(74 μm)[46]。

表2 微塑料对浮游植物的毒性效应Table 2 Toxic effects of microplastics on phytoplankton
2.2 微塑料对浮游动物的毒性效应
浮游动物是指悬浮于水中的水生动物,体型一般较小,种类组成复杂,在养殖业和水生态系统功能、结构中占有重要地位,且浮游动物对水体污染物较为敏感,常被用于毒理学研究,因此微塑料对浮游动物的毒性效应可作为评价微塑料水生态风险的重要依据[48]。
微塑料主要影响浮游动物的生长发育、繁殖能力、摄食能力等(表3)。PS、PVC的存在对大型溞的生长发育带来负面影响,造成产卵数、母溞体长等指标降低,且随着微塑料暴露浓度及暴露时间的增加,对大型溞的心率、摄食率、活动抑制率的影响越显著[49-51]。有研究发现,粒径越小的微塑料在生物体内的累积量越大,停留时间越长,则生物的摄食率就越低,并且会损伤生物的抗氧化防御系统[52]。在浓度为5~80 mg/L时,随着暴露浓度及暴露时间的增加,2 μm的PE对大型溞毒性效应具有剂量反应关系,活动抑制率增加;20、50 μm的PE对大型溞抑制率先增加后降低[53]。淡水湖泊中的轮虫、枝角类和桡足类浮游动物能够摄取0.1、1.0和9.9 μm的PS,但无法摄入大于100 μm的PS,大型溞对粒径为0.1和1.0 μm的PS的摄食率高于粒径为9. 9 μm的PS[54]。虽然浮游动物摄入微塑料后,一部分微塑料会通过代谢排出体外,但粒径较小的微塑料可富集在生物的组织器官中。有研究证实,微塑料摄入后大量富集在消化道,影响生物的摄食能力及消化能力,对生物的生长发育产生危害[55]。浮游动物与渔业发展密切相关,研究浮游动物体内微塑料富集水平对保护人体健康具有重要意义。
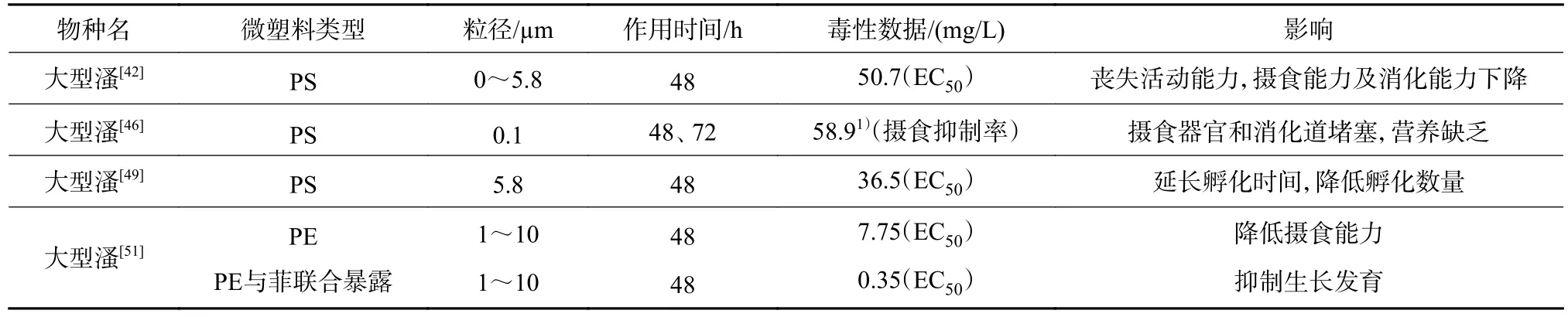
表3 微塑料对浮游动物的毒性效应Table 3 Toxic effects of microplastics on zooplankton
2.3 微塑料对底栖生物的毒性效应
底栖生物是指生活史的全部或大部分时间生活于水体底部的水生动物群。底栖生物是淡水生态系统的重要组成部分之一,是鱼类等水生生物的天然食料,也可作为环境检测的指标,对于了解生态系统的结构与功能有着重要意义[56]。
微塑料在底栖生物体内不同组织、器官中富集,对底栖动物摄食能力、消化能力、生长发育产生影响(表4)。微塑料在贻贝的多个器官均会富集,富集浓度在不同器官之间表现出显著差异,其中在肠道的富集浓度最高[57]。另外,有研究发现微塑料富集在贻贝软组织中,破坏贻贝体内平衡[58-59],导致应激和免疫相关蛋白的产生,使分配给生长的能量减少,从而影响其生长发育。Balbi等[60]的研究发现,PS影响紫贻贝幼虫的正常发育,在PS浓度较高时会导致其胚胎发育停止,并影响壳的发育。微塑料可以在食物链中传递,大型无脊椎动物可通过摄食贻贝等生物而间接摄入微塑料,对自身产生不利影响,并且影响淡水底栖生物群落的组成[61]。目前有关微塑料对底栖生物的危害研究主要集中在贝类及无脊椎生物方面。近年来贝类养殖业发展迅速,贝类产品为渔业发展带来的经济效益越来越高,人们对贝类食品的消费量逐年增加,因此微塑料对贝类生物的危害直接关系到消费者的健康。
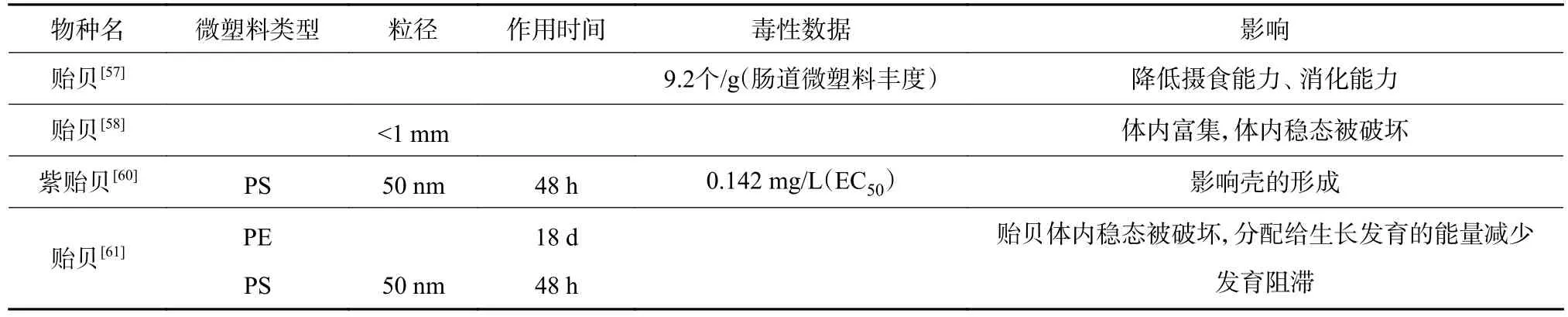
表4 微塑料对底栖生物的毒性效应Table 4 Toxic effects of microplastics on benthos
2.4 微塑料对淡水鱼类的毒性效应
鱼类是水生态系统中的顶级群落,鱼类类型多种多样,对水环境中其他种群的存在具有重要作用。随着捕捞业、养殖业的发展,鱼类作为水产品与人类生活息息相关,了解微塑料对淡水鱼类的毒性效应对保护人体健康具有重要意义[62]。
斑马鱼是研究水环境污染的理想生物模型之一,无论是胚胎阶段还是成鱼阶段,微塑料的粒径、浓度或微塑料与其他污染物形成的复合体系均会对其产生毒害作用[63-64],特别是对内分泌系统和繁殖系统产生影响(表5)。研究发现,微塑料可以进入胚胎中,并可以在幼鱼的肠道、肝脏等部位大量累积,且微塑料粒径越小,对生物体的毒害作用越大;微塑料与污染物联合后会干扰斑马鱼成鱼的内分泌系统,影响其生长发育、性激素、肝脏指数等[65-66]。赵佳等[67]也证实了微塑料的粒径与浓度是影响微塑料对生物体毒性的重要因素之一,提出暴露于低浓度微塑料下的斑马鱼胚胎正常发育,而暴露于高浓度、小粒径的微塑料导致胚胎孵化率明显降低;小粒径微塑料的生物可利用性及对斑马鱼幼鱼的毒性作用更高,且小粒径、高浓度的微塑料更易在肠道等部位累积,不易排出。

表5 微塑料对淡水鱼类的毒性效应Table 5 Toxic effects of microplastics on freshwater fish
误食、通过食物链传递是野生鱼类摄入微塑料的主要途径[70]。在鄱阳湖8种优势淡水鱼的消化道及鳃部均检测到有微塑料富集,且该富集特征与水体环境中微塑料的丰度特征相似[71]。此外,微塑料大量富集在鱼类的肝脏部位,导致黄河鲤幼鱼及红鲫鱼免疫功能、基因表达的改变,影响正常生长发育[70-71]。
2.5 微塑料与其他污染物的复合毒性
微塑料在水体中可作为吸附污染物的载体,与污染物形成复合污染物从而影响淡水生物的生长发育。有研究表明,微塑料与污染物共同存在会增强毒性,如朱志林[46]研究发现,微塑料与典型抗菌剂(TCS)的复合毒性限制了中肋骨条藻细胞内外的物质交换和能量转移,抑制其生长发育和光合作用,且该复合毒性大于微塑料单一毒性;李佳娜[72]研究发现,微塑料(PVC与PS)和雌二醇联合暴露紫贻贝,使紫贻贝血细胞活性低于微塑料和雌二醇的单一暴露;左优[73]将四溴双酚A与PS联合暴露,发现PS增加了四溴双酚A在斑马鱼体内的富集并延长停留时间,造成斑马鱼肝脏组织氧化损伤,而四溴双酚A和PS单独暴露均未产生氧化损伤;微塑料还会在一定程度上增强鱼体内重金属Cu、Cd与Pb的累积效应,并可能产生复合污染效应[69]。但也有研究发现,微塑料的存在会降低污染物的毒性作用,如姜航等[47]的研究发现,0.1 μm的PVC与罗红霉素共同存在时,会抑制斜生栅藻的生长发育,降低叶绿素a的浓度及光合作用效率,但联合毒性作用弱于PVC单一毒性作用;段鑫越等[74]研究发现,PS与金属Cd联合暴露,由于PS被斑马鱼胚胎绒毛膜阻挡,可降低金属Cd在斑马鱼胚胎内的累积,抑制Cd的生长发育毒性。目前对于微塑料与其他物质的复合毒性研究较为缺乏,具体的毒性机制尚未明确,因此需要做更多的深入研究来了解微塑料载携作用对水生生物的毒性效应。
3 结论与展望
我国淡水环境中微塑料污染严重,其赋存受人为活动、水文特征、季节及微塑料类型等多种因素影响。微塑料进入水体环境后,会影响水生植物光合作用和呼吸作用,并能通过食物链在不同营养级的生物之间传递,被生物吸收。微塑料被藻类、无脊椎动物及鱼类等摄入后,会危害其生长、繁殖能力、摄食能力,微塑料还会在摄食生物中不断传递、富集,从而对人体健康造成潜在危害。此外,微塑料极易携带各种污染物进入水体环境,微塑料与其他污染物的复合毒性会对生态系统造成潜在威胁。
微塑料广泛存在于淡水环境中,进入水体的微塑料会对不同营养级生物造成毒性效应。微塑料水质基准的制定为预防和控制微塑料对水生生物和生态系统的危害提供依据。依据HJ 831—2017《淡水水生生物水质基准制定技术指南》,微塑料水质基准的推导至少需要覆盖3个营养级,包含5个淡水水生生物物种(水生植物、浮游动物、底栖生物、硬骨鲤鱼科、硬骨非鲤鱼科),目前有关微塑料对生物急性毒性研究中,生物种类达不到水质基准推导所需要的物种种类需求。微塑料水质基准的推导急性毒性数据效应指标主要包括半最大效应浓度(EC50)、半数致死浓度(LC50),慢性毒性效应指标主要包括无观察效应浓度(NOEC)、最低观察效应浓度(LOEC)、最大允许毒物浓度(MATC)、10% 效应浓度(EC10)、20% 效应浓度(EC20),而目前微塑料淡水水生生物毒性效应指标集中在急性EC,对其他毒性效应指标的研究不足。
建议尽快开展我国淡水水体微塑料赋存特征的系统调查及本土水生生物的急性、亚急性、慢性毒理试验研究,为保护水生生物、人体健康及生态环境安全提供依据,为建立淡水环境微塑料环境基准提供科学数据支持。

