基于RNA-seq技术的雏鸡晚期离焦识别转录组学研究
孙丽媛 朱莉 陈思童 王凯 赵明威
正视化是指眼睛受到外界的视觉刺激,眼球壁向着物像焦点的方向生长,最终致屈光状态与其轴向长度相匹配的发展过程。在一些实验动物眼中已发现存在正视化过程,当其正常过程受到干预(如形觉剥夺、透镜诱导等)时,实验眼会发生异常改变导致屈光不正的出现[1]。眼睛可以锁定离焦的迹象,通过调节生长速度对正、负透镜引起的离焦做出应答。正透镜干扰时眼球生长速度降低,负透镜干扰时生长速度加快,并且这一现象广泛存在于不同物种[2]。1983 年,Williams等[3]通过给猕猴配戴负镜片,首次成功构建了透镜诱导近视(Lens-induced myopia,LIM)模型。Tatiana等[4]学者提出眼睛的生长受光学离焦信号的双向正视化(Bidirectional emmetropization by the sign of optical defocus,BESOD)机制调控,即近视和远视离焦信号可由视网膜转换为分子信号,再通过2个基本不同的离焦敏感信号级联放大传播。利用动物模型进行的研究使我们能了解正视化的机制和特点以及屈光不正的发展过程。常用的实验动物有:鱼[5]、鸡[6]、小鼠[7]、树鼩[8]、狨猴[9]、恒河猴[10]、豚鼠[11]等。近年来创新设计的透镜固定方式,如应用3D打印技术设计的头盖骨式镜框[7]可以有效、稳定地诱导出动物近视模型,给近视研究带来了便利。
近年来,随着“人类基因组计划”的逐渐完善以及各检测技术成本的迅速下降,各种组学研究方法飞速发展,其中转录组学专注于RNA水平的基因表达,并提供基因结构和基因功能的全基因组信息,以揭示特定生物过程中涉及的分子机制,提高了我们对基于RNA的基因调控网络的理解[12]。随着生物科学技术的发展,转录组学分析方法已经从对一个或几个转录本(例如,实时定量PCR)的定向定量,发展到对数千个转录本的无偏倚同时分析。下一代测序技术,主要是RNA-sequencing(RNA-seq)已经迅速成为传统技术的强大替代品[13]。本研究旨在筛选出离焦识别晚期雏鸡的后极部各组织的差异表达基因和信号通路,为屈光不正的防控提供新靶点。
1 材料与方法
1.1 动物饲养
本研究采用的实验用7 d龄白来航鸡,购自北京勃林格殷格翰维通生物技术有限公司,出生时无任何发育畸形,雌雄兼用,随机分为3组,每组10只。实验动物饲养于温度控制的房间里,并保持在正常的实验室照明下,12/12 h明暗交替光照。本研究遵循美国视觉和眼科研究协会(American Association for Vision and Ophthalmology Research,ARVO)规定的眼科研究动物使用规范。所有实验程序均经北京大学人民医院机构动物护理与使用委员会批准(批号:2018PHC059)。
1.2 实验方法
负镜诱导组即远视离焦组小鸡配戴-10 D透镜于右眼,正镜诱导组即近视离焦组小鸡配戴+10 D透镜于右眼,对照组配戴平光镜于右眼,所有小鸡左眼均不做任何干预。本实验使用的镜片均由聚甲基丙烯酸甲酯材料(PMMA)制作而成,有效光学区直径为10 mm,镜片直径12.2 mm,分别为屈光力为-10 D的负透镜、+10 D的正透镜和0 D的平光镜的单光镜片。尼龙扣分为毛面和勾面两部分,中央均打孔,镜片与勾面尼龙扣固定,毛面尼龙扣粘贴于雏鸡右眼眼周,使中央打孔位置良好暴露上下睑。为了避免对动物可能造成的应激反应而影响测量数据的准确性,毛面扣于光学干预前1 d完成眼周粘贴,次日将勾面尼龙扣镜片与毛面眼周尼龙扣贴合,开始光学干预。雏鸡配戴镜片后每天上午10时和下午3时检查镜片配戴情况,保证镜片光学区与动物瞳孔中心准确对位,并清洗镜片,以避免饲料及灰尘遮盖镜片光学区造成形觉剥夺。对于实验过程中出现镜片脱位的动物排除出组。分别于戴镜前及戴镜6 d后,行双眼带状光检影镜验光,高频A超测量眼球轴向长度,光学相干断层扫描(OCT)行后极部扫描成像。所有的生物学测量均由同一名研究人员于上午8—10时完成,采取先屈光测量后眼球生物学长度测量、先实验眼后对侧眼的顺序。
1.2.1 带状光检影验光 以1.5%异氟烷对动物进行吸入性麻醉,开睑器充分暴露角膜,暗室环境下应用带状光检影镜(YZ24,苏州六六视觉科技有限公司)进行检影。记录2条垂直子午线上的屈光度值,计算其等效球镜度。
1.2.2 眼球生物学长度 采用本实验室自主研发的高频A超检测眼部参数,该检测装置具有25MHz换能器(北京TECLAB公司),检测软件为系统自带UTSystem。取20次测量结果求取平均值,保证各个数据测量标准误差小于0.1。轴向长度定义为从角膜前部到视网膜后表面的距离[14]。
1.2.3 光学相干断层扫描 本次实验采用图湃超高速眼科扫频OCT(北京图湃扫频OCT,扫频激光光源,中心波长1 060 nm,扫描速度100 000次/s,扫描深度3 mm,图像像素1 024×1 024,轴向分辨率5 μm,横向分辨率10 μm)测量雏鸡视网膜、脉络膜、巩膜厚度,厚度测量参考既往研究[15]。由于雏鸡的视网膜、脉络膜、巩膜生理结构与人类不同,其视网膜没有黄斑中心凹[16],视网膜较厚,在视神经入口处形成特殊的眼梳膜,含有丰富的血管,伸入玻璃体内,与视网膜的营养和代谢有关。为了更加准确地量化脉络膜厚度和血流变化,本研究以眼梳膜近中心止端为定位点(见图1中A点),选取距离该点5 000 μm处测量脉络膜厚度(见图1中B点)。
1.3 RNA分离和文库制备
1.3.1 组织分离 配戴镜片6 d后使用异氟醚对小鸡进行重度麻醉并断头处死。迅速取出每只眼球,在冰上沿赤道部环形切开眼球,弃眼前节及玻璃体,使用3个冻存管分别收集视网膜/RPE、脉络膜和巩膜,放入液氮中保存。
1.3.2 总RNA的提取 各组中随机选取3个个体的组织,使用Trizol试剂按照制造商的说明从各组织中提取总RNA。RNA提取完成后,利用琼脂糖凝胶电泳检测RNA完整性,NanoDrop分光光度计测量浓度。进一步使用Agilent 2100 生物分析仪(美国Thermo Fisher Scientific公司),检测了RNA样品质量,样品质量达到A后用于后续的建库测序实验。利用磁珠法,mRNA被分离,并片段化,用于cDNA的合成。cDNA合成后,经纯化、末端修复、加A、连接头,用于PCR扩增富集。文库构建完成后,使用Agilent 2100生物分析仪进行样品文库的质控,并使用实时定量PCR(qPCR)对文库进行量化,将制作好的文库用Illumina HiSeq测序仪进行双端测序,并用测序仪自带分析软件对测序过程进行分析并输出结果。
1.4 生物信息学分析
1.4.1 数据质量控制
使用SOAPnuke(v1.5.2)[17]过滤测序数据
(1)去除接头序列。
(2)去除低质量碱基(低质量标准设置为碱基质量≤5)比例大于20%的序列。
(3)去除未知碱基('N'碱基)比例大于5%的reads,得到clean reads并以FASTQ格式存储。使用HISAT2(v2.0.4)[18]将cleandata比对到参考基因组(https://ftp.ncbi.nlm.nih.gov/genomes/refseq/vertebrate_other/Gallus_gallus/latest_assembly_versions/GCF_016700215.1_bGalGal1.pat.whiteleghornlay)。
(4)使用Bowtie2(v2.2.5)[19]将干净的reads比对到参考编码基因集,然后通过StringTie[20]计算基因的表达水平。热图由pheatmap根据不同样本中的基因表达情况绘制。
(5)使用DESeq2(v1.4.5)[21]进行差异表达分析,差异表达基因(Differentially expressed genes,DEGs)筛选标准为P<0.05和|log2FC|>1。
1.4.2 功能分析 由Phyper(https://en.wikipedia.org/wiki/Hypergeometric_distribution)基于超几何检验进行注释的不同表达基因的富集分析:Gene Ontology(GO)(http://www.geneontology.org/)和Kyoto Encyclopedia of Genes and Genomes(KEGG)(https://www.kegg.jp/)。DEG映射到PPI网络上,并将>0.4 的交互得分设置为阈值。使用Cytoscapev3.8.2软件对PPI网络进行可视化和构建。与相邻节点交互次数最多的节点被认为是中心节点。为了识别关键的 PPI 网络模块,使用MCODE对上述 PPI 网络进行模块划分(node score cutoff=0.2,K-core=2),记录得分最高的子网络,再应用cytoHubba,记录top5的基因。
1.5 统计学方法
实验研究。采用SPSS 26.0软件进行数据分析。屈光度和轴向长度测量值符合正态分布,表示为,本研究差值表示的是干预后右眼的屈光度及眼轴长度减去左眼的差值。多组之间的比较采用单因素方差分析,两组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。

图1.SS-OCT测量界面图A:眼梳膜止端;B:距离A点垂直距离5 000 μm的位置,厚度测量在B点进行。R,视网膜厚度;C,脉络膜厚度;S,巩膜厚度Figure 1.SS-OCT measurement interface diagram.A:The end of the pecten oculi.B:The position at a vertical distance of 5 000 μm from point A,the thickness measurement was performed at point B.R,retinal thickness;C,choroidal thickness;S,scleral thickness.
2 结果
2.1 屈光度和眼轴增长结果
各组间基线数据差异无统计学意义(P>0.05)。干预6 d后,对照组实验眼(右眼)保持正常生理生长,实验眼与左眼的屈光度差值为(0.20±0.96)D,眼轴长度差值为(0.04±0.06)mm;应用-10 D单光镜片施加干预后,实验眼与左眼的屈光度差值为(-8.50±1.41)D,眼轴长度差值为(0.50±0.04)mm,与对照组相比,-10 D透镜引起了明显的近视屈光变化(P<0.001)和过度的轴向伸长(P<0.001);应用+10 D单光镜片施加单眼干预后,实验眼与左眼的屈光度差值为(+9.50±1.35)D,眼轴长度差值为(-0.32±0.05)mm;与对照组相比,+10 D镜片诱导出远视漂移(P<0.001),如图2所示。
2.2 后极部组织厚度变化
采用SS-OCT对雏鸡后极部成像,各组间基线数据差异无统计学意义(P>0.05)。对比干预后右眼与干预后左眼的后极部各组织厚度变化,负镜组的视网膜厚度差值为(-5.60±13.71)μm,脉络膜厚度差值为(-79.00±29.13)μ m,巩膜厚度差值为(7.90±13.08)μ m;对照组视网膜厚度差值为(-0.50±11.35)μ m,脉络膜厚度差值为(-0.2 0±3 1.3 0)μ m,巩膜厚度差值为(1.4 0±1 4.2 7)μ m;正镜组的视网膜厚度差值为(5.90±6.92)μ m,脉络膜厚度差值为(161.40±75.83)μ m,巩膜厚度差值为(5.70±15.41)μm;各组织中仅脉络膜厚度差值各组间差异具有统计学意义(P<0.05)。如图3所示。
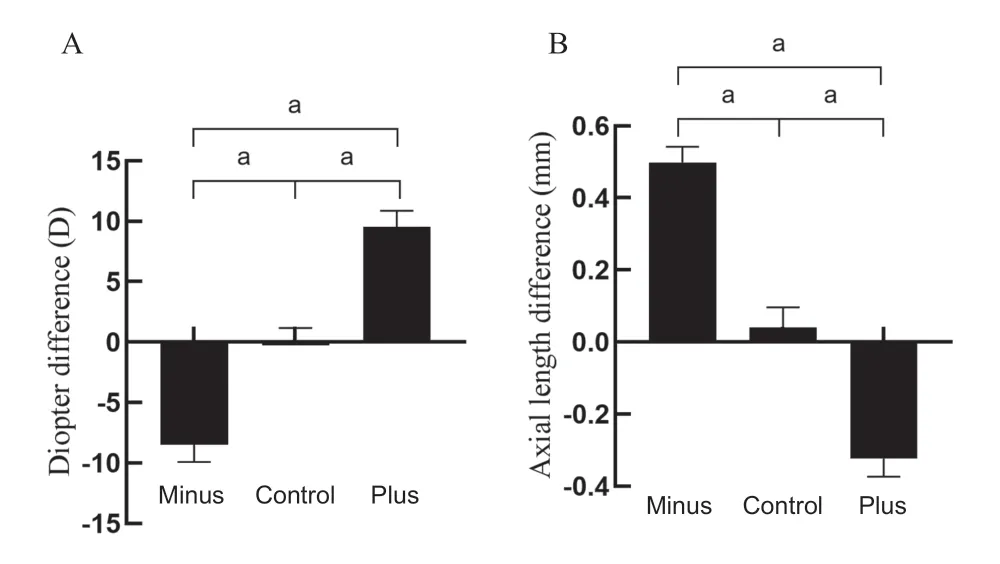
图2.透镜诱导对雏鸡屈光度和眼轴长度的作用(干预后右眼与左眼的差值)A:屈光度差值;B:眼轴长度差值。Minus,负镜组;Control,对照组(平光镜组);Plus,正镜组。a,P<0.001Figure 2.Effect of lens induction on diopter and axial length in chicks(difference between OD and OS after intervention).A:Diopter difference.B:Axial length difference.Minus,minus-lens group;Control,plano-lens group;Plus,plus-lens group.a,P<0.001.
2.3 差异基因表达
基于转录组的RNA-seq分析,鉴定了3种组织的差异表达基因。以P<0.05和|log2FC|>1为筛选标准,各组各组织差异基因表达如表1所示,差异基因由负镜/正镜组与对照组基因表达相比较而产生,重叠差异基因表示该基因在负镜组表达存在差异,同时该基因在正镜组也存在表达差异;视网膜、脉络膜和巩膜的大部分重叠差异基因的表达趋势一致,即该基因如果在负镜组表达下调,在正镜组也表达下调,上调同理;仅有脉络膜的LOC121112941表现出相反的差异表达趋势,该基因在负镜组表达上调,在正镜组表达下调。
负镜组差异表达基因在3种组织中有13个基因重合,正镜组有9个基因重合,具体信息如表2所示,其中log2FC值表示负镜/正镜组与对照组基因表达量的比值,log2FC>1表示与对照组相比,负镜/正镜组该基因表达上调;log2FC<-1表示与对照组相比,负镜/正镜组该基因表达下调。
2.4 GO功能注释
对差异基因进行GO富集分析,从细胞成分、生物学过程和分子功能3 个方面分析靶基因功能。不同透镜诱导所致的差异基因在不同组织中富集的50%以上的GO通路存在重叠(重叠通路的数量:视网膜15、脉络膜19、巩膜24),如图4所示。
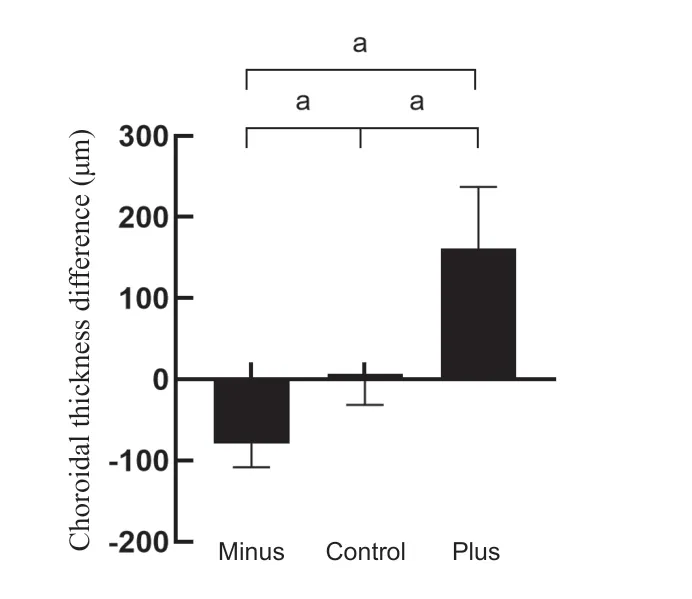
图3.透镜诱导对雏鸡后极部脉络膜厚度的影响(干预后右眼与左眼的差值)Minus,负镜组;Control,对照组(平光镜组);Plus,正镜组。a,P<0.001Figure 3.Effect of lens induction on choroidal thickness at the posterior pole of chicks (difference between OD and OS after intervention).Minus,minus-lens group;Control,plano-lens group;Plus,plus-lens group.a,P<0.001.

表1.负镜/正镜组视网膜、脉络膜、巩膜的差异表达基因数目Table 1.The number of DEGs in retina,choroid,and sclera in the minus-lens/plus-lens group

表2.负镜/正镜组视网膜、脉络膜、巩膜重叠差异表达基因Table 2.Overlapping differentially expressed genes in retina,choroid,and sclera in the minus-lens/plus-lens group
2.5 KEGG通路分析
与GO分析类似,2种处理后的KEGG通路分析也存在重叠,视网膜水平的共同通路是花生四烯酸代谢、酪氨酸代谢和视黄醇代谢。脉络膜水平的重叠途径是内质网中的蛋白质加工,精氨酸和脯氨酸代谢和视黄醇代谢。巩膜层面则为细胞粘附分子、ECM-受体相互作用、粘着斑、细胞因子-细胞因子受体相互作用、硫代谢、糖胺聚糖生物合成-硫酸软骨素/硫酸皮肤素、Toll样受体信号通路、TGF-β信号通路和MAPK信号通路,如图5所示。
2.6 PPI蛋白互作网络分析
应用STRING11.0 构建了PPI 网络,使用MCODE对上述PPI网络进行模块划分,记录得分最高的子网络于图6,应用cytoHubba,记录top5的基因于表3。
3 讨论
本研究首次通过RNA转录组测序分析研究雏鸡晚期离焦识别过程中后极部各组织的DEGs,继而通过GO、KEGG等富集分析探索具体的作用通路。通过测量长时间暴露于正/负透镜磨损产生的近视/远视离焦后视网膜、脉络膜和巩膜中的基因表达,并与对照组进行比较,本研究发现仅有LOC121112941基因在巩膜组织中表现出离焦敏感的表达,各组织在近视离焦和远视离焦的过程中,由差异基因富集到的通路存在一定程度的重合,通过PPI蛋白互作网络分析,本研究还确定了离焦识别过程中的关键基因,可为后续研究提供参考靶点。
本研究结果显示正负透镜的组间的重叠差异基因比例在各组织间保持在29%~62%之间,且重叠基因基本保持同样的表达趋势,即在正镜组中表达升高的DEGs,在负镜组同样表达增高。研究结果同时显示,负镜组3种组织的差异基因结果,存在13 个基因的重叠,而正镜组存在9 个基因的重叠,说明这些基因可能在屈光不正的发展过程中发挥重要作用。其中FBLN1 编码蛋白Fibulin-1[22]是fibulin家族的7个成员之一,为一种重要的细胞外基质支架蛋白。有研究证实Fibulin-1 蛋白在豚鼠巩膜和培养的人巩膜成纤维细胞中表达,其表达受全反式维甲酸调节,可能参与眼轴增长中的巩膜重塑过程。HSP90AA1基因编码热休克蛋白90α(Hsp90α)[23],是分子伴侣Hsp90的应激诱导异构体;HSPA5[24]基因编码结合免疫球蛋白,这是一种位于内质网腔中的Hsp70 家族伴侣。Hsp90 和Hsp70 均参与通路“内质网中的蛋白质加工”[25],该通路通过内质网相关降解确保正确的蛋白质折叠或错误折叠多肽的降解。一项研究收集了透镜诱导近视后恢复的树鼩巩膜,蛋白组学检测显示热休克蛋白70家族的成员HSPA5编码蛋白上调1.3倍[26]。PDK编码丙酮酸脱氢酶激酶[27],是线粒体中的关键酶,通过其亚基的磷酸化负调节丙酮酸脱氢酶复合物的活性,从而有助于调节葡萄糖利用和脂质代谢。作为代谢开关,在已知的同工酶中,PDK4分布最广,在哺乳动物的心肌和骨骼肌中高度表达[28]。但本研究中PDK4在正负透镜诱导组各组织中均表现出表达增高,此现象说明,无论施加何种离焦干预,均会影响动物眼部各组织的代谢反应。
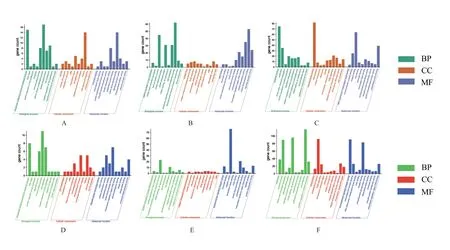
图4.差异表达基因Gene Ontology分析A、B、C:负镜组vs.对照组(A:视网膜;B:脉络膜;C:巩膜);D、E、F:正镜组vs.对照组(D:视网膜;E:脉络膜;F:巩膜)。BP,生物学过程;CC,细胞成分;MF,分子功能Figure 4.Gene Ontology analysis of DEGsA,B,C:The minus-lens group vs. control group (A:retina;B:choroid;C:sclera).D,E,F:The plus-lens group vs. control group (D:retina;E:choroid;F:sclera).BP,biological process;CC,cellular component;MF,molecular function.

图5.差异表达基因Kyoto Encyclopedia of Genes and Genomes (KEGG)分析A:负镜组vs.对照组;B:正镜组vs.对照组Figure 5.KEGG analysis of DEGs.A:The minus-lens group vs. control group.B:The plus-lens group vs. control group.
GO数据库把基因的功能分成了3 个部分分别是:细胞组分、分子功能、生物过程。本研究选取了每部分中显著性最高的10 个条目进行分析,应用正/负透镜干预雏鸡眼部发育后,各组织中二者重合条目分别为15(视网膜)、19(脉络膜)和24(巩膜),重叠比例≥50%。
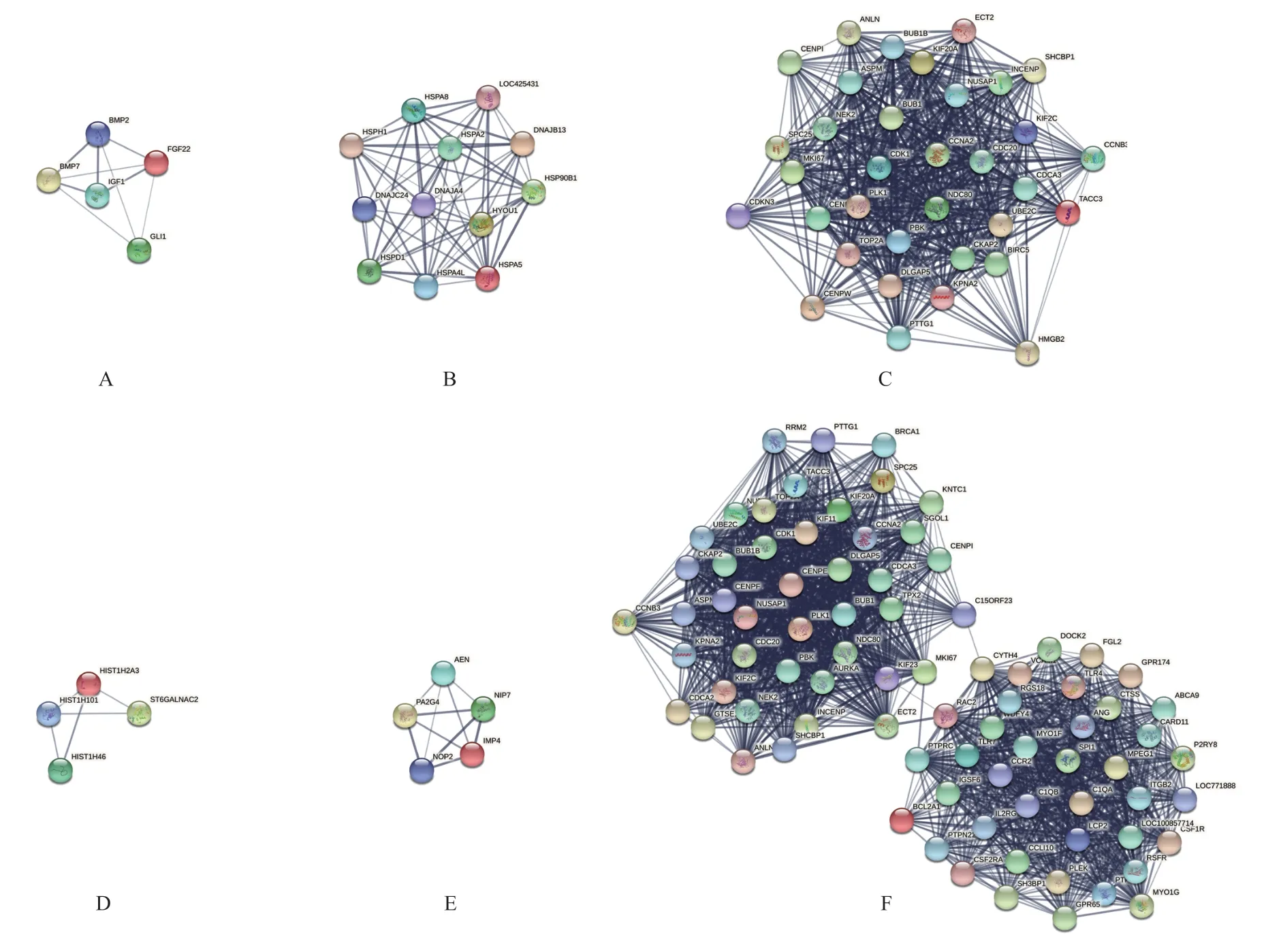
图6.Cytoscape中MCODE插件计算得分最高的子网络A、B、C:负镜组vs.对照组(A:视网膜;B:脉络膜;C:巩膜);D、E、F:正镜组vs.对照组(D:视网膜;E:脉络膜;F:巩膜)Figure 6.Sub-networks with the highest scores calculated by the MCODE plugin in Cytoscape.A,B,C:The minus-lens group vs. control group (A:retina,B:choroid,C:sclera).D,E,F:The plus-lens group vs. control group (D:retina,E:choroid,F:sclera).
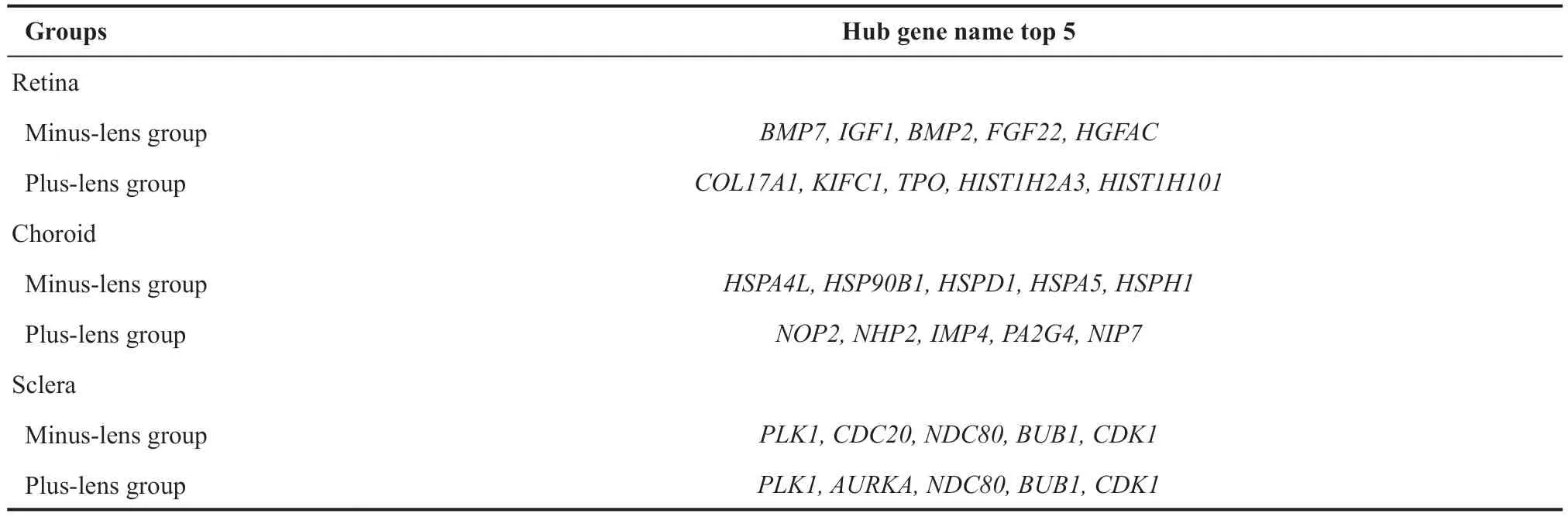
表3.负镜/正镜组视网膜、脉络膜、巩膜的Top 5 hub基因Table 3.Top 5 hub genes in retina,choroid,and sclera in the minus-lens/plus-lens group
目前,已经提出了2种用于正视化视觉控制的替代模型:模型一假设眼睛的生长速度仅受视网膜模糊量的调节而与离焦的迹象无关。在此模型中,越多的模糊促进眼球越快的生长,由于视网膜确实不能区分近视和远视离焦,所以预计强加的近视和远视离焦都会影响相同基因在同一方向上的表达。模型二则被描述为,出生后眼睛的生长受视网膜离焦迹象的控制,并且对离焦的反应是双向的,即近视离焦会主动减少生长,远视离焦会主动增加生长,该过程可能由同一个调节生长速率的控制器或2 个分别控制增加或减少生长的单独控制器调控。如果这个模型是正确的,那么强加的近视和远视离焦将有望在相反方向调节相同基因的表达或影响不同基因组的表达[29]。结合本实验的研究结果,即不同的离焦信号诱导的差异基因的重叠部分表达趋势基本一致,可以猜测该部分可能由离焦的模糊量决定;而差异基因未重叠部分可能符合模型二中的说法,即正视化过程或由2个分别控制增加或减少生长的单独控制器控制。
既往的离焦信号识别的研究证实的基因如,ZENK[30]、ABCC10[31]、ChEST927g14[32]等,在本研究中未显示出具有统计学意义的差异表达现象,考虑出现此差异的原因为实验检测的时间点不同。上述实验均在近视诱导的早期进行了差异基因的检测,而本研究着眼于离焦过程的晚期,我们在雏鸡诱导6 d后取样检测,而且本研究对雏鸡的后极部组织进行了分离,分别对视网膜、脉络膜和巩膜进行了分离采集,与既往混合实验结果比较,数据更具说服力。
KEGG富集分析结果显示:应用正/负透镜干预雏鸡眼部发育后,各组织中二者重合条目分别为3(视网膜)、3(脉络膜)和9(巩膜)。视网膜的KEGG富集通路包括花生四烯酸代谢、酪氨酸代谢和视黄醇代谢。在脉络膜中,重合通路为内质网中的蛋白质加工,精氨酸和脯氨酸代谢和视黄醇代谢。巩膜则为细胞粘附分子、ECM-受体相互作用、粘着斑、细胞因子-细胞因子受体相互作用、硫代谢、糖胺聚糖生物合成-硫酸软骨素/硫酸皮肤素、Toll样受体信号通路、TGF-β信号通路和MAPK信号通路。而上述大部分通路均在过往研究中被证实和屈光不正,尤其是与近视密切相关,也在侧面证实了本研究结果的可靠性和可重复性。例如,有研究者在豚鼠代谢组学研究中发现遮盖诱导近视会降低视网膜花生四烯酸水平[33],酪氨酸代谢和炎症通路的失调可能是近视引起的视网膜变性的机制[34]。早在2000 年,已经有研究证实脉络膜视黄酸的合成受到离焦信号的调节,并且视黄酸可以到达巩膜,调节巩膜蛋白聚糖形成[35]。Betrand等[36]对透镜诱导近/远视的雏鸡的视网膜和巩膜纤维层分别进行蛋白质组学分析,通过Western blot进一步验证得到ApoA1在视网膜和纤维巩膜中均表现出表达差异,而Apo A1可通过参与视黄酸的调节反馈影响眼球增长[37]。一项代谢组学的研究结果证实[38]病理性近视患者的硫胺素代谢发生了改变,同时提出靶向精氨酸和脯氨酸代谢可能具有缓解近视病理变化的治疗潜力。全基因组关联研究(GWAS)和动物研究已经确定了ECM-受体相互作用和粘着斑参与了屈光不正发展过程[39]。Frost等[26]在以树鼩的巩膜为观察对象的蛋白组学研究显示LIM眼中,下调的差异蛋白参与转录、细胞粘附和蛋白质合成,而近视诱导恢复组巩膜差异表达蛋白涉及细胞粘附、细胞分裂、细胞骨架和ECM结构蛋白等信号通路。Guo等[40]研究了LIM豚鼠巩膜中miRNA的表达谱,KEGG通路富集分析表明,差异表达的miRNA涉及TGF-β信号通路。Zhu等[41]发现在近视期间异常表达的miRNA调控的可能通路包括MAPK信号通路。糖胺聚糖生物合成-硫酸软骨素/硫酸皮肤素通路则主要在巩膜的生物力学特性改变方面发挥作用[42]。
本研究中的PPI网络分析结果输入cytoHubba插件,记录了各组织top5的hub基因,发现巩膜组织的hub基因存在明显重合。其中PLK-1[43]可与Polo-box结构域结合的底物相互作用并促进细胞周期。CDC20[44]是一种细胞周期检查点控制因子,在有丝分裂后期承担细胞的关键功能。NDC80[45]复合物,是最重要的动粒元件之一,在负责微管附着的动粒蛋白中起核心作用,参与有丝分裂纺锤体组装和纺锤体检查点信号。CDK1[46]高表达可促进细胞周期。BUB1[47]促进染色体排列并有助于调节有丝分裂持续时间。总之上述基因均与细胞周期调控密切相关,可能为后续的研究提供更多可参考的靶点基因。
本研究没有进一步进行基因的机制研究,后续应该在细胞和动物水平上通过RNA干扰、过表达、玻璃体腔注射通路抑制剂等手段进一步验证基因和相关通路在正视化过程中的作用,为屈光不正的治疗奠定基础。
本研究结果表明,经过正负透镜诱导后,雏鸡后极部各组织中的差异基因重叠比例在29%以上,2 组的差异基因在GO分析和KEGG分析结果存在重叠,且除LOC121112941基因外,绝大多数重叠基因保持着相同的上调或下调表达趋势,但仍有部分差异基因未重叠,说明近视和远视离焦的模糊程度和离焦方向可能同时影响动物正视化过程。然而,确切的机制仍需要进一步研究。
利益冲突申明 本研究无任何利益冲突
作者贡献声明 孙丽媛:酝酿和设计实验,实施研究,采集数据,分析、解释数据,起草文章,统计分析,根据编辑部的修改意见进行修改。朱莉:酝酿和设计实验,对文章的知识性内容作批评性审阅,指导。陈思童:实施研究,采集数据,起草文章。王凯:酝酿和设计实验,对文章的知识性内容作批评性审阅,获得研究经费,行政、技术或材料支持,指导。赵明威:酝酿和设计实验,对文章的知识性内容作批评性审阅,获得研究经费,行政、技术或材料支持,指导,支持性贡献

