Vipr2敲除对小鼠视网膜功能的影响
赵福新 汪琪 王莉 阳凡 郑阳洋 赵晨琛 朱禾 周翔天 瞿佳
血管活性肠肽受体2(Vasoactive intestinal peptide receptor 2,VIPR2)是一种7个跨膜的G蛋白偶联受体,与配体血管活性肠肽(Vasoactive intestinal peptide,VIP)结合被激活后,经环磷酸腺苷依赖的蛋白激酶A途径和磷酯酶C途径发挥生物学效应。主要参与生理节律调节,影响细胞增殖和分化,抑制细胞因子合成分泌,调控机体免疫功能[1]。
目前研究发现VIPR2与近视相关。如石毅等[2]通过全基因组关联分析,发现VIPR2(rs2730260)与高度近视关联;而Zhao等[3]发现VIPR2SNP位点rs6979985与高度近视相关。这些研究在遗传学上均提示VIPR2与近视相关。另外,研究显示小鸡形觉剥夺诱导后视网膜VIPR2表达升高[4]。给予小鸡非选择性VIP受体拮抗剂(VIP hybrid),可有效减缓鸡形觉剥夺性近视(Form deprivation myopia,FDM)的进展,并下调小鸡形觉剥夺眼视网膜VIP蛋白和mRNA的表达[5];而其他研究给予小鸡玻璃体下腔注射VIP可明显抑制FDM的形成,并且会导致VIPR2mRNA表达水平下调[6]。这些研究结果均表明VIPR2在近视进展中发挥作用,可能的效应部位在视网膜,但VIPR2如何影响视网膜功能导致近视并未完全阐明。
文献报道显示生理节律变化与近视有关,Stone等[7]认为视网膜节律改变可能影响近视的进展;Lee等[8]发现BMAL1基因(调控节律时钟重要的转录因子)敲除小鼠发展为近视。多巴胺(Dopamine,DA)是视网膜一种重要的神经递质,视网膜DA合成和代谢[9-10]具有节律性并参与屈光发育、影响近视形成[11-13]。大量研究证实Vipr2调控小鼠生理节律[14-15]。Vipr2作为视网膜一个重要的节律基因是否通过影响视网膜DA等递质的合成与分泌,并影响电生理功能参与近视?为明确此问题,本研究将利用Vipr2敲除小鼠检测视网膜DA等神经递质水平及电生理变化,探讨VIPR2对视网膜功能的影响。
1 材料与方法
1.1 实验动物
采用的4周龄雄性C57BL/6J小鼠,由温州医科大学实验动物中心提供。Vipr2敲除小鼠的构建利用CRISPR-Cas9 基因编辑技术完成(南京大学-南京生物医药研究院)。利用CRISPR-Cas9删除Vipr2基因的第2个外显子序列(100 bp),导致新转录的mRNA翻译蛋白时密码子产生移码突变,多肽合成提前中止,生成的截短蛋白无法发挥VIPIR2 蛋白正常的生物学功能达到Vipr2基因敲除的目的。具体操作如下:首先设计针对Vipr2基因的gRNA和Cas9表达质粒,这2种质粒通过原核显微注射到受精卵随后移植到代孕鼠中,子代鼠基因型通过聚合酶链式反应(PCR)和Sanger直接测序验证获得F0代阳性杂合子小鼠(Vipr2+/-)。F0代小鼠(Vipr2+/-)与C57BL/6J小鼠交配,PCR鉴定基因型得到大量阳性F1代小鼠(Vipr2+/-)。杂合子F1代小鼠(Vipr2+/-)雄雌交配后经PCR基因型鉴定获得Vipr2全身敲除小鼠(Vipr2-/-)与野生同窝仔(Vipr2+/+)小鼠。4周龄Vipr2-/-和Vipr2+/+小鼠(包括雌雄)由江苏集萃药康生物科技股份有限公司代养繁殖。基因型鉴定引物见表1。所有小鼠饲养在温州医科大学实验动物中心,保持室温25℃,维持12 h光照/12 h黑暗循环(上午8点开灯),光照明度约为300勒克斯(lx),可自由进食饮水。本研究所涉及的动物实验经温州医科大学动物伦理委员会批准。
1.2 Vip和Vipr2在小鼠眼球表达部位检测
VIPR2 需要在配体VIP激活下才发挥生物学作用,通过检测VIP和VIPR2在眼组织中的表达分布,明确VIP-VIPR2 信号轴在眼部可能发挥作用的部位。选取1 只4 周龄的野生型C57BL/6J雄性小鼠,颈椎脱臼处死后,分别取角膜、虹膜、晶状体、视网膜、脉络膜+视网膜色素上皮细胞及巩膜,利用Trizol或RNeasy Fibrous Tissue Mini Kit(美国QIAGEN公司)提取组织RNA,转录聚合酶链式反应(Reverse transcription-polymerase chain reaction,RT-PCR)合成cDNA后,以肌动蛋白β(Actb)作为内参基因,扩增Vip、Vipr2cDNA序列,检测Vip、Vipr2在眼组织是否表达。RT-PCR引物使用Primer Premier 5.0商业软件设计,上下游引物至少跨越一个内含子区域。序列及扩增产物片段大小见表2。
1.3 Vipr2敲除小鼠屈光度测量
Vipr2敲除小鼠(Vipr2-knockout,Vipr2-KO)小鼠和Vipr2野生型(Vipr2-wildtype,Vipr2-WT)小鼠在4周龄时,使用自行搭建的红外偏心摄影验光仪对屈光度进行测量,具体操作参考本课题组前期研究[3]。简述如下:小鼠在暗室未经麻醉状态下,实验操作者用一只手抓小鼠尾巴调整小鼠头部方位使其瞳孔中央定位在验光仪显示屏上,当显示屏上的浦肯野影像清晰,并位于瞳孔中央且屈光力相对稳定时,记录此时的屈光度,左右眼交替测量,每只眼睛测量3次,并取其平均值作为最终屈光度数据。
1.4 Vipr2-KO小鼠视网膜和玻璃体DA等神经递质检测
1.4.1 样本取材及预处理 小鼠在12 h/12 h昼夜循环(光照时间08:00—20:00)环境中饲养。文献报道小鼠由黑暗进入光照后的1 h,即授时因子时间(Zeitgeber time 1,ZT1)时视网膜DA合成和代谢利用水平最高[10],故选取上午9:00(ZT1)在微弱的红光下对视网膜取材。分别取24只4周龄的Vipr2-KO小鼠和24只Vipr2-WT小鼠行颈椎脱臼法分批处死,立即剜出右眼置于预冷的培养皿上,在解剖显微镜下使用1 ml无菌注射器迅速抽出玻璃体液注入预冷的EP管,用10 μl微量移液器测量抽取的玻璃体液体积,然后于30 s内迅速剥离视网膜,放入EP管用电子天平称重后立即转入液氮中,待同一批样本取完材后从液氮中取出样本转入-80℃冰箱保存。样 本检测DA等神经递质含量前,玻璃体液和视网膜分别加入15、100 μl的0.1 mol/L冰预冷的高氯酸,其中含10 μmol/L 抗坏血酸、0.1 mmol/L 乙二胺四乙酸二钠(Ethylenediaminetetraacetic cid disodinm salt,EDTA-Na2)、0.02 μmol/L 3,4-二羟基苯甲胺氢溴酸盐(3,4-dihydroxybenzylamine hydrobromide,DHBA),进行超声匀浆处理(玻璃体液不需匀浆处理),于4℃16000 g离心50 min,取上清液转入1.5 ml EP管,置于冰上立即检测。

表1.Vipr2敲除和野生型小鼠基因型鉴定引物序列Table 1.Primer sequences for genotyping of Vipr2-KO and Vipr2-WT mice
表2.RT-PCR扩增Vip和Vipr2引物序列Table 2.Primer sequences of Vip and Vipr2 for reverse transcription PCR
1.4.2 高效液相色谱法检测神经递质含量 利用安捷伦神经递质分析仪平台(Agilent 1200,美国安捷伦公司)通过高效液相色谱法(High performance liquid chromatography,HPLC)对DA等递质进行检测。参照文献[16]对视网膜和玻璃体液DA、3,4-二羟基苯乙酸(3,4-dihydroxyphenylacetate,DOPAC)、高香草酸(Homovanillic acid,HVA)、去甲肾上腺素(Norepinephrine,NE)以及各类氨基酸包括天冬氨酸(Aspartic acid,Asp)、谷氨酸(Glutamic acid,Glu)、丝氨酸(Serine,Ser)、谷氨酰胺(Glutamine,Gln)、甘氨酸(Glycine,Gly)、牛磺酸(Taurine,Tau)和γ氨基丁酸(γ-aminobutyric acid,GABA)等进行检测分析。操作步骤大致如下:使用流动速率为0.2 ml/min的流动相(0.05 mmol/L 乙二胺四乙酸(EDTA)、1.7 mmol/L 正硅酸(Orthosilicic acid)、90 mmol/L磷酸氢二钠(Na2HPO4)、50 mmol/L柠檬酸(Citric acid)和5%乙腈(Acetonitrile)对DA等进行检测,检测池电压设为+700 mV,温度保持为35℃。收集的数据通过ChemStation工作台(美国安捷伦公司)进行分析,同时使用外标法和内标法作标准曲线进行定量分析。
1.5 Vipr2-KO小鼠视网膜电生理检测
为明确Vipr2敲除影响视网膜电生理的早期时间点,分别选取6 只4 周龄的Vipr2-KO小鼠和6 只Vipr2-WT同窝仔小鼠进行视网膜电生理检测。检测前一晚小鼠放在暗房中过夜进行暗适应。检测仪器为改装后的小鼠专用电生理仪(ROLAND Ganzfeld Q450,德国罗兰公司),记录系统为RETI port 视网膜电图(Roland Consult,德国罗兰公司)。操作步骤如下:①散瞳:视网膜电生理记录前20 min对每只小鼠的右眼滴用复方托吡卡胺滴眼液(日本参天制药株式会社)充分散瞳;②麻醉:在微弱红光下用氯胺酮(90 mg/kg)+甲苯噻嗪(10 mg/kg)混合液按小鼠体质量(0.01 ml/g)行腹腔注射麻醉。小鼠麻醉后使其侧卧于立式支架的平台上,将其固定。测量室温维持在20~22℃,放置小鼠的支架平台给予水浴恒温加热,避免小鼠麻醉后因体温过低死亡;③安放电极:在小于5 lx红光下安置电极。右眼角膜表面安放自制螺旋状银-氯化银电极作为记录电极,电极尽量与角膜最大接触,避免产生尖端接触,电极固定后,角膜予以1%羧甲基纤维素钠(美国眼力健公司)点眼,以保持角膜湿润。不锈钢针状电极用作参考电极和接地电极,分别置于同侧面颊部和尾部皮下;④记录:再次暗适应1 min后,在不同刺激强度下(-3.699、-2.201、-0.699、0.301、0.799 log cd·s/m2)记录视网膜电图,包括暗适应视网膜a、b波振幅和潜时,然后记录振荡电位(Oscillatory potentials,OPs)。暗适应闪光视网膜电图记录完成之后,进行10 min的明适应,再记录明适应条件下不同刺激强度下(-0.699、-0.201、0.301、0.799、1.301 log cd·s/m2)视网膜a、b波振幅和潜时及OPs。
1.6 统计学方法
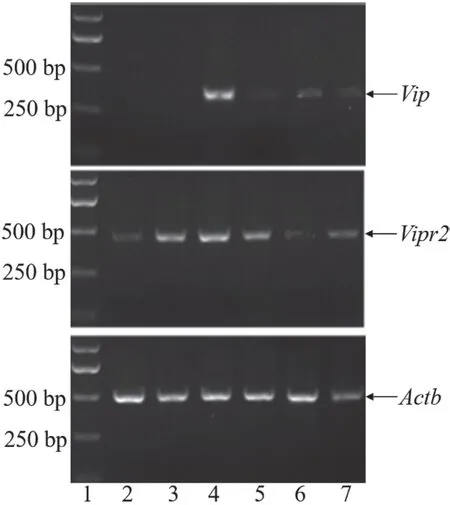
图1.眼球各组织中Vip和Vipr2的mRNA表达情况Vip和Vipr2基因的RT-PCR琼脂糖凝胶电泳图。扩增条带大小:Vip为343 bp;Vipr2为442 bp;Actb为487 bp。1,DNA分子量标准;2,晶状体;3,虹膜;4,视网膜;5,脉络膜和视网膜色素上皮细胞;6,角膜;7,巩膜Figure 1.Vip and Vipr2 mRNA expression in ocular tissue.The agarose gel electrophoresis of Vip and Vipr2 for RT-PCR.Lengths of RT-PCR amplification product:Vip:343 bp;Vipr2:442 bp;Actb:487 bp.1,DNA molecular weight marker;2,lens;3,iris;4,retina;5,choroid+retinal pigment epithelium;6,cornea;7,sclera.
实验研究。采用SPSS 22.0统计软件进行数据分析。所有数据进行正态性和方差齐性检验,符合正态分布,以表示。小鼠左右眼屈光度比较使用配对样本t检验,若差异无统计学意义,则以左右眼的平均值作为最终均值进行后继分析;Vipr2-KO和Vipr2-WT小鼠间的屈光度、DA及各类氨基酸比较采用独立样本t检验;不同明暗适应时,不同刺激强度下Vipr2-KO和Vipr2-WT小鼠间视网膜电生理数据比较采用双因素重复测量方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 Vip和Vipr2在眼组织中表达情况
逆转录PCR检测显示VipmRNA在小鼠视网膜中高表达,在脉络膜及视网膜色素上皮细胞、角膜和巩膜也有表达,在虹膜和晶状体未见表达(见图1);Vipr2mRNA在视网膜、虹膜、脉络膜+视网膜色素细胞中均高表达,而在晶状体、角膜和巩膜中低表达(见图1)。
2.2 Vipr2-KO小鼠表现为相对性近视
通过对Vipr2杂合子(Vipr2+/-)种鼠交配繁殖的后代小鼠进行基因型鉴定,成功鉴定并得到Vipr2敲除纯合子(Vipr2-/-)、杂合子(Vipr2+/-)及WT(Vipr2+/+)小鼠(见图2A)。对4周龄的Vipr2-KO和Vipr2-WT小鼠的屈光度进行检测发现,Vipr2-KO小鼠相比Vipr2-WT小鼠,屈光明显向近视漂移(t=2.51,P=0.017),见图2B。
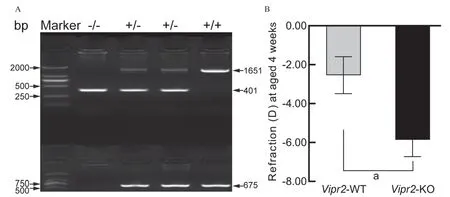
图2.Vipr2敲除纯合子、杂合子和野生型小鼠基因型鉴定图及4周龄时屈光状态A:基因型鉴定PCR扩增产物电泳图。-/-:纯合子;+/-:杂合子:+/+:野生型;B:Vipr2敲除(n=24)和野生型(n=24)小鼠4周龄的屈光状态。a,Vipr2敲除和野生型小鼠比较,P=0.017Figure 2.Genotyping of Vipr2 homozygote,heterozygote and wildtype mice.A:Electrophoresis of PCR amplification product for genotyping of Vipr2 knockout mice and wildtype counterparts.-/-,Homozygote;+/-,Heterozygote;+/+,Wildtype.B:The refractive status of Vipr2 knockout mice (n=24) and wildtype (n=24) counterparts at age 4 weeks.a,comparison between Vipr2 knockout and wildtype mice,P=0.017.
2.3 Vipr2-KO小鼠视网膜DA含量变化
4 周 龄Vipr2-KO小鼠与Vipr2-WT小鼠相比,视网膜DA 含量为(0.284±0.019)ng/mgvs.(0.191±0.020)ng/mg(以视网膜重量进行校正),Vipr2-KO小鼠视网膜DA含量明显增加(t=3.42,P=0.001,见图3A);而DOPAC含量为(0.082±0.008)ng/mgvs.(0.062±0.005)ng/mg,HVA含量为(0.050±0.004)ng/mgvs.(0.035±0.002)ng/mg,Vipr2-KO小鼠视网膜DOPAC、HVA含量明显高于Vipr2-WT小鼠(t=2.15,P=0.037;t=3.27,P=0.002,见图3A),但Vipr2-KO小鼠与Vipr2-WT小鼠间的DOPAC/DA 比值差异无统计学意义(t=1.97,P=0.058,见图3A)。视网膜中未检测出NE。
玻璃体液中,Vipr2-KO小鼠与Vipr2-WT小鼠DA含量分别为(0.015±0.001)ng/μl、(0.018±0.001)ng/μl;DOPAC含量分别为(0.030±0.002)ng/μl、(0.032±0.002)ng/μl;DOPAC/DA比值分别为2.274±0.166、2.092±0.152。2种小鼠间DA、DOPAC、DOPAC/DA、NE、HVA含量差异均无统计学意义(t=0.01~1.37,P>0.05,见图3B)。视网膜和玻璃体液中的氨基酸(Asp、Glu、Ser、Gln、Gly、Tau、GABA)含量在Vipr2-KO小鼠与Vipr2-WT小鼠之间差异均无统计学意义(t=0.21~6.45,P>0.05,见图3C-D)。

图3.Vipr2-KO和Vipr2-WT小鼠视网膜和玻璃体液DA、DOPAC及各氨基酸含量比较A:视网膜中DOPAC、DA、HVA含量和DOPAC/DA比值;B:玻璃体液中DOPAC、DA、NE、HVA含量和 DOPAC/DA比值;C、D:分别为视网膜、玻璃体液中Asp、Glu、Ser、Gln、Gly、Tau和GABA含量比较。Vipr2-KO小鼠和Vipr2-WT小鼠各24只。DOPAC,3,4-二羟基苯乙酸;DA,多巴胺;HVA,高香草酸;NE,去甲肾上腺素;Asp,天冬氨酸;Glu,谷氨酸;Ser,丝氨酸;Gln,谷氨酰胺;Gly,甘氨酸;Tau,牛磺酸;GABA,γ氨基丁酸。a,Vipr2-KO小鼠与Vipr2-WT小鼠DOPAC比较,P=0.037;b,Vipr2-KO小鼠与Vipr2-WT小鼠DA比较,P=0.0013;c,Vipr2-KO小鼠与Vipr2-WT小鼠HVA比较,P=0.002Figure 3.DA,DOPAC,and amino acid contents in the retina and vitreous body for Vipr2 knockout (Vipr2-KO) and Vipr2 wildtype (Vipr2-WT) mice at age 4 weeks.A:DOPAC,DA,and HVA contents and DOPAC/DA ratio in the retina in Vipr2-KO and Vipr2-WT mice.B:DOPAC,DA,NE,and HVA contents,and DOPAC/DA ratio in the vitreous body.C-D:Asp,Glu,Ser,Gln,Gly,Tau,and GABA contents in the retina and vitreous body.Vipr2-KO (n=24) and Vipr2-WT (n=24).DOPAC,3,4-dihydroxyphenylacetate;DA,dopamine;HVA,homovanillic acid;NE,norepinephrine;Asp,aspartic acid;Glu,glutamic acid;Ser,serine;Gln,glutamine;Gly,glycine;Tau,taurine;GABA,γ-aminobutyric acid.a,comparison of DOPAC content between Vipr2-KO and Vipr2-WT mice,P=0.037;b,comparison of DA content between Vipr2-KO and Vipr2-WT mice,P=0.0013;c,comparison of HVA content between Vipr2-KO and Vipr2-WT mice,P=0.002.
2.4 Vipr2-KO小鼠视网膜电生理检测结果
暗适应条件下,4周龄Vipr2-KO小鼠b波振幅与Vipr2-WT小鼠相比,明显增加(F=8.65,P=0.015),而a波差异无统计学意义(F=0.23,P=0.639);明适应条件下,Vipr2敲除小鼠a、b波与野生型小鼠相比,振幅差异无统计学意义(F=3.99,P=0.081;F=4.75,P=0.054)。暗适应条件下2 种小鼠间OPs振幅(F=2.00,P=0.187)及a、b波潜时差异均无统计学意义(F=0.01,P=0.918;F=2.48,P=0.146)。见图4。
3 讨论
RNA原位杂交实验发现在小鼠胚胎16d(E16)即可见VIPR2 在视神经母细胞层表达[17],出生后6~7 d时全视网膜均有表达,且在内核层和神经节细胞层高表达,说明VIPR2 在视网膜早期发育中就发挥作用。免疫荧光及免疫组织化学检测发现VIPR2 主要在鸡[4,18]视网膜(光感受器外节、内丛状层)和脉络膜上表达。本研究通过RT-PCR进一步明确了VIPR2在成年小鼠视网膜、虹膜、脉络膜+视网膜色素细胞、晶状体、角膜和巩膜中均有表达,提示这些组织部位均可能为VIPR2的作用靶点。
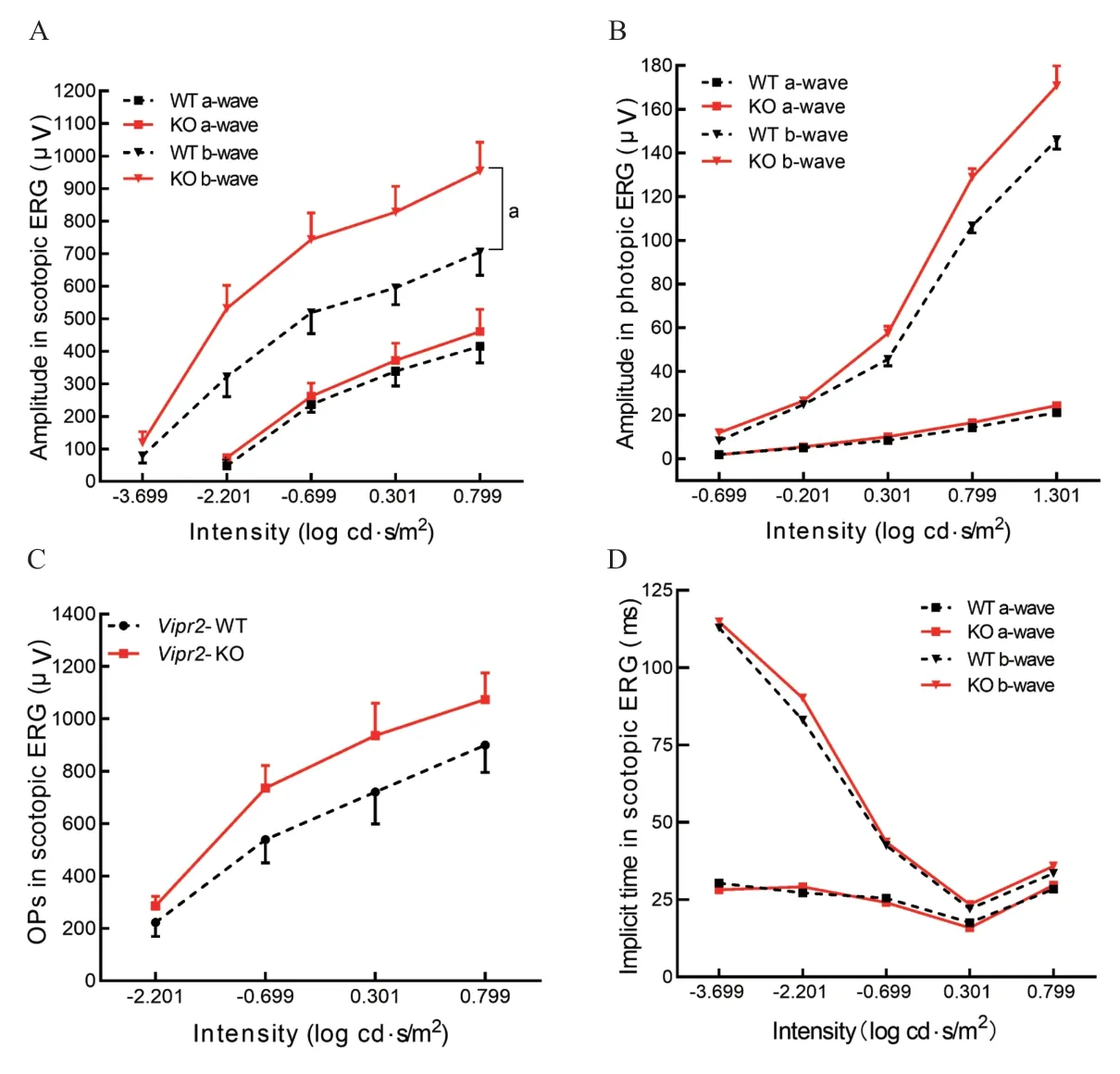
图4.明暗适应条件下Vipr2-KO和Vipr2-WT同窝仔小鼠在不同强度光刺激时a、b波和振荡电位的变化A:暗适应时Vipr2-KO和Vipr2-WT小鼠a、b波的波幅;B:明适应时Vipr2-KO和Vipr2-WT小鼠a、b波的波幅;C:暗适应时Vipr2-KO和Vipr2-WT小鼠振荡电位;D:暗适应时Vipr2-KO和Vipr2-WT小鼠a、b波潜时。Vipr2-KO小鼠和Vipr2-WT小鼠各6只。a,Vipr2-KO和Vipr2-WT小鼠b波比较,P=0.015Figure 4.The amplitude of a and b waves,and oscillation potential (OPs) in scotopic and photopic adaptation for Vipr2 knockout (Vipr2-KO) and Vipr2 wildtype (Vipr2-WT) mice at age 4 weeks.A:The amplitudes of a and b waves in scotopic adaptation.B:Amplitudes of a and b waves in photopic adaptation.C:Amplitude of oscillation potential in scotopic adaptation.D:Implicit time of a and b waves in scotopic adaptation.Vipr2-KO mice (n=6) and Vipr2-WT mice (n=6) were used.a,comparison of amplitude of the b wave between Vipr2-KO and Vipr2-WT mice,P=0.015.ERG,electroretinogram.
正常生理状态下,机体受各种生理节律的调控。神经中枢具有整体调控的节律时钟,而各器官和组织也有自身内在的节律调控机制。如视网膜有内在的节律调控时钟基因表达,如褪黑素受体(MTNR1A、MTNR1B)、黑视蛋白(OPN4)、周期基因(PER1、PER2)、VIP及受体VIPR1、VIPR2等,这些节律基因可以调控视网膜节律并影响视网膜生理功能。文献报道光照昼夜节律紊乱与近视有关[19];Zhou等[20]改变小鼠光照/黑暗节律,2周后发现18 h光照/6 h黑暗节律循环明显使小鼠屈光向近视方向漂移,因此他们认为光/暗循环变化可能改变节律基因表达而影响小鼠正常屈光发育。目前大量文献已证实VIPR2可调控机体的生理节律[15,21-22],VIPR2 已明确影响到正常屈光发育[3]。视网膜DA含量受昼夜等生理节律调控并已明确其参与屈光发育。本研究对Vipr2敲除小鼠视网膜和玻璃体液中的DA等神经递质进行了检测,只发现视网膜中的DA、DOPAC、HVA含量明显升高而玻璃体液中无变化。由于DA在细胞内合成后分泌到细胞外才能发挥生理作用,视网膜DA反映其胞内非活性总水平及合成能力,而分泌到细胞外(玻璃体)中的DA反映其发挥生物学活性作用的部分,玻璃体DA含量高低反映了视网膜DA的分泌能力。DOPAC、HVA则为DA主要代谢产物,反映DA代谢利用能力。本研究结果说明Vipr2敲除可影响到视网膜(胞内)DA的合成与代谢,但未影响到视网膜DA分泌功能(胞外玻璃体液中DA水平未变化)。文献报道近视状态下视网膜DA含量明显降低[11,23],但也有研究发现近视后DA含量并没有变化[16,24]或者增加[25]。本研究发现Vipr2敲除导致小鼠表现为相对近视,DA含量升高,Vipr2敲除如何导致DA升高的具体机制目前并不清楚,还有待进一步阐明。Luo等[25]对豚鼠利用闪烁光诱导近视,发现视网膜及玻璃体液中DA含量升高,但形觉剥夺近视豚鼠的DA却降低,提示不同的诱导条件可能触发的近视信号通路及机制可能不同,导致DA变化不一致。DA通过与DA受体结合发挥生理作用,DA激活不同的DA受体发挥的生理学并不相同,如多巴胺受体DRD1与DRD2在近视中发挥相反作用[12],这些研究结果表明DA及受体在屈光发育及近视形成中的调控机制十分复杂,VIPR2是如何影响DA并参与近视的作用机制需进一步研究来明确。
本课题组前期研究发现C57BL/6J小鼠形觉剥夺1、2 d后VIP mRNA表达明显下降,而形觉剥夺1、2、4周后却没有差异[3],提示VIP-VIPR2信号轴在近视早期发挥作用。近视过程中视网膜电生理会发生异常变化,视网膜光感受器异常会引起电生理a波变化,而双极细胞功能受损则影响b波。本课题组前期已对7 周龄Vipr2-KO小鼠视网膜电生理进行检测,发现在暗适应时a波和b波振幅较野生型对照明显升高[3]。为明确Vipr2是否在更早时间点就已经影响视网膜功能,本研究选取了4周龄Vipr2-KO小鼠进行视网膜电生理检测,同样也发现暗适应时b波振幅升高,提示Vipr2在小鼠发育早期(4周龄)已影响视网膜功能。文献报道Drd1、Drd2、Aplp2敲除影响屈光发育产生近视或远视表型[26-27],同时Drd2-KO小鼠伴随着a、b波波幅明显升高,而Drd1-KO和Aplp2-KO小鼠b波的波幅明显下降,提示不同的基因功能丧失可产生不同的视网膜电生理a、b波变化;双极细胞ON(Nyx-/-)[28]和OFF通路(Vsx1-/-)[24]失活也影响小鼠屈光发育并伴随b波明显下降或消失。这也提示双极细胞引起的电生理异常影响正常屈光发育。本课题组前期通过单细胞转录组测序,发现Vipr2主要表达在视网膜双极细胞[3],小鼠形觉剥夺眼视网膜中Vipr2+双极细胞功能明显受到抑制,使cAMP信号通道明显下调,这些均提示VIPR2主要通过调控视网膜双极细胞而发挥作用,如本研究中引起视网膜电生理b波变化。
综上,本研究发现Vipr2-KO小鼠在4周龄时呈近视表型,能引起视网膜DA含量增加,并伴随视网膜电生理功能异常。由此推测VIPR2可影响视网膜DA合成与代谢但并不是直接通过调控DA导致近视,有可能是通过影响视网膜双极细胞电生理功能参与近视形成,但具体作用机制还有待进一步研究。
利益冲突申明 本研究无任何利益冲突
作者贡献声明 赵福新:收集数据;参与选题、设计及资料的分析和解释;撰写论文;修改论文中关键性结果、结论;根据编辑部的修改意见进行核修。汪琪、王莉、阳凡、郑阳洋、赵晨琛、朱禾:收集数据;参与选题、设计及资料分析。周翔天、瞿佳:参与课题思路设计,修改论文中关键性结果、结论,根据编辑部的修改意见进行核修

