基础有机化学中几类经典有机反应的改进创新
黄鹏,葛春华,冯大明,林觅
辽宁大学化学院,沈阳 110036
有机化学是高等院校化学化工、生命科学、环境科学、药学等相关专业重要的基础必修课,也是研究最为活跃的化学学科。在过去的几十年里,有机化学新理论、有机合成新方法不断涌现,新的有机反应也层出不穷。很多经典的有机反应也得到了极大的改进,却未及时体现在基础有机化学教材中。这对基础有机化学的教学也提出了更高的要求,即在教学中既要注重基础知识的传授,也要适当关注学科发展的前沿成果。另一方面,有机化学课程是开展思政教育的重要阵地[1],然而基础有机化学教材的主要内容却是建立在近代西方有机化学学科的发展与重大成就基础上的[2],在众多的西方历史名人及其成果面前,仅靠我国的历史典籍和几位科学家的历史事迹激发学生爱国热情显然是不够的,还需要适当展示近年来国内学者取得的一些创新成果[3]。
本文介绍了几类经典有机反应的改进创新。这些反应与基础有机化学紧密相关,新颖、易懂且具有启发性,可作为教材内容的延伸与拓展用于基础有机化学相关章节的教学中,不仅可开拓学生的视野,也有助于培养他们发现问题、分析问题和解决问题的能力。更重要的是,其中一些具有重要意义的改进是由国内科研团队完成的,体现了我国学者在有机化学学科发展中所做出的重要贡献,对于培养学生的爱国主义情怀、民族自豪感和文化自信也具有积极作用。
1 Brønsted酸催化的炔烃水合反应
炔烃的水合反应是合成乙醛以及酮类化合物的常用反应之一。在基础有机化学教材中,这一反应通常是在硫酸水溶液中用硫酸汞催化进行,被称为Kucherov反应。该反应的机理涉及汞对炔碳叁键的配位活化,对于初学有机化学的学生而言是一大难点[4]。此外,由于反应条件不符合绿色、环保的要求,Kucherov反应在基础研究和工业生产中已不具备实用价值,导致学生也缺乏学习的动力。因此,有必要在教学过程中对炔烃水合反应条件的改进研究进行简介,从而激起学生的学习兴趣。
事实上,与烯烃的水合反应类似,炔烃的水合反应也可仅在浓硫酸的作用下进行[5],其反应机理为典型的亲电加成:碳碳叁键上的碳原子首先与质子加成形成烯基碳正离子中间体,然后与水结合生成氧鎓盐,进而脱质子并经烯醇-酮式互变异构得到产物酮。然而,该反应的效果差且需要大大过量的硫酸(用量至少是炔烃的1500倍)。2000年,Eiji Shirakawa等人[6]采用三氟甲磺酸(TfOH) (注意:三氟甲磺酸是一种液体有机超强酸,其酸性超过100%的硫酸,具有强腐蚀性和吸水性,在空气中发烟,取用时要做好安全防护)或双(三氟甲磺酰)亚胺(Tf2NH)代替浓硫酸,首次实现了Brønsted酸催化的炔烃水合反应。该反应需要在1,4-二氧六环中回流进行,TfOH或Tf2NH的用量为炔烃的0.1-0.2倍。2016年,Chao-Jun Li等人[7]采用三氟乙醇作溶剂,进一步将TfOH催化的炔烃水合反应温度降至室温,如图1所示。三氟乙醇[8]是一类具有强氢键给予能力、强致电离能力、弱酸性和弱亲核性的独特有机溶剂。它能通过稳定烯基碳正离子中间体而降低质子与碳碳叁键上的碳原子加成的活化能,同时,其氧原子的Lewis碱性和亲核性都很弱,几乎不与质子及烯基碳正离子反应。因此,在三氟乙醇溶剂中,多种脂肪炔烃、芳香炔烃、端炔烃和内炔烃等都能在TfOH的催化下发生水合反应,不仅反应条件温和,而且反应的选择性和产率都很好。

图1 三氟甲烷磺酸(TfOH)催化的炔烃水合反应及代表性产物
显然,与Kucherov反应相比,上述Brønsted酸催化的炔烃水合反应过程更加绿色环保,反应机理也更简单易懂。在基础有机化学教学中简单介绍炔烃水合反应的上述发展过程,既可以达到在化学教育中融入绿色化学理念的目的,也有助于学生更好地理解与掌握炔烃的亲电加成反应。
2 无氨Birch还原反应
Birch还原是利用溶剂化电子将芳香化合物还原为1,4-环己二烯类化合物的反应,被誉为芳香族化合物与脂环族化合物之间的桥梁,在工业生产及科学研究中具有广泛的用途。经典的Birch还原反应采用金属钠与液氨作用产生溶剂化电子,操作繁琐且危险[9]。因此,自1944年该反应被报道以来,全球众多科研团队对其进行了改进研究。然而,大多数的改进方法仍然需要使用液氨或有机胺化合物。
2018年,中国农业大学的安杰等人[10]报道了首个具有广泛适用性的无氨Birch还原反应。他们发现钠分散体可在室温下与冠醚15-冠-5快速反应形成稳定的电子盐,该电子盐在冰水浴的条件下即可高效还原多种(杂环)芳香化合物,如图2所示。

图2 无氨Birch还原反应及代表性产物
钠分散体[11]是细微分散的钠微粒在惰性溶剂(如甲苯、二甲苯、汽油等)中的稳定悬浮体。相比于钠片或钠块,钠分散体在空气中不易自燃,可用注射器或移液管量取,并且由于比表面积大而具有更高的反应活性。使用钠分散体和冠醚代替经典的Birch还原条件,不仅操作安全便捷,还具有适用范围广、化学/区域选择性好、冠醚可回收使用等反应优势。
值得一提的是,上述工作是由安杰教授指导的本科学生主要完成的[12]。他们不仅为Birch还原反应开发了一种新方法,还发现了冠醚的新用途。众所周知,冠醚对碱金属阳离子具有很强的配位能力,因此常被用作有机合成反应中的相转移催化剂,而安杰等人却利用冠醚的强配位能力与钠单质反应制备还原性的电子盐。他们对冠醚性质的创造性理解和使用无疑可带给学生更多的思考与激励。
3 碘仿反应合成酰胺
1870年,Adolf Lieben[13]在研究碱性条件下单质碘与多种羰基化合物的反应过程中,发现甲基酮类化合物在碘的碱性水溶液中会转化为少一个甲基的羧酸盐,同时生成黄色的碘仿沉淀。此后,该反应被称为碘仿反应,成为鉴别甲基酮类化合物或能被碘氧化成甲基酮的化合物的一种常用方法,也是从甲基酮制备少一个碳的羧酸化合物的一种重要方法[4]。
2009年,华中师范大学吴安心等人[14]报道了碘仿反应的新用途。他们发现碘仿反应也可在氨水体系中进行,但所得产物为酰胺,而非通常的羧酸,如图3所示。该反应具有广泛的适用性,可将多种取代的(杂环)芳基、烯基、炔基甲基酮或α-甲基醇类化合物转化为相应的酰胺。作者提出,氨水本身具有的碱性促使甲基酮发生α-碘代反应,重复三次,得到三碘甲基酮中间体A。由于氨水溶液中氨分子的亲核性比水强,三碘甲基酮难以通过水解反应转化为羧酸盐,而在氨分子的进攻下发生加成-消除反应,转化为酰胺和碘仿。

图3 碘仿反应合成酰胺、代表性产物及反应机理
吴安心等人的上述研究不仅为酰胺类化合物的合成提供了一种简便且有效的方法,更重要的是,它打破了人们对碘仿反应的思维定势,使人们意识到,通过加入其他的亲核试剂,碘仿反应还可以用于羧酸衍生物的合成,由此也启发和促进了人们对碘仿反应的应用研究。这样的突破与创新对于基础有机化学而言也是有教育意义的。
4 基于自活化循环的Beckmann重排反应
Beckmann重排反应是酮肟类化合物的特征反应,在科学研究和工业生产中占有重要的地位。目前主流的基础有机化学教材在介绍Beckmann重排反应时,都指出酮肟需要在过量的强酸(如硫酸、多聚磷酸)以及酰氯(如五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯)作用下才能有效地重排为酰胺[4],经典的反应机理如图4所示。
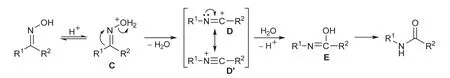
图4 经典的Beckmann重排反应机理
事实上,自1886年Beckmann重排反应被首次报道以来,人们一直在寻找温和的反应体系、简便的操作方法以便提高酰胺产物的收率,同时降低污染。近年来,该领域的研究取得了突破性的进展,科研人员不仅在实验中发现了多种Lewis酸、酸酐、膦酰氯、磺酰氯等可高效催化Beckmann重排反应,而且在理论上对Beckmann重排反应过程也有了新的认识[15]。
2013年,华东理工大学的邓卫平等人[16]对催化量的对甲基苯磺酰氯(TsCl)促进的Beckmann重排反应进行了实验和理论研究,提出了基于自活化循环(self-propagating cycle)的Beckmann重排反应机理,如图5所示:少量的酮肟首先与催化量的对甲基苯磺酰氯发生酯化反应,随后酯化产物F脱掉对甲基苯磺酸并重排成为腈阳离子D’;D’受到另一分子酮肟羟基氧原子的进攻,转化为氧鎓盐中间体G;G迅速分解释放出一分子酰胺的同时重排成另一个腈阳离子中间体D’并参与到下一次循环中。

图5 基于自我活化循环的Beckmann重排反应机理
随后,邓卫平等人[17]通过进一步研究发现,与对甲基苯磺酰氯催化的反应类似,在三聚氯氰(CNC)、六氯三聚磷腈(TAPC)、双(2-氧代-3-噁唑烷基)次磷酰氯(BOP-Cl)、3,3-二氯-1,2-二苯基环丙烯(CPI-Cl)等有机物催化的Beckmann重排反应中,自活化循环的机理比文献报道的Meisenheimer络合物中间体机理在能量变化上更为有利。鉴于此,他们认为上述有机氯化物实质上是Beckmann重排反应的引发剂,而非催化剂,并且自活化循环反应机理可能适用于所有有机试剂引发的Beckmann重排反应。
邓卫平等人的上述研究厘清了人们对Beckmann重排反应中“催化剂”的作用及反应机理的认识,也为Beckmann重排反应“催化剂”的设计与筛选提供了重要的理论指导。对于学习基础有机化学的学生而言,在掌握经典的Beckmann重排反应的基础上,进一步探讨基于自活化循环的Beckmann重排反应,不仅能培养他们对有机反应的思考与分析能力,也有助于他们了解有机小分子催化这一绿色化学的重要发展方向。
5 芳基重氮盐的双分子脱氮偶联反应
1884年,德国化学家Traugott Sandmeyer[18]希望通过苯胺的重氮盐(PhN≡NCl)与乙炔铜的反应合成苯乙炔,然而,实验表明,该反应的主要产物是氯苯,没有预期的苯乙炔生成。仔细研究反应条件后,Sandmeyer发现,反应体系中产生的CuCl催化了重氮基团被氯取代的反应。在Sandmeyer反应发现后不久,研究人员便注意到不同的加料顺序会得到不同的反应结果:当在10 °C以下向稀释的CuCl水溶液中加入PhN≡NCl时,反应的主要产物是氯苯;而改变加料顺序,则会导致该反应在生成氯苯的同时伴随着大量的联苯和苯酚副产物。后续的研究发现,在芳基重氮盐的某些其他反应中也会有联芳烃副产物生成。这一现象激起了科研人员的兴趣。一方面,科研人员从反应机理的角度分析联芳烃的形成原因,并逐渐认识到,联芳烃是通过芳基自由基的偶联形成的;另一方面,研究人员也希望能够从芳基重氮盐专一地合成联芳烃,尽管发现了一些方法,但大都因为反应适用范围窄、产物产率低、副反应多等缺点而未受重视[19]。
2012年,浙江工业大学的宋庆宝和绍兴文理学院的齐陈泽等人[20]发现,采用当量的氯化亚铁作为促进剂,可实现芳基重氮四氟硼酸盐的双分子脱氮偶联,如图6所示。该反应操作简便、反应条件温和、副反应少。各种吸电子/给电子基团取代的芳基重氮四氟硼酸盐以及杂环芳基重氮四氟硼酸盐都能以中等到优良的产率平稳地转化为相应的联芳烃类产物。
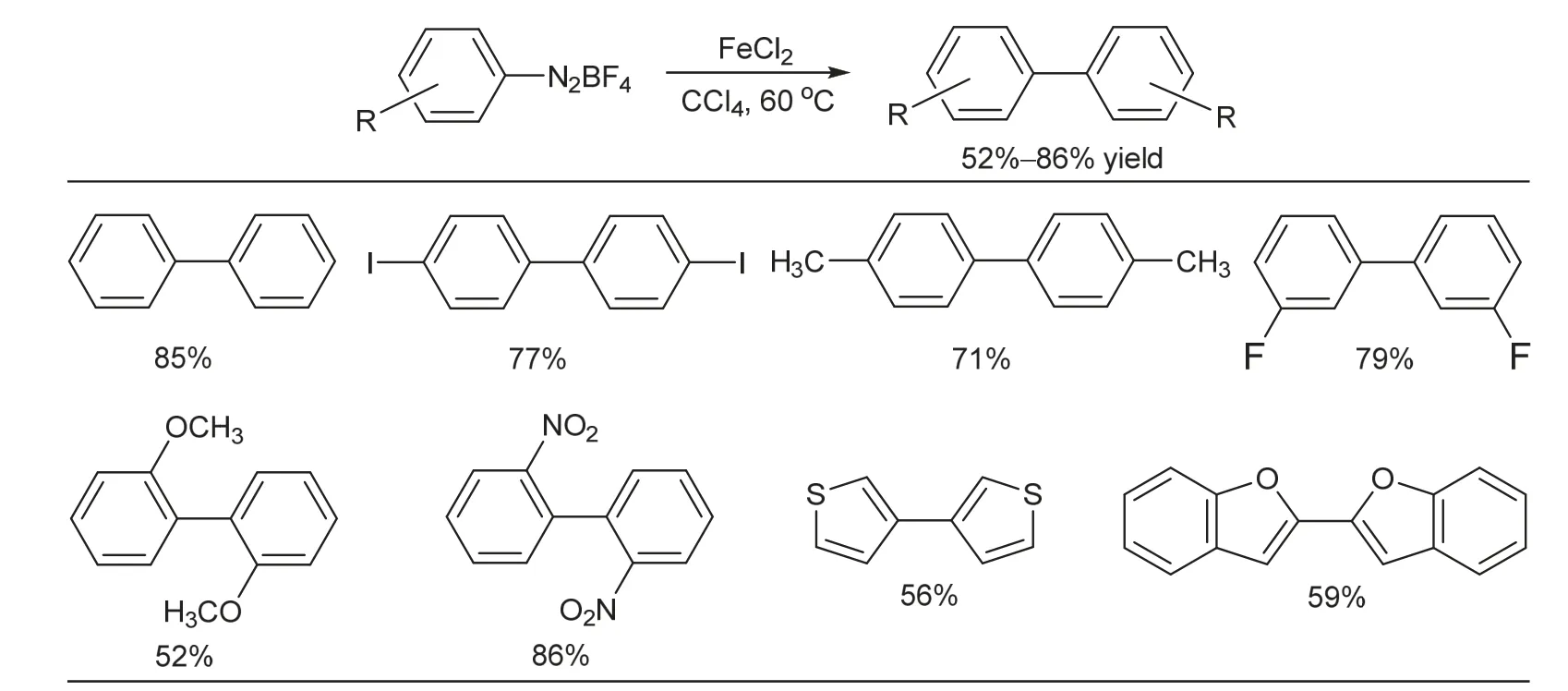
图6 FeCl2促进的芳基重氮盐双分子脱氮偶联反应及代表性产物
上述反应是通过单电子转移的方式进行的[20],如图7所示。苯基重氮四氟硼酸盐被亚铁离子还原,发生碳氮键断裂,释放氮气的同时形成苯基自由基。两个苯基自由基结合形成联苯产物。

图7 芳基重氮盐双分子脱氮偶联反应机理
宋庆宝和齐陈泽等人的上述研究成果,克服了传统的芳基重氮盐双分子脱氮偶联反应的缺点,使这类反应重新在对称的联芳烃类化合物的合成中焕发出了生机。尽管目前的基础有机化学教材中还没有这方面的内容,但考虑到该反应与Sandmeyer反应之间的历史联系,以及联芳烃在基础研究、化学合成和化学工业中的广泛应用,上述反应可作为基础有机化学中重氮盐相关内容的一个有益补充,供学生了解。
6 结语
随着有机化学的蓬勃发展,教学内容的更新与拓展越来越受到教学双方的重视。本文简单介绍了近年来基础有机化学中几类经典有机反应的改进创新情况,包括它们的研究背景、新反应的特点及意义等。作为经典有机反应持续发展的新成果,将这些新反应引入有机化学相关章节的教学中,能够开拓学生的眼界与思维,激发他们对有机化学的学习兴趣,进而提升教学效果。同时,学生深切感受到我国科学家在基础有机化学学科发展中所做出的突出贡献以后,还能激起他们的爱国热情,增强民族自豪感,深化文化自信。笔者期待后续能有更多的与基础有机化学紧密相关的、尤其是国内学者取得的创新成果被发掘并引入到基础有机化学的教学和教材中。

