川芎嗪对脂肪干细胞体外增殖及小鼠颗粒脂肪移植存活的影响
周景和 徐慧芳 祝飞 贾明 李金晟
脂肪干细胞(adipose-derived stem cells,ADSC)有较强的增殖能力,且可以分化为多种不同的细胞系,如脂肪细胞、内皮细胞、成骨细胞及软骨细胞等。利用ADSC分化的不确定性,临床可在美容、整形及不同的软组织缺损疾病中应用颗粒脂肪移植方法[1]。然而单纯颗粒脂肪移植成活率并不理想。已有研究通过尝试不同移植物注射方式,或应用不同添加成分来提高脂肪移植成活率[2-3]。川芎是一种药用植物,其主要活性物质为生物碱类化合物川芎嗪,具有保护心脑血管系统、溶栓抗凝、抗氧化、改善微循环等多种药理作用。临床上川芎嗪主要被用于治疗心脑血管、肾脏、消化系统等的有关疾病[4]。基于此,本研究探讨川芎嗪对ADSC体外增殖的影响,及川芎嗪不同添加方式对颗粒脂肪移植成活的影响,现报道如下。
1 材料和方法
1.1 主要材料 6~8周龄,体重约20 g的BALB/c裸鼠12只(上海斯莱克实验动物有限公司),ADSC(中科院上海细胞库)。主要试剂:过氧化物酶体增殖物激活受 体 γ(peroxisome proliferator-activated receptor-γ,PPAR-γ)和CCAAT增强结合蛋白α(CCAAT enhancer binding protein-α,C/EBP-α)引物由上海生工生物工程有限公司合成;MEM培养基(美国Gibco公司)、川芎嗪(无锡市第七制药有限公司,批号:310701)、CCK-8试剂盒(上海碧云天生物技术有限公司)、HE染液(珠海贝索生物技术有限公司)、油红O染色液(武汉谷歌生物科技有限公司)、OCT包埋剂(美国Tissue-Tek公司)、水性封片剂(美国Vector Laboratories公司)、5x primeScript RT Master MIX(日本TAKARA公司)、Power SYBR Green PCR Master(美国Thermo公司)。主要仪器:酶标仪(瑞士TECAN公司,Infinite M100 PRO型)、荧光定量PCR仪(美国ABI公司,ViiA7型)、透射电子显微镜(日本Joel公司,JEM-1230型)、普通光学显微镜(日本Olympus公司,CKX 31型)、倒置荧光显微镜(意大利Optika公司,XDS-3FL4型)。脂肪组织为行腹部或大腿脂肪抽脂术的患者术后组织标本(经患者知情同意)。
1.2 方法
1.2.1 ADSC培养 ADSC培养于含有10%FBS、1%双抗体的MEM培养基中,在37℃、5% CO2培养箱中培养过夜。
1.2.2 ADSC分组及增殖能力检测 因透明质酸(hyaluronic acid,HA)具有良好的生物相容性和几乎无免疫原性,故使用HA作为移植ADSC的支架材料。将ADSC分组干预,分别为ADSC组、ADSC-HA组(0.2 ml ADSC+0.2 ml HA)、ADSC-HA+川芎嗪组(0.2 ml ADSC+0.2 ml HA+0.1 mg/ml川芎嗪)。将100 μl细胞悬液以5×103细胞/孔的密度接种于96孔板中,37℃、5% CO2条件下预培养24 h。将培养板在培养箱孵育,分别于第1、3、5、7天,添加CCK-8溶液(10 μl/孔,加入时防止产生气泡),孵育1.5 h后,于酶标仪上测定450 nm处的光密度(OD值),绘制细胞增殖曲线。
1.2.3 裸鼠皮下颗粒脂肪移植 用0.9%氯化钠溶液清洗脂肪组织,清除细胞碎片及血细胞后,将其转置到5 ml空注射器,加入0.9%氯化钠注射液后静置,使其分层,分层后上、中、下层分别为油脂、颗粒脂肪及冲洗液。随后排出下层的冲洗液,冲洗(3~4次)后使用纱布过滤排除冲洗液和油脂,得到纯化后的颗粒脂肪。将裸鼠按随机数字表法分为4组,颗粒脂肪-HA+PBS组(200 μl PBS+颗粒脂肪+200 μl HA)、颗粒脂肪-HA+川芎嗪注射组(200 μl PBS+颗粒脂肪+200 μl HA+术后川芎嗪注射)、颗粒脂肪-HA+川芎嗪浸泡组(200 μl 100 mg/L的川芎嗪+颗粒脂肪+200 μl HA)、颗粒脂肪-HA+川芎嗪注射+浸泡组(200 μl 100 mg/L的川芎嗪+颗粒脂肪+200 μl HA+术后川芎嗪注射),各3只。使用1 ml注射器将各组混合物注射到裸鼠左右背部皮下,每点注射0.4 ml。术后川芎嗪注射是在皮下注射颗粒脂肪后,以2 mg/d的剂量注射川芎嗪,持续注射7 d。术后8周处死裸鼠解剖刮取出移植组织。
1.2.4 各组裸鼠颗粒脂肪移植组织冷冻切片制备 使用4%多聚甲醛固定组织,固定24 h后转置15%的蔗糖溶液中,1 h后将组织样本转移到30%的蔗糖溶液中过夜。滤纸吸除多余的蔗糖溶液后,用OCT包埋,于4℃冰箱平衡30 min,使气泡逸出,然后置于-80℃冰箱冷冻1h以上。冷冻组织于-18℃连续切片,厚度8μm。
1.2.5 各组裸鼠颗粒脂肪移植组织HE染色观察 冷冻切片在37℃复温30 min,苏木精液染色30 s,使用流水反复冲洗之后加入1%的盐酸溶液用于分色,冲洗后于伊红液染色中染色60 s。将切片分别依次置于95%乙醇(30 s),95%乙醇(1 min),1∶1的二甲苯:无水乙醇混合液(3 min),二甲苯Ⅰ(5 min),二甲苯Ⅱ(5 min)对样本脱水、透化处理。最后使用中性胶封闭切片,在光学显微镜下观察。
1.2.6 各组裸鼠颗粒脂肪移植组织油红O染色观察冷冻切片在37℃复温30 min,加入75%乙醇孵育10 s后避光情况下于油红O染液中染色12 min。之后,将样本置于75%乙醇分化,待背景至无色之后使用蒸馏水清洗漂洗2 min,然后于苏木精中复染30 s。洗涤后,将其置于1%盐酸溶液中分化3 s,反复冲洗后使用水性封片剂进行封片处理,在倒置显微镜下观察。
1.2.7 各组裸鼠颗粒脂肪移植组织脂肪形成相关的转录因子PPAR-γ、C/EBP-α mRNA表达水平检测 采用荧光定量PCR法。用Trizol试剂提取组织总RNA后,于酶标仪检测RNA浓度和质量。使用5x prime-Script RT Master MIX先合成第一链cDNA,之后以Power SYBR Green PCR Master进行实时PCR扩增,热循环条件为50℃ 3 min,95℃ 3 min,95℃ 10 s,60℃30 s进行40个循环;溶解曲线分析(60~95℃,每10 s增加0.5℃),引物序列见表1。

表1 引物序列
1.2.8 各组裸鼠颗粒脂肪移植组织HA残留情况检测 各组移植组织PBS洗涤后,于4℃下加入1%锇酸溶液固定样本,固定2 h后使用PBS清洗,之后依次在50%、70%、80%、90%乙醇梯度中对样本进行脱水处理(各梯度静置15 min),之后置于70%的乙醇中过夜。使用100%乙醇对样本再次进行脱水处理(20 min/次)。使用丙酮进行2次置换(15 min/次),然后依次于2∶1、1∶1和1∶2体积比的丙酮∶包埋剂混合物中分别浸渍1、4及4 h。之后使用纯包埋剂再次进行2次浸渍处理(每次18 h以上)。然后对包埋的样本65℃条件下聚合,持续48 h。包埋样本修成表面积<0.2 mm×0.2 mm的梯形,以70 nm的厚度制备超薄切片。依次于醋酸铀酰和醋酸铅中分别染色10 min,冲洗后,于透射电子显微镜下观察组织HA残留情况。
1.3 统计学处理 采用SPSS 22.0统计软件。计量资料以表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组ADSC增殖能力检测 培养至第1、3、5天时,ADSC组、ADSC-HA组、ADSC-HA+川芎嗪组增殖能力比较差异均无统计学意义(均P>0.05),第7天时,ADSC-HA+川芎嗪组增殖能力较ADSC组、ADSCHA组增强(均P<0.05),而ADSC组、ADSC-HA组增殖能力比较差异无统计学意义(P>0.05),表明川芎嗪可促进ADSC体外增殖。各组ADSC增殖曲线见图1。
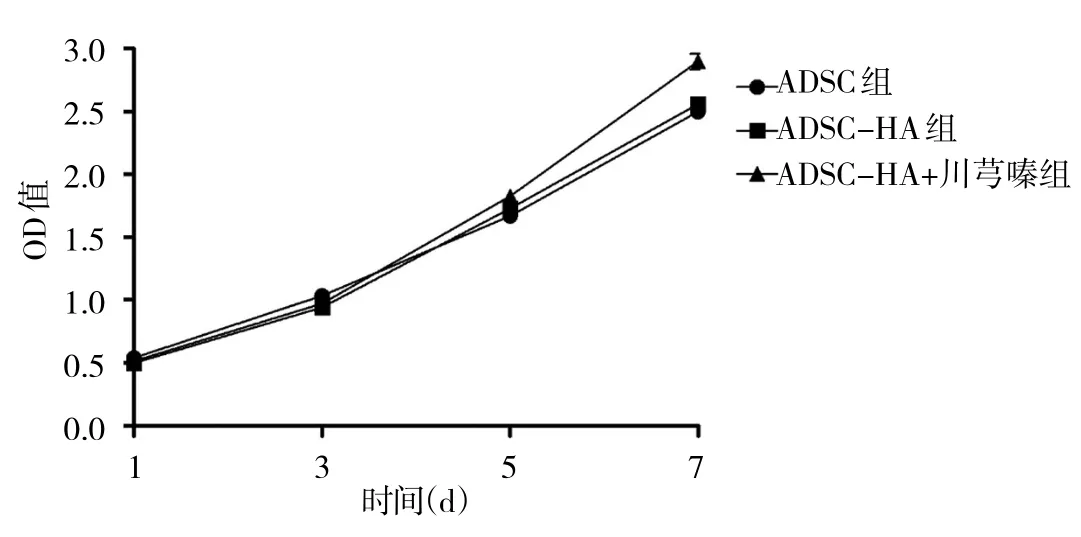
图1 各组ADSC增殖曲线
2.2 各组裸鼠皮下颗粒脂肪移植物大体情况比较裸鼠皮下颗粒脂肪移植8周后,各组小鼠的皮肤下都有突起,推测为脂肪块;解剖后,可观察到皮下黄色脂肪组织,见图2(插页)。刮取黄色脂肪组织称重,与颗粒脂肪-HA+PBS组相比,颗粒脂肪-HA+川芎嗪注射组和颗粒脂肪-HA+川芎嗪浸泡组裸鼠皮下颗粒脂肪移植物重量较重(均P<0.05)。且颗粒脂肪-HA+川芎嗪注射+浸泡组裸鼠皮下颗粒脂肪移植物重量较颗粒脂肪-HA+川芎嗪注射组、颗粒脂肪-HA+川芎嗪浸泡组更重(均P<0.05),而颗粒脂肪-HA+川芎嗪注射组与颗粒脂肪-HA+川芎嗪浸泡组比较差异无统计学意义(P>0.05)。见表2。
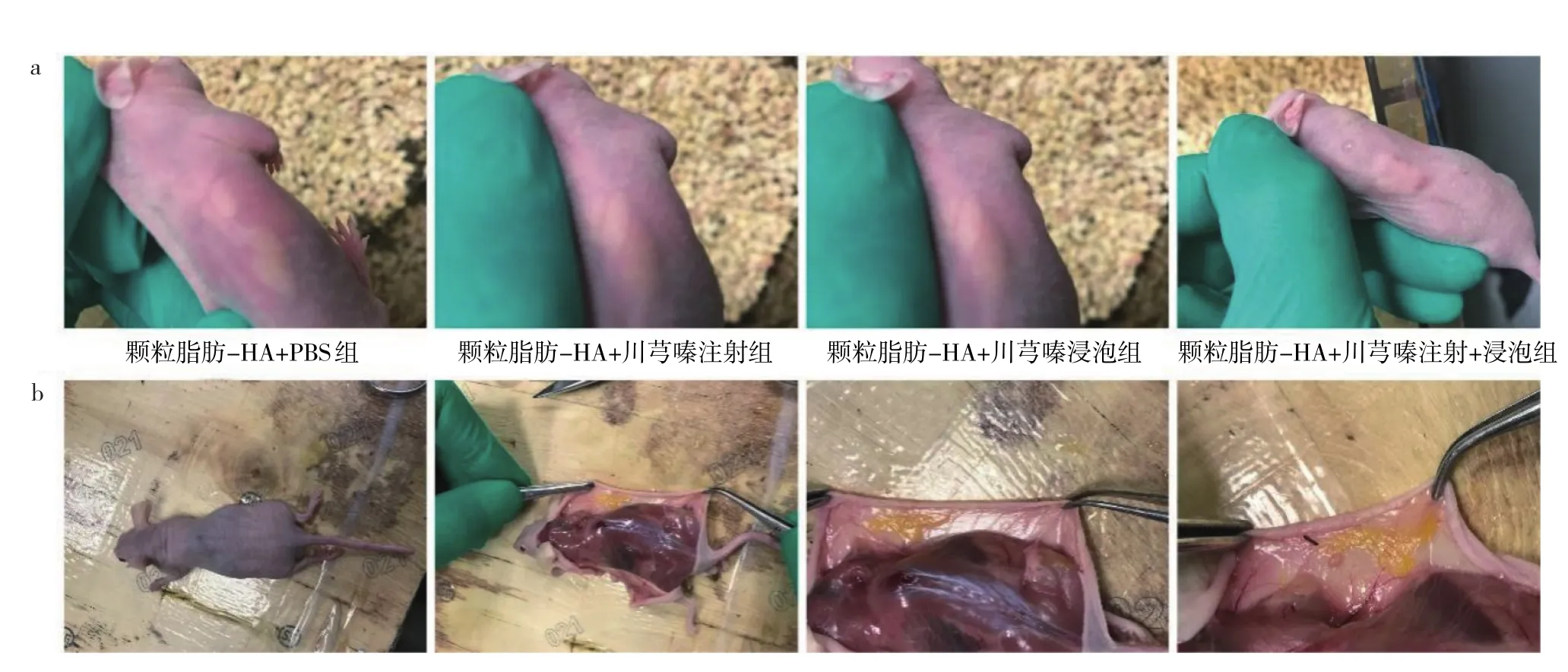
图2 各组裸鼠皮下颗粒脂肪移植物大体外观(a:移植8周后各组裸鼠的外观;b:颗粒脂肪-HA+川芎嗪注射组裸鼠解剖后皮下颗粒脂肪移植物组织)

表2 各组裸鼠皮下颗粒脂肪移植物重量比较
2.3 各组裸鼠皮下颗粒脂肪移植物组织学比较 HE和油红O染色结果显示,颗粒脂肪-HA+PBS组移植物结缔组织较多,脂肪组织较少;颗粒脂肪-HA+川芎嗪注射组脂肪细胞增多,大小不一;颗粒脂肪-HA+川芎嗪浸泡组结缔组织较多,脂肪细胞零散分布;颗粒脂肪-HA+川芎嗪注射+浸泡组脂肪细胞明显增多,排列紧密。结果表明,皮下的黄色组织确实是脂肪组织。即注射颗粒脂肪可以在裸鼠皮下形成脂肪组织,注射或浸泡川芎嗪对颗粒脂肪的生长影响不大,同时进行两种方式给药能促进脂肪细胞形成。见图3(插页)。

图3 各组裸鼠皮下颗粒脂肪移植物组织学染色结果比较(a:HE染色,×200;b:油红O染色,×400)
2.4 各组裸鼠颗粒脂肪移植组织PPAR-γ、C/EBP-α mRNA表达水平比较 与颗粒脂肪-HA+PBS组相比,颗粒脂肪-HA+川芎嗪注射组、颗粒脂肪-HA+川芎嗪浸泡组、颗粒脂肪-HA+川芎嗪注射+浸泡组裸鼠颗粒脂肪移植组织PPAR-γ、C/EBP-α mRNA表达水平均升高(均P<0.05),且颗粒脂肪-HA+川芎嗪注射+浸泡组高于颗粒脂肪-HA+川芎嗪注射组、颗粒脂肪-HA+川芎嗪浸泡组(均P<0.05),见图4。
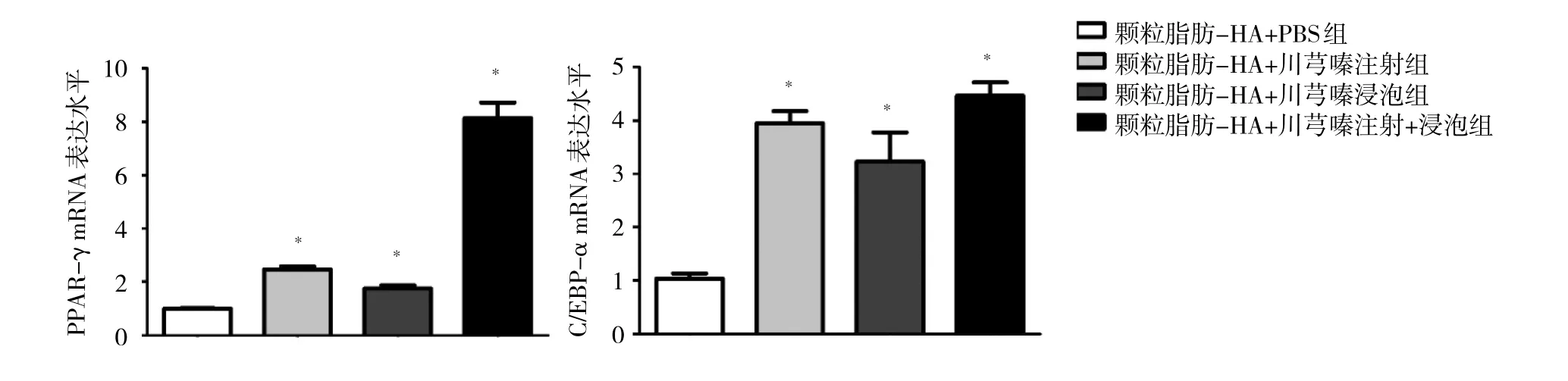
图4 各组裸鼠颗粒脂肪移植组织PPAR-γ、C/EBP-α mRNA表达水平比较
2.5 颗粒脂肪-HA+PBS组和颗粒脂肪-HA+川芎嗪注射+浸泡组裸鼠颗粒脂肪移植组织HA残留情况比较 颗粒脂肪-HA+PBS组和颗粒脂肪-HA+川芎嗪注射+浸泡组裸鼠颗粒脂肪移植组织切片进行透射电子显微镜下扫描均未检测到HA残留,即HA已经完全降解,见图5。
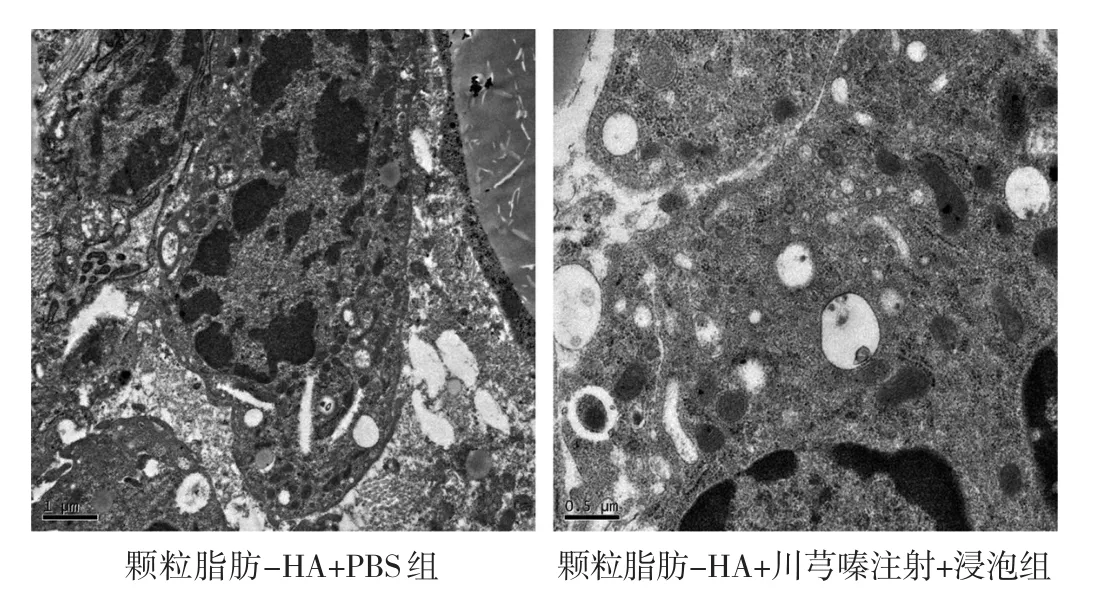
图5 各组裸鼠颗粒脂肪移植组织HA残留情况透射电子显微镜下观察所见
3 讨论
研究发现,单纯颗粒脂肪移植后只有50%~60%的存活率,移植后高脂肪组织吸收率以及可能的囊肿和钙化等并发症限制了临床上自体脂肪移植的广泛应用[5]。学者们试图通过调整脂肪供区选择,改进脂肪获取、纯化方法以及脂肪注射方式,在移植物中添加不同成分(如血管生长因子、富血小板血浆、药物成分等)多种方法来提高移植脂肪的存活率[6-7]。黄伟光等[8]发现自体颗粒脂肪移植时添加富血小板血浆能够极大地提高移植脂肪的存活率,增加隆乳患者胸围及乳房皮下脂肪厚度,并且显著减少术后并发症的发生。随着对脂肪移植研究的不断深入,研究人员就提升脂肪移植物成活率已达成共识,即移植早期建立移植物的血管系统是提升脂肪移植物存活的关键。
脂肪组织的血液供应丰富,因为各细胞均具备其单独的血供系统且与主干相连,保证了每个细胞的营养供应。颗粒脂肪移植初期,移植物还没有与受区建立良好的血液供应关系,因缺乏有效血供而导致移植物处于缺氧缺血状态,只能从移植体周围组织液中获取营养及氧,直至后期形成内部血管化并建立自己的血管系统[9]。这提示脂肪组织新生与血运重建对脂肪移植体存活的重要性。
川芎嗪是川芎的主要活性成分,具有抗血小板聚集、扩张小动脉,活血通脉,改善微循环的功效[10]。研究证实,川芎嗪可降低兔心肌梗死再灌注后心肌无复流面积和心肌梗死面积[11],且可通过促进血运重建减轻心肌缺血再灌注损伤[12]。何莉等[13]研究发现,川芎嗪能够促进骨髓移植小鼠骨髓造血细胞的恢复,改善骨髓微环境,促进骨髓造血重建。陈方等[14]基于兔股骨头坏死模型的研究证实,注射川芎嗪能够促进股骨头血管的增生和重建。这些发现提示川芎嗪对血运重建有积极的促进作用。在本研究中,川芎嗪处理显著促进了ADSC的体外增殖。体内实验表明添加川芎嗪可促进注射的颗粒脂肪存活,并在裸鼠皮下形成脂肪组织。组织学染色结果中,颗粒脂肪-HA+川芎嗪注射组,脂肪细胞增多,大小不一;颗粒脂肪-HA+川芎嗪浸泡组结缔组织较多,脂肪细胞零散分布;颗粒脂肪-HA+川芎嗪注射+浸泡组,脂肪细胞明显增多,排列紧密。这些结果提示单纯注射或浸泡川芎嗪对移植脂肪的生长影响差异不大,同时进行两种方式给药更能促进脂肪细胞形成。
作为脂肪形成关键的转录因子,PPAR-γ和C/EBP-α参与了脂肪形成的级联调控,并在成脂分化中发挥关键作用,PPAR-γ作为核受体被脂类激活,诱导脂类相关基因的表达[15]。PPAR的α、δ和γ 3种同型在控制脂质储存和动员、糖代谢、形态发生和炎症反应中起关键作用的基因表达中起综合作用。对PPAR-γ的研究发现,其作为脂肪细胞主导转录因子促进脂肪酸在脂肪沉积中存储,并调节脂肪细胞分泌激素的表达[16]。研究发现,PPAR-γ在间充质干细胞成脂分化中发挥重要的调控作用[17]。C/EBP-α作为关键的脂肪形成转录因子,在脂肪源性干细胞的成脂分化中发挥重要作用[18]。本研究发现川芎嗪促进脂肪形成相关的转录因子PPAR-γ和C/EBP-α的表达,提示川芎嗪促进脂肪形成相关基因的表达进而促进脂肪细胞形成。
综上所述,川芎嗪可促进注射的颗粒脂肪存活,并通过促进脂肪形成相关转录因子PPAR-γ和C/EBP-α的表达进而促进脂肪细胞形成。单纯注射或浸泡川芎嗪两种方式对移植脂肪的生长影响差异不大,同时进行两种方式给药干预更能促进脂肪细胞形成。

