miR-205在宫颈鳞癌中的表达及其对癌细胞迁移、侵袭能力的影响
刘建兵,林晓雨,李文龙,王伟,王文豪,崔小华,郝建卿,李莉,郝敏*
1山西医科大学第二医院妇产科,山西太原 030001;2山西医科大学基础医学院医学细胞生物与遗传学教研室,山西太原 030001
宫颈癌是一种发病率和致死率均较高的妇科肿瘤[1-2]。高危型人乳头瘤病毒的持续感染是公认的诱发宫颈癌变的主要因素[3-4]。现有研究发现,Epstein-Bar病毒、阴道微生物菌群、叶酸缺乏及化学致癌物等因素均与宫颈癌的发生发展有关[3,5-6]。微小RNA(miRNA,miR)是一段由20~24个核苷酸组成的内源性非编码RNA,一般通过与靶基因结合后的相互作用而发挥调控功能,涉及30%以上的人类基因[7-8]。目前发现宫颈癌中有近百种miRNA存在异常表达,如miR-27b、miR-196a、miR-21、miR-590等呈高表达[9-12],miR-506、miR-200b、miR-183、miR-125b等呈低表达[13-16]。差异表达的miRNA通过广泛参与宫颈癌细胞的增殖、侵袭、转移、化疗耐药、放疗抵抗等过程,在宫颈癌的发生、发展及预后中发挥重要的作用[17],但目前能应用于临床诊断及作为治疗靶标的关键miRNA还很少。本研究拟筛选宫颈癌中异常表达的miRNA,并通过细胞及分子生物学方法鉴定关键miRNA的功能机制,以探讨宫颈癌发生发展的机制,并寻找可用于宫颈癌诊断及治疗的新靶标。
1 材料与方法
1.1 样本信息及差异表达分析 从肿瘤基因图谱(The Cancer Genome Atlas,TCGA)数据库中下载宫颈鳞癌患者的临床信息及miRNA不同亚型表达量数据,包括254个肿瘤样本组织和3个邻近的非肿瘤样本组织,并在R软件中进行归一化处理。采用R软件中的“limma”包分析并筛选差异表达的miRNA,筛选标准为差异倍数>2.5及P<0.01。P值经错误发现率(FDR)校正。
1.2 宫颈鳞癌样本及癌细胞株 选取2021年6-9月在山西医科大学第二医院进行手术治疗的21例宫颈鳞癌患者。纳入标准:初次确诊为宫颈鳞癌;治疗前未进行化疗、放疗及免疫治疗等;接受宫颈癌切除术。收集手术切除的21例宫颈鳞癌组织及13例癌旁组织,将标本保存于4%多聚甲醛溶液及液氮中。本研究经山西医科大学伦理委员会审查通过(2021SLL044)。人宫颈癌细胞系HeLa及SiHa细胞购自中国医学科学院基础医学研究所细胞资源中心,培养于DMEM培养基(含10%FBS、1%双抗)中,于细胞培养箱(37 ℃、5% CO2)中生长,备用。
1.3 细胞转染 对照(NC)组、miR-205组,miR-205抑制剂对照组,miR-205抑制剂组以及si-IL-32组细胞,分别利用Lipofectamine 2000转染NC序列(UCCUUCAUUCCACCGGAGUCUG)、miR-205 mimics序列(GACUCCGGUGGAAUGAAGGAUU)、miR-205 inhibitor NC序列(CAGUACUUUUGUGUAG UACAA)、miR-205 inhibitor序列(CAGACUCCGGUG GAAUGAAGGA)及IL-32 siRNA序列(GGCUUGAUU ACUCUCUAUATT)。
1.4 原位杂交法检测癌组织中miR-205的表达 采用原位杂交法检测癌组织中miR-205的表达,以癌旁组织作为对照。将人宫颈鳞癌组织用4%多聚甲醛溶液固定、石蜡包埋,切成4 µm厚的切片,蛋白酶K处理,室温下用醋酸酐、三乙醇胺溶液孵育10 min,加入地高辛标记的RNA探针[5'-CAG(+A)C(+T)CCGG(+T)GGAA(+T)GA(+A)GGA-Dig-3'],4 ℃孵育过夜。次日用含吐温-20的磷酸盐缓冲液冲洗,并用碱性磷酸酶显色液处理至显色,水洗残液,乙醇脱水,封片,拍照。
1.5 qRT-PCR法检测miR-205及IL-32的表达 提取总RNA,并要求其光密度(OD)260/OD280为1.8~2.0;将RNA进行反转录,得到模板cDNA;以cDNA为模板,构建PCR体系,采用两步法进行PCR扩增。引物序列如下。miR-205:反转引物RT-205 5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTC GCACTGGATACGACCAGACT-3';扩增引物正向5'-AATTGTCCTTCATTCCACCGG-3',反向5'-GTGC AGGGTCCGAGGT-3';IL-32正向5'-TCTCAGTGGA GCTGGGTCAT-3',反向5'-CCAACCCCTGAGCAGAA GTA-3';U6正向5'-CGCヰCGGCAGCACATATAC-3',反向5'-TTCACGAATTTGCGTGTCAT-3';GAPDH正向5'-CGAGATCCCTCCAAAATCAA-3',反向5'-TTCACACCCATGACGAACAT-3'。以人U6基因或GAPDH作为内参照,目的基因mRNA相对表达量=2-ΔΔCt。ΔΔCt=(目的基因Ct-内参照基因Ct)处理组-(目的基因Ct-内参照基因Ct)对照组。
1.6 细胞增殖、迁移及侵袭能力检测 (1)细胞增殖检测:采用CCK-8法,取适量细胞,置于96孔板,每组重复5孔,分别于培养0 h和48 h每孔添加10 µl CCK-8溶液,孵育1 h,用酶标仪测定450 nm处的OD值,计算细胞活力。(2)细胞迁移及侵袭能力检测:采用Transwell模型,将Transwell小室放入预先每孔加有600 µl培养基(含10%血清)的24孔板内,在Transwell的内室(侵袭实验中的Transwell小室需提前铺Matrigel基质胶)加入适量细胞,培养一定时间后,取出小室,擦掉内室细胞,利用4%多聚甲醛溶液固定小室外细胞,伊红或结晶紫染色后,于显微镜下观察、计数、拍照。
1.7 miR-205对IL-32mRNA表达的调节作用 在宫颈癌HeLa及SiHa细胞中,检测过表达或降低miR-205表达后IL-32的表达情况。比较IL-32启动子与miR-205序列,构建IL-32启动子报告载体,将IL-32启动子报告载体与NC或miR-205mimics序列分别共转染于HeLa细胞中,采用双荧光素酶报告基因检测试剂盒(海肾萤光素酶基因为报告基因,萤火虫萤光素酶基因为内参照基因,美国Promega公司)检测相对荧光素酶活性。
1.8 Western blotting法检测侵袭相关蛋白的表达将HeLa和SiHa细胞各分为对照组及si-IL-32组,提取细胞总蛋白,测定OD562nm值,根据标准曲线法测得蛋白浓度。取30~50 µg蛋白样品,变性,SDSPAGE凝胶电泳,转膜,用5%脱脂奶粉溶液封闭1 h,孵育一抗过夜;磷酸盐缓冲溶液冲洗3~5次,孵育二抗1 h;磷酸缓冲溶液冲洗3~5次,按化学发光试剂盒要求进行曝光显影(取溶液A、B各1 ml,避光条件下配制发光液,滴加适量发光液,使其与蛋白膜充分接触,反应1 min后,进入暗室显影、定影)。所用抗体如下:兔源MMP-2、MMP-9(1:1000,美国Proteintech公司)及兔源GAPDH(1:5000,美国Bioworld公司)。以GAPDH为内参,通过条带灰度分析计算蛋白相对表达量。
1.9 统计学处理 采用Excel 2007软件进行统计学分析。计量资料以表示,宫颈癌组和癌旁组的比较采用配对t检验,实验组与对照组间的比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 筛选宫颈鳞癌差异表达miRNA 生物信息学分析显示,宫颈鳞癌中具有表达差异的miRNA共106个,其中70个上调,36个下调。在差异表达的miRNA中,miR-205表达量变化最大,差异倍数为8.414(图1,表1)。

表1 宫颈鳞癌中表达上调及下调前5位的miRNATab.1 The top five up-regulated and down-regulated miRNAs in cervical squamous cell carcinoma

图1 宫颈鳞癌中差异表达的miRNA火山图Fig.1 Volcano plot of differentially expressed miRNAs in cervical squamous cell carcinoma
2.2 宫颈癌组织中m i R-2 0 5 的表达水平 在TCGA数据库中,与宫颈正常组织miR-205表达量(55.60±3.6)比较,宫颈鳞癌组织的miR-205表达量(12 122.59±9000.7)明显升高,差异有统计学意义(P<0.05,图2A)。原位杂交检测结果显示,miR-205在人宫颈鳞癌组织中呈阳性表达(蓝色),而在癌旁组织中表达很弱,甚至不表达(图2B)。宫颈鳞癌临床标本癌组织的miR-205表达量明显高于癌旁组织[(1.86±0.19)vs. 1.00,P<0.05,图2C]。2.3 过表达miR-205对宫颈癌HeLa细胞增殖、迁移及侵袭能力的影响 HeLa细胞转染实验结果显示,与对照组比较,miR-205组miR-205的表达水平明显升高(P<0.05,图3A);CCK-8法检测结果显示,与对照组比较,miR-205组细胞活力明显升高(P<0.05,图3B);Transwell法检测结果显示,与对照组比较,miR-205组能够迁移或侵袭过Transwell小室的细胞数量明显增多(P<0.01,图3C)。
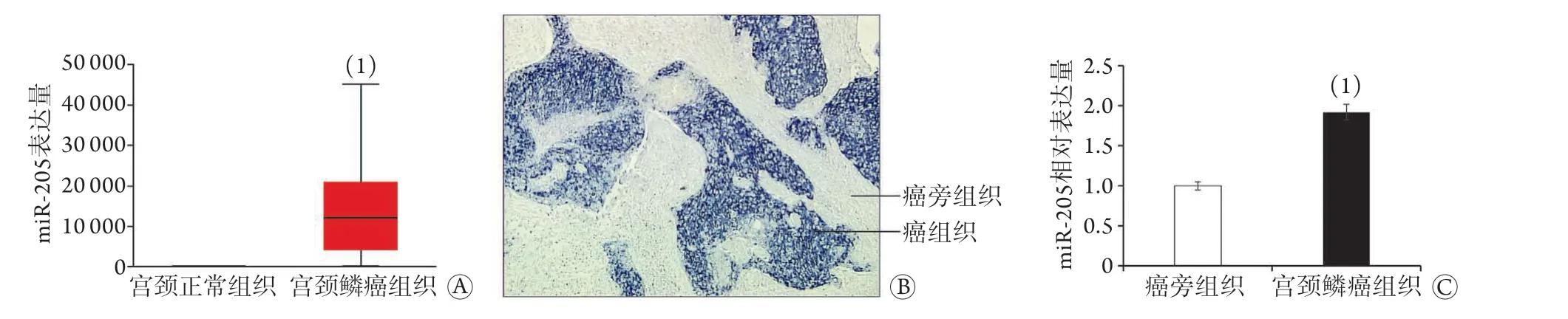
图2 宫颈鳞癌与正常组织中miR-205的表达情况Fig.2 The expression of miR-205 in normal tissue and cervical squamous cell carcinoma
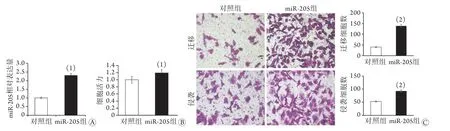
图3 miR-205过表达对宫颈癌HeLa细胞增殖、迁移及侵袭的影响Fig.3 The effect of over-expressed miR-205 on proliferation, migration and invasion of cervical cancer HeLa cells
2.4 miR-205对IL-32mRNA表达的调节作用 与对照组比较,miR-205组miR-205表达量明显升高(P<0.05,图4A);与miR-205抑制剂对照组比较,miR-205抑制剂组miR-205表达量明显降低(P<0.05,图4B)。与对照组比较,miR-205组IL-32mRNA相对表达量明显升高(P<0.05,图4C); 与miR-205抑制剂对照组比较,miR-205抑制剂组IL-32mRNA相对表达量明显降低(P<0.05,图4D)。在临床标本中,与癌旁组织比较,宫颈鳞癌组织中IL-32mRNA相对表达量明显升高(P<0.05,图4E)。与IL-32启动子报告载体+NC组比较,IL-32启动子报告载体+miR-205组的相对荧光活性明显升高(P<0.05,图4F)。
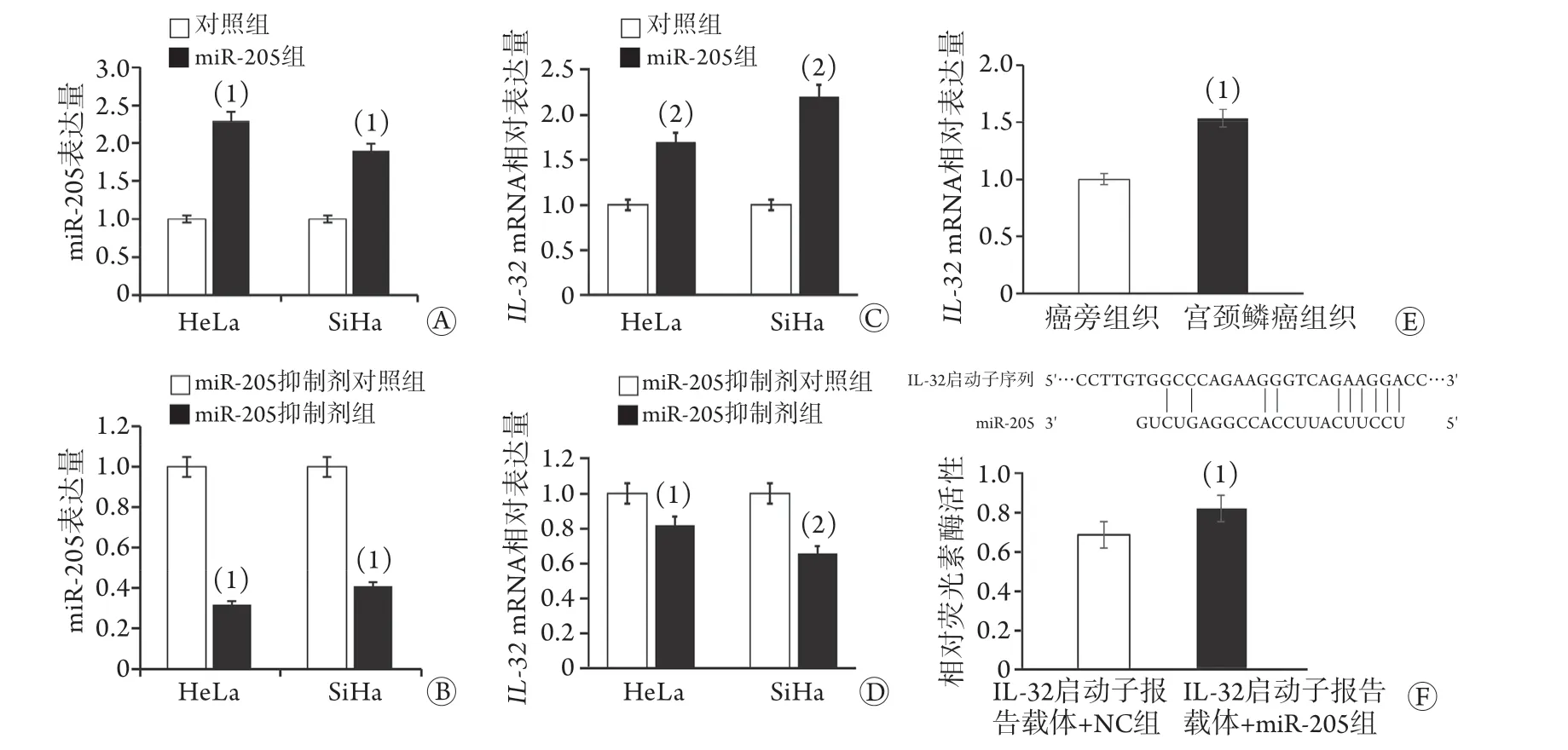
图4 miR-205对IL-32 mRNA表达的调节作用Fig.4 Regulating effect of miR-205 and on the expression of IL-32 mRNA
2.5 miR-205和IL-32对宫颈癌细胞侵袭及侵袭相关蛋白MMP-2、MMP-9表达的影响 与对照组比较,si-IL-32组细胞IL-32mRNA相对表达量明显降低(P<0.05,图5A、B)。Transwell法检测结果显示,降低miR-205表达后迁移过Transwell小室的细胞数量明显变少(P<0.05,图5C);si-IL-32组能够侵袭过Transwell小室的细胞数量也明显少于对照组(P<0.05,图5D)。Western blotting检测结果显示,si-IL-32组MMP-2、MMP-9蛋白的相对表达量明显低于对照组(P<0.05,图6)。

图5 miR-205和IL-32对宫颈癌细胞侵袭的影响Fig.5 The effect of miR-205 and IL-32 on the invasion of cervical cancer cells
3 讨 论
宫颈癌中有近百种miRNA存在异常表达,但目前能应用于临床诊断及作为治疗靶标的关键miRNA还很少。本研究经筛选获得了宫颈癌中共106个差异表达的miRNA,其中miR-205表达明显上调,且变化量最大。本研究发现,miR-205在宫颈癌组织中表达水平明显高于癌旁组织,提示miR-205可能对宫颈癌的发生发展起重要作用。miR-205是一个非常保守的非编码RNA分子,在多种癌症的发生发展中异常表达,在不同类型的癌症中,既可以充当致癌因子,又可以充当抑癌因子的角色[18]。在宫颈癌的研究中,关于miR-205的功能也有不同报道。有研究发现,miR-205促进了宫颈癌细胞的增殖、迁移及侵袭[19-21],也有研究显示miR-205能够抑制宫颈癌细胞的增殖及侵袭[22-23]。本研究证实,miR-205能促进宫颈癌细胞的增殖、迁移、侵袭,为阐明miR-205在宫颈癌中的作用提供了新证据。
人IL-32起初发现于活化的NK细胞及T细胞,主要表达于免疫细胞及上皮细胞,是一种促炎细胞因子[24]。IL-32在多种类型的癌症中异常表达,能够通过促炎效应、抗病毒感染、促血管生成等方式及途径参与调控肿瘤的发生发展,但其在宫颈癌中的作用研究较少。既往发现IL-32对宫颈癌的发展具有抑制作用[25-26],但Lee等[25]发现IL-32高表达与宫颈癌的进展显著相关,随着人乳头瘤病毒(HPV)持续感染,使炎症持续,可能会促进宫颈发生癌变。IL-32可诱导肿瘤坏死因子(TNF)-α等炎性因子的表达,进而促进炎症反应[27]。Lee等[25]证实,IL-32可促进IL-1β、TNF-α及IL-18等炎性因子的表达。本研究发现,miR-205可促进炎性因子IL-32的表达,进而增强MMP-2、MMP-9的表达,促进宫颈癌细胞的侵袭。有研究发现,miRNA与炎性因子能够相互作用:一方面,miRNA靶向炎症执行者,调节炎症反应;另一方面,炎症信号可改变miRNA的表达,进而调节炎性因子表达,破坏促肿瘤与抗肿瘤信号转导的平衡,进而在恶性转化中发挥重要的调控作用[28]。上述结果提示,miR-205可能通过调控炎性因子IL-32的表达在宫颈癌的发生发展中发挥重要的促进作用。
经典理论认为,miRNA对靶基因具有负调控作用,但有研究发现miRNA在基因表达调控中也有正向调控的情况发生。Vasudevan等[29]证实miRNA可从对基因表达的抑制作用转变为活化作用;Majid等[30]发现,miR-205能够结合于IL-24及IL-32的启动子区,并诱导靶基因mRNA和蛋白的高表达;Kim等[31]发现,口腔癌中miR-205能够直接上调IL-24的表达;Xiao等[32]发现,位于细胞核内的miRNA可起到激活基因转录的作用;本课题组前期研究也发现,miR-205能够直接上调靶基因CHN1的表达[21]。由此看来,miRNA对靶基因的调控机制除了经典的负调控以外,还可能有正调控作用。在miR-205的调控模式中已经多次发现正调控的现象,表明miR-205对靶基因调控机制较为复杂。本研究发现,在宫颈癌细胞中miR-205与IL-32mRNA的表达变化一致,原位杂交实验显示miR-205可能在细胞核中高表达;本实验还证实miR-205可通过与IL-32启动子相互作用提高IL-32mRNA的表达量。这为后续研究miR-205的复杂作用机制指明了方向,也再次证实了miR-205与IL-32的调控关系,但miR-205通过调控IL-32的表达影响宫颈癌发生发展的具体机制还需进一步深入研究。
综上所述,在宫颈鳞癌中存在异常表达的miRNA,其中miR-205明显高表达,可能通过上调IL-32的表达调节MMP-2和MMP-9的表达水平,从而促进癌细胞的增殖、迁移及侵袭。

