LncRNA SOX2OT对肺炎链球菌诱导的肺泡上皮细胞凋亡和炎症反应的影响及机制
徐义松 龚成林 王利华
肺炎链球菌是诱发肺炎的主要病原菌,其可引起肺泡上皮细胞凋亡及炎性损伤[1]。探究肺炎链球菌引起的肺泡上皮细胞凋亡及炎性损伤的机制,对肺炎的防治具有重要意义。性别决定区Y-框转录因子2重叠转录本(sex determining region Y-box 2 overlapping transcript,SOX2OT)是一种长链非编码RNA(Long non-coding RNA,LncRNA),基因位于3号染色体长臂26区33带,其在多种疾病中异常表达,参与调控疾病的发展进程。研究显示,LncRNA SOX2OT在氧糖剥夺/复氧处理的心肌细胞H9c2中表达增加,沉默LncRNA SOX2OT可通过靶向微小RNA(microRNA,miR)-215-5p/锌指E盒结合同源盒蛋白2(zinc finger E-box binding homeobox 2,ZEB2)轴促进氧糖剥夺/复氧处理的H9c2细胞活力,并抑制细胞凋亡,其可作为心力衰竭治疗的分子靶点[2];LncRNA SOX2OT在脊髓损伤大鼠和脂多糖诱导的神经细胞中表达升高,其通过激活Janus 通路促进脂多糖(lipopolysaccharide,LPS)介导的神经细胞凋亡、炎症和氧化应激,促进大鼠脊髓损伤[3]。然而,LncRNA SOX2OT对肺炎发生发展的影响及调控机制还未知。DIANA Tools靶基因在线软件预测显示,LncRNA SOX2OT可能靶向结合miR-146a-5p。有报道称,miR-146a-5p在急性期肺炎患者血清及LPS诱导的WI-38细胞中表达下调,上调其表达可通过靶向抑制趋化因子(C-C 基序)配体 5(chemokine (C-C motif) ligand 5,CCL5)的表达减少LPS诱导的WI-38细胞凋亡,并减轻细胞炎性损伤,miR-146a-5p为肺炎的治疗提供了新靶点[4]。本研究建立肺炎链球菌诱导的肺泡上皮细胞HEPApiC损伤模型,观察了LncRNA SOX2OT对肺炎链球菌诱导的HEPApiC细胞凋亡和炎症反应的影响及其能否靶向miR-146a-5p发挥作用,以期了解LncRNA SOX2OT/miR-146a-5p轴对肺炎链球菌诱发肺炎发生发展的影响,为肺炎治疗提供分子靶点。
资料与方法
一、材料
选取2019年5月至2020年10月于本院确诊的51例肺炎链球菌肺炎患者为研究对象,男29例,女22例,年龄(4.26±1.05)岁。肺炎链球菌肺炎诊断标准[5]如下:出现咳嗽、咳痰等肺炎临床症状,肺部听诊异常,实验室检查外周血炎性指标升高,病原学检查肺炎链球菌阳性。另选取同时期29例健康体检者为对照,男16例,女13例,年龄(4.52±1.12)岁。两组年龄、性别等一般资料无显著差异(P<0.05;χ2=0.021,P=0.884)。研究符合《赫尔辛基宣言》原则。
HEPApiC细胞系,武汉普诺赛生命科技有限公司;胎牛血清,浙江天杭生物科技有限公司;DMEM培养液、二喹啉甲酸(BCA)蛋白检测试剂盒、Annexin V-FITC/PI细胞凋亡试剂盒和双荧光素酶活性检测试剂盒,北京索莱宝;RNA抽提试剂盒、逆转录试剂盒和PCR试剂盒,大连宝生物;LipofectamineTM 2000试剂盒,美国Invitrogen公司;引物序列、LncRNA SOX2OT小干扰RNA(si-LncRNA SOX2OT)及阴性对照序列(si-NC)、LncRNA SOX2OT野生型和突变型荧光素酶报告基因载体(WT-LncRNA SOX2OT、MUT-LncRNA SOX2OT)、miR-146a-5p模拟物(mimics)和抑制剂(anti-miR-146a-5p)、抑制剂阴性序列(anti-miR-NC)及模拟对照序列(miR-NC),上海生工;白细胞介素(interleukin,IL)-6、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和IL-10试剂盒,南京建成;兔抗B淋巴细胞瘤-2相关蛋白(Bcl-2-associated X protein,Bax)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体,中国Abcam公司。
二、方法
1 qRT-PCR检测LncRNA SOX2OT和miR-146a-5p表达:采集两组受试者清晨空腹周静脉血,用RNA抽提试剂盒提取总RNA,逆转录为cDNA后,行PCR反应。引物序列见表1。2-△△Ct法计算LncRNA SOX2OT相对GAPDH、miR-146a-5p相对U6的表达量。

表1 引物序列
2 细胞培养:复苏HEPApiC,加含10 %胎牛血清的DMEM培养液,置于CO2培养箱中培养。于6孔板中每孔接种5.0×105个HEPApiC细胞,培养12 h后,弃培养液,分为对照(con)组和model组。con组用常规培养液培养,model组用1×108CFU·mL-1[6]肺炎链球菌感染细胞。然后qRT-PCR检测细胞中LncRNA SOX2OT和miR-146a-5p表达,方法同1.3.1。
3 双荧光素酶报告基因实验:于6孔板中每孔接种5.0×105个HEPApiC细胞,培养12 h后,弃培养液。用LipofectamineTM 2000脂质体法,分别共转染WT-LncRNA SOX2OT与miR-NC(或miR-146a-5p mimic)、MUT-LncRNA SOX2OT与miR-NC(或miR-146a-5p mimic)。转染12 h后,弃培养液,裂解细胞。3500 r·min-1离心10 min。取20 μL上清液,加100 μL 1×萤火虫或海肾荧光素酶反应工作液,检测萤火虫和海肾的荧光强度。以萤火虫与海肾荧光强度的比值,表示细胞荧光素酶活性。
4 细胞转染和分组处理:于6孔板中每孔接种5.0×105个HEPApiC细胞,培养12 h后,弃培养液。用LipofectamineTM 2000脂质体法,分别转染si-NC、si-LncRNA SOX2OT、共转染si-LncRNA SOX2OT与anti-miR-NC、si-LncRNA SOX2OT与anti-miR-146a-5p。转染12 h后,弃培养液。加新鲜培养液,在培养24 h。然后收集转染后的细胞重新制为单细胞悬液,接种至6孔板中(5.0×105个/孔),培养12 h后,均按照model组进行处理,并分别记为model+si-NC组、model+si-LncRNA SOX2OT组、model+si-LncRNA SOX2OT+anti-miR-NC组、model+si-LncRNA SOX2OT+anti-miR-146a-5p组。同时设置con组和model组,同1.3.2。处理结束后,收集各组细胞和细胞培养上清液,进行后续指标检测。
5 流式细胞仪检测细胞凋亡:利用Annexin V-FITC/PI试剂盒,检测各组细胞凋亡。
6 蛋白质印迹法检测Bax和Bcl-2蛋白表达:用RIPA试剂提取各组细胞中总蛋白,BCA试剂盒检测蛋白含量。行10 % SDS-PAGE电泳分离蛋白,经转膜和封闭处理后,于4℃冰箱中分别用Bax(1 ∶500)、Bcl-2(1 ∶500)和GAPDH(1 ∶1000)一抗孵育过夜,洗膜,再用山羊抗兔二抗(1 ∶2000)37℃孵育1 h。加显影液,避光显影,曝光拍照,Image J 软件分析Bax、Bcl-2相对GAPDH的表达量。
7 酶联免疫吸附法检测细胞培养上清液中IL-6、TNF-α和IL-10含量:将收集的各组细胞培养上清液3500 r·min-1离心10 min,取上清,分别利用IL-6、TNF-α和IL-10试剂盒,采用酶联免疫吸附法检测上清中其含量。
三、 统计学处理
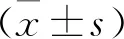
结 果
一、 LncRNA SOX2OT和miR-146a-5p在肺炎患者中的表达
肺炎患者外周血中LncRNA SOX2OT表达量为2.11±0.32,显著高于健康对照组(0.75±0.17,t=21.209,P<0.05);miR-146a-5p表达量为0.52±0.09,显著低于健康对照组(1.25±0.17,t=25.157,P<0.05)。
二、 肺炎链球菌对肺泡上皮细胞中LncRNA SOX2OT和miR-146a-5p表达的影响
model组肺泡上皮细胞中LncRNA SOX2OT表达量为3.26±0.28,显著高于con组(1.00±0.00,t=24.214,P<0.05);miR-146a-5p表达量为0.23±0.02,显著低于con组(1.00±0.00,t=115.500,P<0.05)。
三、LncRNA SOX2OT靶向负调控miR-146a-5p
转染si-LncRNA SOX2OT的肺泡上皮细胞中LncRNA SOX2OT的表达量为0.26±0.04,显著低于转染si-NC的细胞(1.00±0.00,t=55.500,P<0.05),说明转染si-LncRNA SOX2OT的肺泡上皮细胞中LncRNA SOX2OT表达下调。LncRNA SOX2OT与miR-146a-5p核苷酸序列的结合位点(见图1)。共转染WT-LncRNA SOX2OT与miR-146a-5p mimics的细胞荧光素酶活性为0.33±0.04,显著低于共转染WT-LncRNA SOX2OT与miR-NC的细胞(0.99±0.08,t=22.137,P<0.05);共转染MUT-LncRNA SOX2OT与miR-146a-5p mimics的细胞荧光素酶活性为0.97±0.11,与共转染MUT-LncRNA SOX2OT与miR-NC的细胞比较差异无统计学意义(1.00±0.07,t=0.690,P=0.500)。转染si-LncRNA SOX2OT的肺泡上皮细胞中miR-146a-5p的表达量为4.23±0.12,显著高于转染si-NC的细胞(1.00±0.00,t=80.750,P<0.05),说明下调LncRNA SOX2OT促进miR-146a-5p的表达。

图1 LncRNA SOX2OT与miR-146a-5p核苷酸序列的结合位点
四、LncRNA SOX2OT靶向miR-146a-5p调控肺炎链球菌诱导的肺泡上皮细胞凋亡
model组肺泡上皮细胞凋亡率和细胞中Bax蛋白表达高于con组(P<0.05),Bcl-2蛋白表达低于con组(P<0.05)。model+si-LncRNA SOX2OT组肺泡上皮细胞凋亡率和细胞中Bax蛋白表达低于model+si-NC组(P<0.05),Bcl-2蛋白表达高于model+si-NC组(P<0.05)。model+si-LncRNA SOX2OT+anti-miR-146a-5p组肺泡上皮细胞凋亡率和细胞中Bax蛋白表达高于model+si-LncRNA SOX2OT+anti-miR-NC组(P<0.05),Bcl-2蛋白表达低于model+si-LncRNA SOX2OT+anti-miR-NC组(P<0.05)。model组与model+si-NC组、model+si-LncRNA SOX2OT组与model+si-LncRNA SOX2OT+anti-miR-NC组各检测测指标比较差异均无统计学意义(P>0.05)(见图2、表2)。
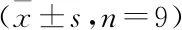
表2 LncRNA SOX2OT靶向miR-146a-5p对肺炎链球菌诱导的肺泡上皮细胞凋亡的影响

图2 LncRNA SOX2OT靶向miR-146a-5p对肺炎链球菌诱导的肺泡上皮细胞凋亡的影响
五、LncRNA SOX2OT靶向miR-146a-5p对肺炎链球菌诱导的肺泡上皮细胞炎症因子表达的影响
model组肺泡上皮细胞培养上清液中,IL-6和TNF-α水平高于con组(P<0.05),IL-10水平低于con组(P<0.05)。model+si-LncRNA SOX2OT组肺泡上皮细胞培养上清液中IL-6和TNF-α水平低于model+si-NC组(P<0.05),IL-10水平高于model+si-NC组(P<0.05)。model+si-LncRNA SOX2OT+anti-miR-146a-5p组肺泡上皮细胞培养上清液中IL-6和TNF-α水平高于model+si-LncRNA SOX2OT+anti-miR-NC组(P<0.05),IL-10水平低于model+si-LncRNA SOX2OT+anti-miR-NC组(P<0.05)。model组与model+si-NC组、model+si-LncRNA SOX2OT组与model+si-LncRNA SOX2OT+anti-miR-NC组各检测测指标比较差异均无统计学意义(P>0.05)(见表3)。
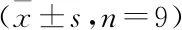
表3 LncRNA SOX2OT靶向miR-146a-5p对肺炎链球菌诱导的肺泡上皮细胞炎症因子表达的影响
讨 论
肺炎是常见的炎症性肺部疾病,具有较高的发病率。肺炎链球菌是一种革兰氏阳性菌,其可感染肺泡上皮细胞导致其炎性损伤和凋亡,进而诱发肺炎。因此,减轻或抑制肺炎链球菌诱导的肺泡上皮细胞凋亡和炎症反应,对肺炎治疗尤为重要。lncRNA是一类长链非编码RNA,其参与调控细胞增殖、凋亡、炎症反应等生理或病理过程[7-9]。研究显示,肺炎患者体内存在大量异常表达的lncRNA,这些lncRNA参与调控肺泡上皮细胞凋亡及炎性损伤,为肺炎的治疗提供了潜在分子靶点。例如,明是非等[10]研究显示,lncRNA PVT1在肺炎链球菌坏死性肺炎肺组织和肺炎链球菌诱导的肺泡上皮细胞A549中,表达上调,敲减其表达抑制了肺炎链球菌诱导的A549细胞凋亡及炎性因子IL-6和转化生长因子β(transforming growth factor β,TGF-β)的表达。
作为一种LncRNA,LncRNA SOX2OT参与肿瘤[11]、心力衰竭[12]和腹主动脉瘤[13]等疾病的发生发展,然而其对肺炎发生发展的影响还未知。本研究结果显示,LncRNA SOX2OT在肺炎患者外周血及肺炎链球菌诱导的肺泡上皮细胞HEPApiC中表达增加,这提示其可能促进肺炎的发展进程;通过下调HEPApiC细胞中LncRNA SOX2OT的表达发现,下调LncRNA SOX2OT有效减少了肺炎链球菌诱导的HEPApiC细胞凋亡率,提示LncRNA SOX2OT有可能成为肺炎治疗的分子靶点。Bax是促凋亡分子,其表达增加促进细胞凋亡;Bcl-2是抗凋亡分子,其表达增加,则阻碍细胞凋亡[14]。本研究结果显示,下调LncRNA SOX2OT降低了肺炎链球菌诱导的HEPApiC细胞中Bax蛋白表达,而促进了Bcl-2蛋白表达,进一步说明下调LncRNA SOX2OT抑制了肺炎链球菌诱导的HEPApiC细胞凋亡。
炎症反应,在肺炎的发生发展中起重要作用,抑制肺泡上皮细胞炎症反应对肺炎的防治尤为重要。肺泡上皮细胞感染肺炎链球菌后,分泌TNF-α、IL-6和IL-10等大量炎性因子,其中TNF-α和IL-6未促炎因子,促进肺泡上皮细胞炎性损伤;而IL-10为抗炎因子,对细胞炎性损伤具有保护作用[5]。本研究结果显示,下调LncRNA SOX2OT对肺炎链球菌诱导的肺泡上皮细胞HEPApiC中IL-6和TNF-α的分泌具有显著抑制作用,而对IL-10的分泌具有促进作用,说明下调LncRNA SOX2OT抑制肺炎链球菌诱导的肺泡上皮细胞炎症反应,LncRNA SOX2OT可作为减轻肺泡上皮细胞炎性损伤的分子靶点。
LncRNA可发挥miRNA分子海绵作用调控miaRNA靶基因的表达,进而发挥生物学调控作用[15]。为了探究下调LncRNA SOX2OT抑制肺炎链球菌诱导的肺泡上皮细胞HEPApiC凋亡和炎症反应的分子机制,本研究证实了LncRNA SOX2OT可靶向结合并负调控miR-146a-5p。研究显示,miR-146a-5p高表达的社区获得性肺炎患者预后优于低表达患者,miR-146a-5p可作为社区获得性肺炎患者预后判断的生物标志物[16]。本研究结果显示,肺炎患者外周血及肺炎链球菌诱导的肺泡上皮细胞HEPApiC中miR-146a-5p的表达均下调,上调miR-146a-5p对肺炎链球菌诱导的HEPApiC细胞凋亡及炎症反应具有显著抑制作用,说明miR-146a-5p对肺炎链球菌诱导的HEPApiC细胞具有保护作用,提示miR-146a-5p可作为肺炎治疗的分子靶点。此外,本研究还显示,下调miR-146a-5p逆转了下调LncRNA SOX2OT对肺炎链球菌诱导的HEPApiC细胞凋亡和炎症反应的影响,进一步提示LncRNA SOX2OT通过靶向负调控miR-146a-5p来影响肺炎链球菌诱导的HEPApiC细胞凋亡和炎症反应,但其具体调控的miR-146a-5p的靶基因还有待探究。
综上,LncRNA SOX2OT在肺炎患者外周血及肺炎链球菌诱导的肺泡上皮细胞HEPApiC中表达上调,而miR-146a-5p表达下调;下调LncRNA SOX2OT可能通过靶向上调miR-146a-5p抑制肺炎链球菌诱导的肺泡上皮细胞HEPApiC凋亡和炎症反应,LncRNA SOX2OT/miR-146a-5p轴可能为肺炎的治疗提供了新靶点。

