富营养化湖泊中铜锈环棱螺分解对钨迁移影响
刘振海,宋兰兰,燕文明,2,邢小蕾,赵梓屹,陈 翔,李 琪
(1.河海大学水文水资源学院,江苏 南京 210098; 2.河海大学水文水资源与水利工程科学国家重点实验室,江苏 南京 210098)
近年来,随着工业的快速发展和城市化进程的加快,太湖水体污染问题日益突出,尤其是重金属等污染物排放量的不断增加,不仅造成了严重的环境问题,对人类健康也构成了极大的威胁[1-3]。重金属进入水体后,通过吸附、共沉淀等作用贮存于沉积物中,当沉积物-水界面环境发生变化,沉积物中蓄积的重金属会再次活化而被释放出来,成为太湖水体重金属的源和汇[4-6]。钨一直被认为是微毒元素[7],由于其化学性质稳定且难溶于水,因此,水环境中关于钨迁移的研究较少。但近来有关研究发现,钨可被生物富集而进入食物链,进而对人体健康造成危害[8-10],会增加罹患糖尿病、心血管病、甲状腺疾病[11-13]和儿童白血病[14-17]的风险。沉积物中钨受铁锰氧化还原所控制:好氧环境下,钨与铁锰氧化物形成稳定的矿物沉淀[18];厌氧环境下,钨伴随着铁锰氧化物还原溶解,被再次释放[19]。
水生生物是水生态系统的重要组成部分,它们的存在能够加快碎屑分解,促进物质交换和水体净化[20]。但水生生物死亡后,又会对沉积物-水界面附近的重金属地球化学循环产生影响[21]。汤亚洲等[22]发现蓝藻降解消耗了大量的溶解氧,钨可通过锰氧化物的还原溶解释放至上覆水,锰氧化物的形态控制着钨的迁移。底栖动物作为水生态系统的一个重要生态类群,其死亡分解必然也会引起沉积物重金属形态的变化,而底栖动物死亡分解对钨迁移的影响目前未见报道。
本文以太湖梅梁湾为研究对象,通过模拟自然状态下铜锈环棱螺死亡分解所引起的钨形态变化,分析水体富营养化后铜锈环棱螺死亡分解对沉积物中钨迁移的影响。
1 材料与方法
1.1 研究对象及采样
太湖是中国第三大淡水湖,蓝藻频繁暴发是太湖面临的重要挑战之一[23-25]。为探究太湖富营养化后铜锈环棱螺死亡分解状况及水体中钨形态对其的响应变化,选取富营养化湖区梅梁湾(31°26′18″ N,120°11′12″E)为研究对象,利用重力采样器(直径90 mm,高度500 mm)采集16根沉积柱样品(1/3上覆水,2/3沉积物);同步采集梅梁湾湖水,作为室内模拟试验中上覆水水样,同时补充试验中水损耗,并于当地水产市场购买产自太湖的铜锈环棱螺。所有样品尽快运回实验室,途中注意避免对沉积物-水界面的扰动。
1.2 试验设计
模拟自然条件下铜锈环棱螺死亡分解。
1.2.1 试验模拟
将沉积柱敞口置于25℃、上覆水深45 cm的恒温水箱中培养,分3组,用于溶解氧(DO)、上覆水溶解态钨、沉积物间隙水HR-Peeper溶解态W/Fe(Ⅱ)/Mn以及沉积物间隙水DGT生物有效态钨的测量。铜锈环棱螺置于-20℃下冷冻致死。
第1组:将pH和DO的荧光膜贴在10 cm×10 cm×20 cm(长×宽×高)矩形有机玻璃容器的前玻璃内侧。选择1根沉积柱将其放入玻璃容器中,并在25℃恒温水箱中培养15 d,以消除扰动影响。然后,选取8只冷冻致死的铜锈环棱螺投入沉积柱,继续恒温培养36 d。
第2组:选取3根沉积柱,在沉积物-水界面处水平插入Rhizon装置至沉积柱中心,并于25℃恒温水箱中培养2 d进行预处理。预处理后,在每根沉积柱中分别加入8只冷冻致死的铜锈环棱螺,继续恒温培养36 d。
第3组:选取12根沉积柱,在25℃恒温水箱中培养2 d进行预处理。预处理后,选取其中9根沉积柱,每根沉积柱中分别加入8只冷冻致死的铜锈环棱螺,每3根为一组,分别恒温培养8 d、16 d和36 d。
培养过程中,每隔3~4 d用原湖水补充沉积柱中水的损耗。
1.2.2 样品采集频率
上覆水采集:使用土壤溶液采样器(Rhizon)装置,通过外管连接注射器主动抽提上覆水[26]。
间隙水采集:使用高分辨率平衡式间隙水采样(HR-Peeper)装置和薄膜扩散梯度(DGT)装置采集。①HR-Peeper装置:依据膜渗透平衡原理,即间隙水中溶解态待测样品与HR-Peeper装置小室中介质物质交换达到平衡(48 h)后,通过测定每个采样小室中溶剂的化学浓度,获得溶解态待测样品物质的质量浓度[27-28]。装置见图1(参考www.easysensor.net)。②DGT装置:依据费克第一扩散定律,利用固定膜液相之间形成的浓度梯度,对固定时间内穿过一定厚度扩散膜的元素进行计算而获得准确的元素有效态质量浓度值[29],分析24 h后固定膜累积吸附的样品量,即沉积物-水界面处可被吸附的物质[30]。DGT所测定的有效态质量浓度能很好地表征生物有效性[31-32],因此使用生物有效态定义DGT所测结果。采集频率设置如下。

图1 高分辨率平衡式间隙水采样(HR-Peeper)装置 Fig.1 High-resolution Peeper (HR-Peeper) device
第1组:恒温培养15 d后,用平面光极技术对沉积柱拍照,作为DO对照组;然后投入8只冷冻致死的铜锈环棱螺,在第2天、8天、16天和36天分别进行拍照,测界面处DO的二维分布,作为铜锈环棱螺检测组。
第2组:在预培养(无铜锈环棱螺)和加入铜锈环棱螺后每隔4 d,分别使用Rhizon装置抽取2 mL上覆水,用于溶解态钨的测定。
第3组:在预培养(无铜锈环棱螺)后选取剩余的3根沉积柱作为对照组,另外9根每3根为一组,分别作为铜锈环棱螺8 d、16 d和36 d检测组,恒温培养后在每根沉积柱中先垂直插入1根HR-Peeper装置,24 h后再投入1根ZrO-Chelex DGT装置,稳定平衡24 h后,将DGT装置和HR-Peeper装置同时拔出,收集间隙水。
1.2.3 样品分析
a.溶解态Fe(Ⅱ)。采取邻菲罗啉法,通过酶标仪(Epoh)测定。
b.钨和锰的测定。①上覆水金属测定:使用3%优级纯硝酸溶液(2.5 mL)稀释上覆水,用电感耦合等离子体质谱(ICP-MS)测定。②HR-Peeper装置样品测定:取出HR-Peeper装置后,迅速用半干的滤纸清理干净滤膜表面的沉积物,用移液枪吸取间隙水样品。③DGT装置样品测定:DGT装置回收后,用去离子水冲洗干净表面的沉积物,避免再次吸附。取出ZrO-Chelex膜,使用陶瓷排刀每隔2 mm将ZrO-Chelex膜切割为长条,并用800 μL浓度为1 mol/L的硝酸溶液浸泡条状膜16 h以上。④测定过程利用水系沉积物标准物质(GBW-07307a)、平行样和空白样进行质量控制,结果符合质控要求。
1.3 数据分析
生物有效态钨质量浓度计算:
ρDGT=MΔg/(DAt)
(1)
式中:ρDGT为扩散层线性梯度靠近环境介质一端的质量浓度,μg/L;M为固定膜中钨的累积量,μg;Δg为扩散层厚度,cm;D为扩散系数,cm2/s,钨的扩散系数为7.47×10-6cm2/s;A为条状膜面积,cm2;t为DGT装置放置时间,s。
2 结果与讨论
2.1 沉积物-水界面处DO二维剖面变化
平面光极技术不仅能够快速(20 s)获取二维空间的氧分布变化信息,避免微电极应用中电磁噪声干扰的问题,而且成本较微电极低廉,具有更好的灵活性和更高的二维时空分辨率[33],在沉积物溶解氧分布研究中运用更广。溶解氧(DO)二维剖面变化如图2所示。
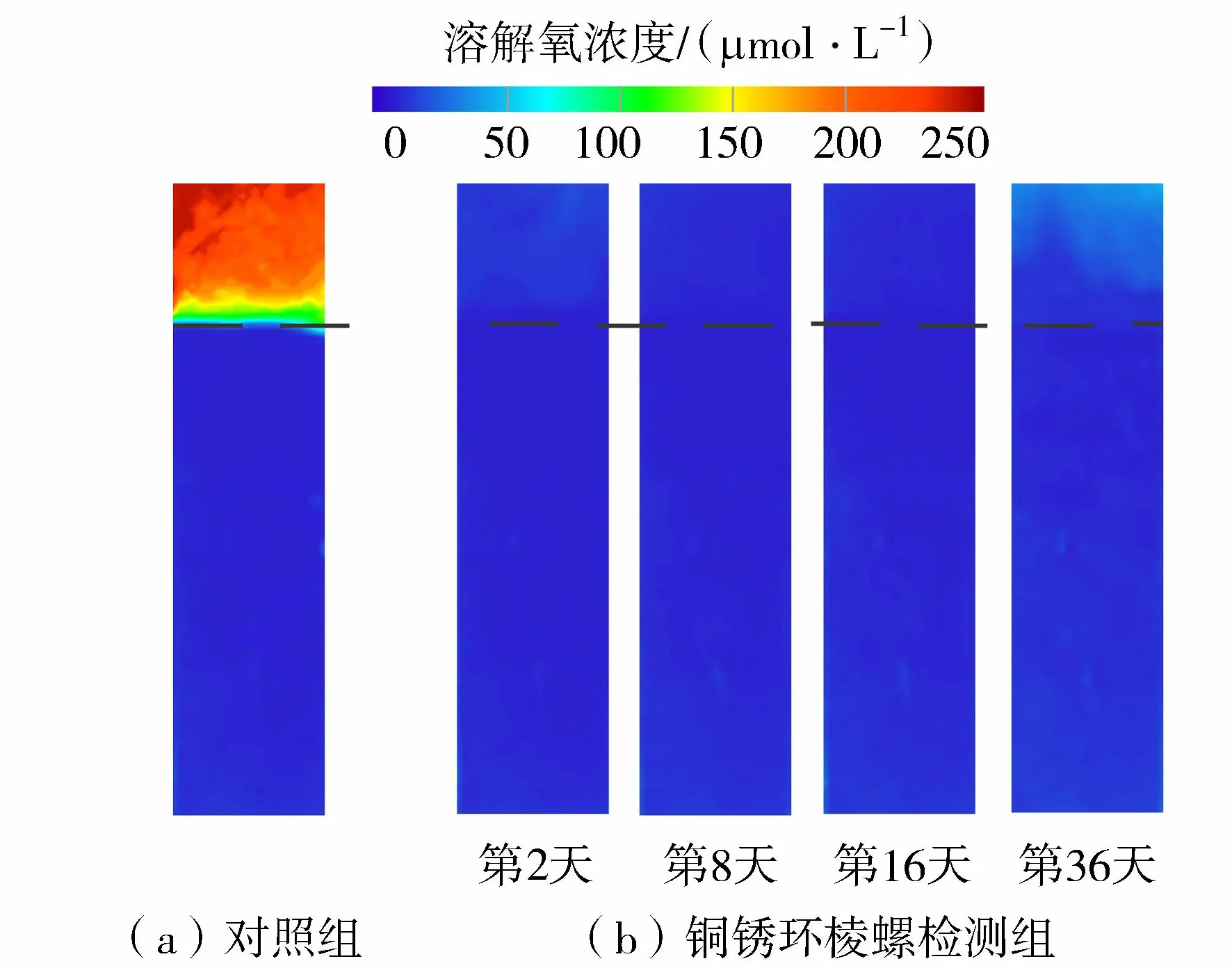
图2 分解过程中沉积物-水界面处DO二维分布Fig.2 Two-dimensional distribution of DO near sediment-water interface during decomposition
对照组:上覆水溶解氧浓度维持在200 μmol/L以上,在沉积物-水界面附近出现DO剧烈降低的现象,从150 μmol/L下降至50 μmol/L;沉积物中DO维持在较低浓度水平。
铜锈环棱螺检测组:铜锈环棱螺分解显著影响沉积物-水界面处DO的浓度。投入铜锈环棱螺后,上覆水DO浓度降至50 μmol/L以下,沉积物中DO浓度更低,整个培养体系处于缺氧状态。由于试验在“敞口”状态下进行,说明铜锈环棱螺分解消耗大量的DO[34],大气复氧速率低于微生物分解耗氧速率,引起DO浓度变化。
2.2 溶解态钨和生物有效态钨垂向分布
沉积物-水界面处溶解态钨和生物有效态钨质量浓度垂向分布如图3所示。
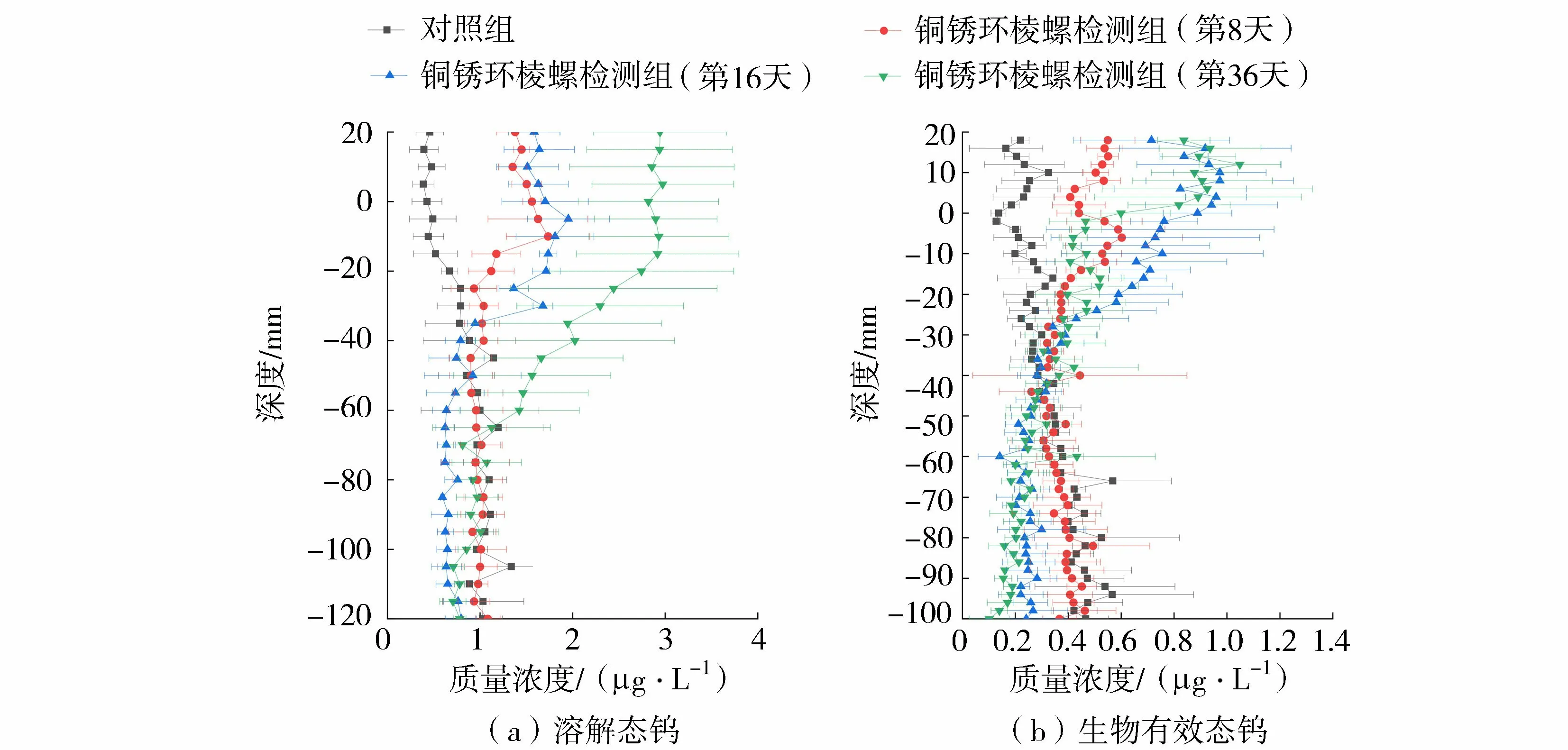
图3 沉积物间隙水溶解态钨和生物有效态钨质量溶度垂向分布Fig.3 Vertical distribution of dissolved W and labile W in sediment interstitial water profiles
2.2.1 溶解态钨
a.对照组:间隙水溶解态钨质量浓度在深度上呈现先增加后减少的变化趋势。上覆水溶解态钨质量浓度较低,而在沉积物-水界面处增加,于深度-105 mm(以沉积物-水界面为0,以上为正,以下为负)处达到峰值(1.34 μg/L);随后随深度增加钨质量浓度保持稳定或逐渐减小。
b.铜锈环棱螺检测组:加入铜锈环棱螺后上覆水溶解态钨质量浓度显著增加。在8~36 d溶解态钨质量浓度逐渐增加,与对照组相比较,上覆水中钨质量浓度出现了最高值,并保持至沉积物-水界面以下20 mm左右,然后质量浓度逐渐下降。该现象表明:铜锈环棱螺分解导致沉积物间隙水中的钨大量向水体释放。
2.2.2 生物有效态钨
与间隙水溶解态钨类似,铜锈环棱螺的分解造成生物有效态钨质量浓度增大。对照组中,钨质量浓度变化较明显,上覆水中钨质量浓度较低,在0.14 ~0.33 μg/L之间波动,在沉积物-水界面附近钨质量浓度随深度增加而增加,并在-66 mm附近达到峰值(0.57 μg/L)后逐渐下降。铜锈环棱螺加入的第8天,钨质量浓度有一个小幅度的增加,并在-6 mm附近达到峰值(0.60 μg/L)后逐渐下降至对照组浓度大小,影响深度为上覆水至沉积物-水界面下40 mm,上覆水钨质量浓度在0.41 ~0.55 μg/L之间波动。第16天和第36天,钨质量浓度继续增加。
2.3 溶解态钨和生物有效态钨平均质量浓度变化
沉积物剖面溶解态钨(深度20~-120 mm)和DGT生物有效态钨(深度20~-100 mm)平均质量浓度变化如图4所示。其中溶解态钨在对照组以及3个分解阶段剖面的平均质量浓度分别为0.83 μg/L、1.12 μg/L、1.07 μg/L和1.78 μg/L,分解第8天与16天与对照组钨平均质量浓度相比较分别增加了34.94%和28.92%,随后分解影响继续增加。在分解的第36天,溶解态钨质量浓度平均值增加114.46%;DGT生物有效态钨在对照组以及3个分解阶段剖面的质量浓度分别为0.33 μg/L、0.41 μg/L、0.45 μg/L和0.40 μg/L,随着铜锈环棱螺分解的进行,生物有效态钨平均质量浓度逐渐增加,在第16天达到最大,较对照组增加36.36%。随着分解的继续进行,生物有效态钨的平均质量浓度有所下降,但还是高于对照组,相比于对照组平均质量浓度增加了21.21%。
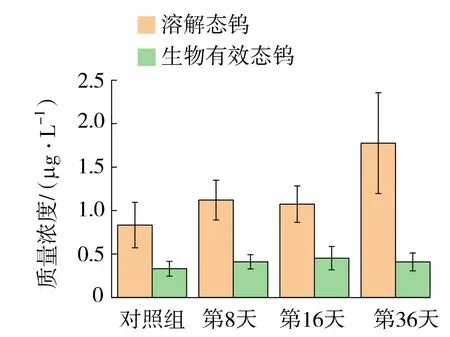
图4 沉积物剖面溶解态钨和生物有效态钨平均质量浓度Fig.4 Mean concentration of dissolved W and labile W in sediment profiles
2.4 上覆水溶解态钨质量浓度变化
铜锈环棱螺分解体系中上覆水溶解态钨质量浓度变化如图5所示。溶解态钨质量浓度随分解天数的增加而持续上升,初始质量浓度为0.049 μg/L,铜锈环棱螺加入后,溶解态钨质量浓度处于持续上升趋势,分解36 d时,达0.545 μg/L,表明上覆水溶解态钨质量浓度增加主要来自铜锈环棱螺的分解。
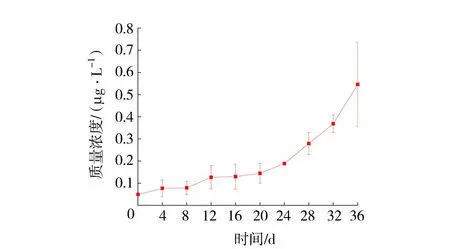
图5 铜锈环棱螺分解阶段上覆水溶解态钨质量浓度变化Fig.5 Mass concentration changes of dissolved W in overlying water at decomposition stage of Bellamya aeruginosa
2.5 溶解态Fe(Ⅱ)/ Mn平均质量浓度变化
a.对照组:沉积物间隙水中溶解态Fe(Ⅱ)和Mn的平均质量浓度分别为1.24 mg/L和2.15 mg/L。
b.铜锈环棱螺检测组:铜锈环棱螺的分解显著增加了间隙水中溶解态Fe(Ⅱ)和Mn的平均质量浓度(图6),在分解第8天、16天和36天后间隙水溶解态Fe(Ⅱ)和Mn的平均质量浓度分别增加至11.12 mg/L、8.53 mg/L、5.13 mg/L和11.50 mg/L、8.06 mg/L、5.07 mg/L。与对照组相比,溶解态Fe(Ⅱ)和Mn的平均质量浓度分别增加了796.77%、587.90%、313.71%和434.88%、274.88%、135.81%。在分解第36天后与第8天相比,溶解态Fe(Ⅱ)和Mn的平均质量浓度虽有所降低,但是仍然显著高于对照组。

图6 沉积物剖面溶解态 Fe(Ⅱ)/ Mn平均质量浓度Fig.6 Mean mass concentration of dissolved Fe(II)/Mn in sediment profiles
由溶解态钨和溶解态 Fe(Ⅱ)/ Mn的Person相关分析显示(表1),溶解态钨和溶解态 Fe(Ⅱ)/ Mn在对照组及分解的第一个阶段中均呈显著正相关(R2≥0.588,p<0.01)。随着分解的继续进行,溶解态钨和溶解态Fe(Ⅱ)的相关性由正相关(R2≥0.371,p<0.05)变为负相关;溶解态钨和溶解态Mn不成相关性。
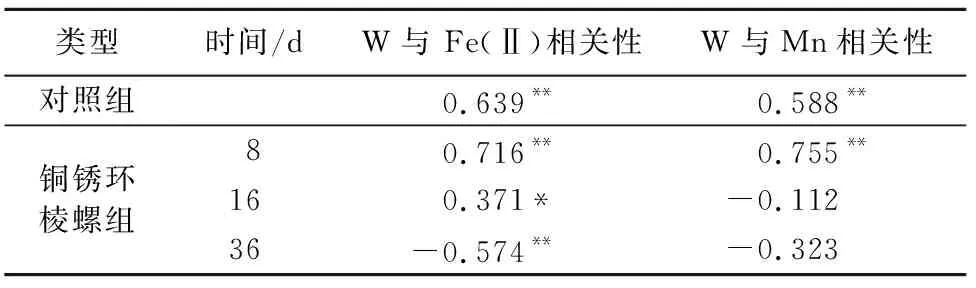
表1 沉积物剖面溶解态钨和溶解态 Fe(Ⅱ)/ Mn的Person相关分析
2.6 铜锈环棱螺分解对沉积物中钨迁移的影响特征
水体中DO的变化会影响沉积物中重金属的分布和释放[35]。对比对照组DO、钨和Fe(Ⅱ)/Mn的变化发现,上覆水DO浓度较高时,W和Fe(Ⅱ)/Mn却保持较低水平(见图2、图4和图6),这是由于沉积物表层形成铁锰氧化物,吸附微量金属并阻止深层金属向上覆水扩散[36]。底栖动物的分解消耗了沉积物-水界面附近大量的DO[37],使得沉积物-水界面厌氧,沉积物中的铁锰氧化物发生还原分解进入间隙水中,与对照组相比溶解态铁锰平均质量浓度显著增加(图6),这与汤亚洲等[22]的研究结果一致。该研究发现,环境处于厌氧状态时,溶解态锰质量浓度平均值与对照组相比增加了38%~67%。王永平等[38]发现在厌氧状态下铁锰氧化物发生还原反应,铁锰能从沉积物中再释放出来。与对照组相比,第8天沉积物剖面溶解态/生物有效态钨的平均质量浓度分别增长了34.94%和24.24%(图4),同时W与Fe(Ⅱ)/Mn表现出高度的一致性(R2≥0.716,p<0.01),表明铜锈环棱螺分解过程前期沉积物中钨的释放主要受铁锰的氧化还原控制。钨与铁锰氧化物的氧化还原反应是沉积物中钨释放的重要控制机制。当环境处于厌氧状态时,W随着FeOOH和MnOOH的溶解而释放进入间隙水[19]。
随着分解时间的延长,溶解态钨和生物有效态钨质量浓度持续增加(图4)。李志良等[39-40]研究发现,铜锈环棱螺具有较高的重金属富集能力,且邓佑锋等[41-43]发现铜锈环棱螺体内所富集的重金属在分解时可以被重新释放,引起上覆水重金属浓度迅速增加。因此,分解后期(第16天和第36天)界面处溶解态钨和生物有效态钨质量浓度持续增加是由铜锈环棱螺体内所累积的钨释放所致。
3 结 论
a.水体中DO的变化会影响沉积物中重金属的分布和释放。铜锈环棱螺的分解增加了湖泊中钨的释放风险。铜锈环棱螺分解前期(第8天),沉积物中钨的释放主要受到铁锰的氧化还原控制。铜锈环棱螺的分解过快消耗了沉积物-水界面附近的溶解氧,使沉积物-水界面处于厌氧环境,W随着FeOOH和MnOOH的溶解而释放进入间隙水中。
b.随着铜锈环棱螺分解进入后期(第16天和第36天),沉积物-水界面处溶解态钨和生物有效态钨质量浓度持续增加,这是由于铜锈环棱螺具有较高的重金属富集能力,且富集的重金属在分解时可以被重新释放,此时铜锈环棱螺体内累积的钨的释放是造成钨质量浓度增加的另外一个原因。

