基于图论的2 型糖尿病患者局部效率及节点局部效率变化分析
杜伟,刘杨颖秋,姜健,李琬瑶,蒋玉涵,苗延巍,王微微
随着老龄化、城市化的快速增长,2型糖尿病(type 2 diabetes mellitus,T2DM)的全球患病率逐年增加[1],糖尿病及其并发症对个人及其家庭、卫生系统和国民经济具有重大影响。因此,全面了解T2DM患者的健康状况,探索T2DM的病理生理机制,对于疾病的防控具有重要意义。糖尿病并发症多,几乎全身所有的组织及器官均可受累。其中,中枢神经系统改变,即糖尿病脑病(diabetic encephalopathy,DE),是T2DM常见的并发症之一,认知障碍是其最常见的表现[2]。然而T2DM合并DE的早期临床表现往往不典型,其进展是一个隐匿的慢性过程,目前缺少明确的影像学指标作为DE诊断和病情评估的标志。
随着MRI技术的不断发展,多种功能MRI及后处理技术广泛应用于中枢神经系统的研究疾病。基于血氧水平依赖(blood oxygenation level dependent,BOLD)的静息态功能磁共振成像(resting-state functional MRI,rs-fMRI),能够通过检测静息状态下血氧水平的波动来反映自发性的神经活动,近年来利用rs-fMRI技术来阐述T2DM功能变化为其病理生理学机制的研究提供新的思路。图论分析是近些年新兴的复杂脑网络分析技术,是以预设的脑区模板定义为网络的节点,不同脑区在时间序列上的相关性定义为功能连接,从而构建大脑的功能网络进行分析。多项研究表明,人脑本质上是高度模块化的小世界网络架构,能够以低布线成本进行有效地传输信息,并形成高度连接的枢纽区域。功能分离和整合是小世界网络两个主要的组织原则。人脑的小世界网络可以很好地在局部专业化和大脑功能连接的全局整合之间取得平衡[3]。先前研究发现,T2DM 患者相较健康对照(healthy controls,HC)组平均路径长度(average path length,Lp)值增加,局部效率(local efficiency,Eloc)值降低[4];左侧中央沟、左侧岛叶、双侧豆状核和右侧颞下回节点局部效率增加[5];此外还有研究发现T2DM组的Eloc、γ、σ值升高[6]。然而T2DM小世界网络的研究仍相对较少,各研究之间存在不一致的结果,也缺乏临床影响因素和认知状态关联性研究。本研究采用基于图论分析的方法分析大脑功能网络的小世界网络属性改变及大脑网络拓扑属性的改变,并进一步分析其与临床、认知评分的相关性,探究T2DM认知能力下降的神经机制。
1 资料与方法
1.1 一般资料
本研究前瞻性纳入31 例2019 年1 月至2019 年12 月期间于大连医科大学附属第一医院内分泌科诊断为T2DM 的患者(T2DM 组,男17 名,女14 名),并招募22名健康志愿者(HC组,男8名,女14名)。T2DM组的纳入标准包括:(1)符合2014 年美国糖尿病协会建议的T2DM 诊断标准[7]:空腹血糖≥7.0 mmol/L (126 mg/dl)或糖化血红蛋白≥6.5% 或2 h 葡萄糖耐量试验(OGTT)≥11.1 mmol/L (200 mg/dl)或具有典型的高血糖症状或高血糖危象,随机血糖≥11.1 mmol/L(200 mg/dl);(2)右利手;(3)年龄范围40~75 岁。排除标准:(1)其他类型的糖尿病;(2)严重的内科急症,如中、重度贫血,心脏、肝脏、肺、肾功能衰竭,严重的电解质紊乱等;(3)慢性中枢神经系统疾病史,如帕金森病、痴呆、癫痫等;(4)精神心理疾病病史;家族精神疾病病史;头部外伤及手术史;药物滥用及成瘾史;(5)当前或既往重大躯体疾病史,如脑出血、大面积脑梗死、颅内感染、化学或药物中毒性脑病、恶性肿瘤等;(6)自身免疫性疾病及其他式的内分泌疾病史;(7)磁共振检查禁忌证。HC 组纳入标准:既往体健,无糖尿病,其余同T2DM 组纳入标准2~3项。排除标准:同T2DM组2~7项。
分别记录所有被试的姓名、年龄、受教育年限等社会人口学信息。临床检查资料包括血脂、胆固醇、同型半胱氨酸、空腹血糖、糖化血红蛋白、体质量指数(body mass index,BMI)和腰臀比(waist hip rate,WHR)。在MRI扫描之前,所有被试由受过专科培训的神经内科医生进行一系列神经心理学测试,使用简明精神状态量表(Mini-Mental State Examination,MMSE)、蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA;原版v7.1)评定认知状态;对T2DM早期较易受损的记忆及执行两个认知领域,采用加利福尼亚词语学习测验和符号数字模式转换(Symbol-Digital Mode Test,SDMT)进行评价。本研究经大连医科大学附属第一医院医学伦理委员会批准(伦理批件号:PJ-KS-KY-2018-140),所有被试均签署知情同意书。
1.2 仪器与方法
应用Philips Ingenia CX 3.0 T 磁共振扫描仪(Philips Healthcare, Best,荷兰)及32 通道正交头部线圈对所有被试进行扫描。在MRI 数据采集过程中,所有被试均被要求闭眼,放松思想(但不要入睡),不做任何定性思考。
rs-fMRI使用梯度回波序列获取,扫描参数为:重复时间(repetition time,TR):2000 ms;回波时间(echo time,TE):30 ms;翻转角(flip angle,FA):90°;矩阵:80×80;视野(field of view,FOV):240 mm×240 mm;层厚:4 mm;层间距:1 mm。结构像采用矢状位3D T1多次激发快速场回波序列序列,成像范围覆盖全脑。具体参数为:TR:6.6 ms;TE:3.0 ms;反转时间:2800 ms;FA:12°;FOV:256 mm×256 mm;矩阵:256×256;层厚:1.0 mm;层间距:0 mm;体素大小:1.0 mm×1.0 mm×1.0 mm。自左向右采集188 层。另外获取常规序列如T1WI、T2WI 及液体衰减反转恢复序列等用于诊断和除外脑部其他病变。
1.3 MRI数据后处理
rs-fMRI 图像数据利用GRETNA (https://www.nitrc.org/projects/gretna/)软件进行预处理、功能网络的构建及分析。
1.3.1 图像预处理
图像预处理步骤包括:(1) DICOM 格式转换为NIFTI 格式;(2)去除最初5 个时间点的图像,降低机器磁化不稳定所导致的误差;(3)时间校正;(4)头动校正,头动位移>2 mm或转动角度大于2的被试予以剔除;利用Scrubing,剔除帧位移量阈值>0.5 的前1 个时间点和后2 个时间点,来控制微小头动;(5)将所有被试的rs-fMRI 图像标准化到MNI 空间,并重新采样为3 mm×3 mm×3 mm大小的各向同性体素;(6)回归协变量,包括头动参数、脑脊液信号、白质信号等;(7)采用线性漂移和带通滤波(0.01~0.08 Hz)消除时间序列中的低频漂移和干扰信号。
1.3.2 功能网络构建和网络分析
利用解剖学自动标记模板90 构建全脑功能网络。将全脑分割成90 个脑区,每个脑区定义为一个节点,把每个脑区内所有体素的时间序列进行加权平均后得到90个脑区的平均时间序列。之后通过计算每个被试两两脑区平均时间序列之间的Pearson相关系数,得到一个90×90相关性矩阵,即为该被试的全脑功能连接矩阵。
在GRETNA软件中计算小世界网络属性及大脑网络拓扑属性。设定0.05~0.50为稀疏度取值,步长设置为0.01,以保证:(1)两组被试功能网络所有节点处于全连接状态,即网络没有断点;(2)小世界属性可估计的最大相关值[8]。之后与500个预先设定好的随机网络做对比,得到该大脑网络属性的具体参数值,包括σ、λ、γ、聚类系数(clustering coefficient,Cp)、Lp、全局效率(global efficiency,Eg)、Eloc及节点局部效率。
1.4 统计学分析
使用SPSS 26.0 软件对两组之间的人口学资料和临床数据进行统计,计量资料组间比较采用独立样本t检验或非参数检验,计数资料采用χ²检验,均为双尾检验。使用GRETNA软件对磁共振功能指标统计,采用两个独立样本t检验,来评估两组之间的小世界网络属性、网络拓扑属性及节点局部效率的差异,并将节点局部效率结果进行Bonferroni校正,以校正后P<0.05为差异有统计学意义。应用Pearson相关性分析探索σ、λ、γ、Cp、Lp、Eg 和Eloc 结果指标与人口学资料、实验室指标及神经心理量表评分的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 人口学及临床资料特征
本研究剔除了头动过大的2例T2DM被试和2例HC被试,最终纳入T2DM组29例,HC组20例。两组被试的年龄、性别、教育程度、BMI等差异均无统计学意义(P>0.05)。T2DM 组的WHR 高于HC 组,MMSE、MoCA、SDMT 评分低于HC 组,差异具有统计学意义(P<0.05) (表1)。其中T2DM 组MoCA 评分低于26 分的被试有17 人,HC组有4人。

表1 T2DM组与HC组人口学资料、实验室指标及神经心理量表评分比较Tab.1 Comparison of demographic data,laboratory parameters and neuropsychological scale scores between T2DM and HC
2.2 T2DM组与HC组的小世界网络属性差异
在稀疏度0.05~0.50 范围内,分别计算两组每个稀疏度下σ、λ、γ、Cp、Lp、Eg和Eloc属性值,及所有稀疏度的曲线下面积(area under the curve,AUC)。T2DM 组与HC 组的小世界属性参数均符合γ>1,λ≈1,σ=γ/λ>1 的标准,提示两组所有被试的大脑功能网络均具有小世界属性。结果显示两组间σ、λ、γ 的每个稀疏度下属性值及所有稀疏度的AUC 值差异无统计学意义(P>0.05) (图1、表2)。
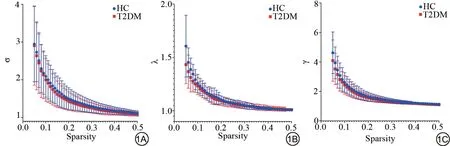
图1 两组被试的小世界网络属性随稀疏度(Sparsity)的变化,误差线表示平均值及标准差。1A、1B、1C 显示两组间σ、λ、γ在每个稀疏度下属性值差异无统计学意义(P>0.05)。Fig. 1Changes of small-world network properties with sparsity in the two groups of subjects, the error bars represent the mean and standard deviation. 1A, 1B, and 1C show that the attribute values under each sparsity of σ, λ, γ between the two groups are not statistically significant(P>0.05).

表2 T2DM组与HC组的小世界属性各参数AUC值比较Tab.2 Comparison of AUC values of small-world properties between T2DM and HC
在稀疏度0.05~0.50范围内,T2DM组的大脑网络与HC 组相比Eloc AUC 值显著降低(P<0.05) (表3)。在0.30、0.34、0.36、0.40稀疏度下,T2DM组的大脑网络与HC 组相比Eloc 属性显著降低(P<0.05) (图2、表3),提示T2DM被试受损的功能网络。

表3 T2DM组与HC组的Cp、Lp、Eg和Eloc属性AUC值比较Tab.3 Comparison of AUC values of Cp,Lp,Eg and Eloc between T2DM and HC

图2 两组被试的网络拓扑属性随稀疏度(Sparsity)的变化,误差线表示平均值及标准差。2A、2B、2C 显示T2DM 组的大脑网络与HC 组间Eg、Cp、Lp在每个稀疏度下属性值差异均无统计学意义(P>0.05)。2D:在0.30、0.34、0.36、0.40稀疏度下T2MD组较HC组Eloc属性显著降低(P<0.05),*表示差异有统计学意义。Cp:聚类系数;Lp:平均路径长度;Eg:全局效率、Eloc:局部效率。Fig. 2 Changes of network topology properties with sparsity in the two groups of subjects. The error bars represent the mean and standard deviation. 2A, 2B and 2C showe that Eg, Cp and Lp attribute values at each sparsity between the two groups are not statistical significance (P>0.05). 2D shows that at 0.30, 0.34, 0.36,0.40 sparsity,the Eloc properties of brain network in the T2DM group are significantly lower compared to the HC group(P<0.05),*indicates that the difference is statistically significant.Cp:clustering coefficient; Lp:average path length;Eg:global efficiency;Eloc:local efficiency.
2.3 T2DM组与HC组的节点局部效率差异
与HC组相比,T2DM组的右侧岛盖部额下回、右侧嗅皮质、右侧缘上回、左侧颞中回脑区的节点局部效率显著降低;T2DM 组的左侧眶部额上回、左侧眶部额中回、右侧眶内额上回、左侧楔叶脑区的节点局部效率显著升高(表4、图3)。

图3 T2DM 患者大脑功能性连接伪彩图。与HC 组相比,T2DM 组的右侧岛盖部额下回、右侧嗅皮质、右侧缘上回、左侧颞中回脑区的节点局部效率显著降低(蓝色球体);左侧眶部额上回、左侧眶部额中回、右侧眶内额上回、左侧楔叶脑区的节点局部效率显著升高(红色球体)。T2DM:2型糖尿病;HC:健康对照。Fig. 3 Pcolor diagram of T2DM brain functional connectivity. T2DM group presented significant decreases of integrated nodal efficiency in the right opercular part of inferior frontal gyrus,olfactory cortex,supramarginal gyrus, and left middle temporal gyrus (blue sphere), and showed increases in the left orbital part of superior and middle frontal gyrus, the right medial orbital of superior frontal gyrus, and the left cuneus (red sphere), compared to the HC group.T2DM:type 2 diabetes mellitus;HC:healthy controls.

表4 T2DM组与HC组的节点局部效率有差异的脑区Tab.4 Brain regions with differences in nodal local efficiency between T2DM and HC
2.4 相关性分析
在性别、年龄、受教育程度组间差异无统计学意义前提下,Pearson相关分析显示T2DM组的Lp AUC值与SDMT 评分呈正相关(r=0.38,P=0.04);σ AUC 值(r=-0.45,P=0.02)、γ AUC值(r=-0.40,P=0.03)与SDMT评分呈负相关;λ AUC 值与SDMT 评分(r=0.45,P=0.01)呈正相关,与MoCA评分(r=0.45,P=0.02)呈正相关(图4)。此外,Cp AUC 值与同型半胱氨酸(r=0.39,P=0.04)呈正相关,与血红蛋白(r=0.46,P=0.01)呈正相关。Eg 和Eloc 值与其余人口学资料、临床化验指标未见明显相关性。

图4 组间差异具有统计学意义的结果指标与人口学资料、实验室指标及神经心理量表评分的热点图,*差异有统计学意义。BMI:体质量指数;MMSE:简明精神状态量表;MoCA:蒙特利尔认知评估量表;SDMT:符号数字模式测验;CVLT:加利福尼亚词语学习测验。Fig. 4 Heat map of statistically significant between-group differences in outcome measures with demographic data, laboratory parameters and neuropsychological scale scores, *indicates statistically significant differences. BMI: body mass index; MMSE: Mini-Mental State Examination; MoCA: The Montreal Cognitive Assessment; SDMT:Symbol-digital mode test;CVLT:California verbal learning test.
3 讨论
本研究采用基于图论分析的方法分析大脑功能网络的小世界网络属性改变及大脑网络拓扑属性的改变。本研究发现在稀疏度0.05~0.50 范围内,两组被试均存在经济的小世界网络;在稀疏度0.05~0.50 范围内,T2DM 组的大脑网络与HC 组相比,Eloc AUC值显著降低;在0.30、0.34、0.36、0.40稀疏度下,T2DM 组的大脑网络与HC 组相比,Eloc 属性显著降低;此外,T2DM 组的右侧岛盖部额下回、右侧嗅皮质、右侧缘上回、左侧颞中回脑区的节点局部效率显著降低,左侧眶部额上回、左侧眶部额中回、右侧眶内额上回、左侧楔叶脑区的节点局部效率显著升高。
大脑是一个具有不同功能区域的分离的复杂系统,用于处理不同的信息。相互连接的大脑区域之间的信息交换被认为是人类认知过程的生物学基础。Watts 和Strogatz 于1998 年提出小世界网络模型[8]。小世界网络是一种经济的网络模型,兼具有较高Cp 及较短Lp 的特点,保证了在局部及全局水平上信息传递与处理的高效性。Cp 反映大脑网络节点的聚集程度,平均路径长度反映不同脑区之间信息传递的高效性。本研究提示T2DM 及HC 组所有被试均具有小世界网络特性,与先前的报道一致[6,9]。本研究两组间σ、λ、γ 的每个稀疏度下属性值及所有稀疏度的AUC 值虽无统计学意义,但T2DM 组相应指标值均低于HC 组,提示可能T2DM 的小世界网络属性尚未严重受损,与先前报道一致[4-5,10]。此外也有研究[4,6,11-12]发现T2DM 患者的小世界网络属性及网络拓扑属性较健康组有不同程度的改变,和本研究结果不一致。本研究发现在0.30、0.34、0.36、0.40 稀疏度下,T2DM 组的大脑网络与HC 组相比Eloc 属性显著降低,提示T2DM 患者大脑中的信息传递效率降低。Eloc 主要与相邻区域之间的短距离连接有关,这些区域之间的中介作用是信息处理和网络的容错能力。值得注意的是,T2DM 组的大脑网络与HC 组相比Cp、Lp、Eg 属性并无明显变化,与其他研究不同[13],提示可能T2DM 的网络拓扑属性受损较轻。此外,本研究发现Cp AUC值与同型半胱氨酸及血红蛋白呈正相关,有研究表明同型半胱氨酸可能在T2DM 患者认知障碍的发病机制中起重要作用[14],提示代谢异常及血红蛋白指标异常和大脑网络的改变有关。
大脑的节点局部效率反映一个节点与其他节点之间的连接程度,代表该节点的通讯效率[13]。本研究发现与HC组相比,T2DM组的右侧岛盖部额下回、右侧嗅皮质、右侧缘上回、左侧颞中回脑区的节点局部效率显著降低。岛盖部额下回在大脑中具有许多重要功能,其中包括语义处理、语言生成和语音处理等,本研究中岛盖部额下回节点局部效率降低,与先前的报道一致[15-16]。有研究观察到T2DM 患者的右侧缘上回及颞中回脑血流量减低和灰质体积萎缩[17],结合本研究发现右侧缘上回、左侧颞中回脑区的节点局部效率降低,表明这些脑区在T2DM 的病理生理机制中扮演重要角色。目前大量研究表明,阿尔茨海默病(Alzheimer's disease,AD)患者的嗅皮质厚度降低和淀粉样蛋白积累增加与嗅觉障碍几率的增加显著相关,嗅觉功能障碍被认为是神经变性的早期预测因素,并且与晚年认知障碍有关[18-21]。而脑淀粉样蛋白聚集和tau 蛋白过度磷酸化,可能是T2DM 和AD 共病的发病机制之一[22]。本研究中T2DM 患者右侧嗅皮质节点局部效率降低,与先前的研究一致[23]。这对于早期发现T2DM患者潜在的认知能力下降和痴呆具有重要意义。
此外本研究发现T2DM 组的左侧眶部额上回、左侧眶部额中回、右侧眶内额上回、左侧楔叶脑区的节点局部效率显著升高。额上回及额中回参与情绪相关的大脑活动,易受血糖波动的影响[24]。有文献表明,与HC组相比,T2DM患者眶内额上回的局部一致性(regional homogeneity,ReHo)值降低,左侧额中回的各向异性分数值降低,平均扩散率升高[25-26],该脑区的ReHo 值和白质结构的改变可能与T2DM 患者的消极情绪状态有关。楔叶参与人脑的抑制性控制机制,即通过使用注意力和推理来抑制或控制冲动反应的能力。尽管在注意力缺陷和多动障碍患者中最为常见,但在T2DM 中也观察到抑制性控制的功能障碍。因此,楔叶可能与认知缺陷有关[27-28]。有研究表明T2DM 患者楔叶的灰质体积明显减少[29],ReHo 值减低[30],右侧小脑后叶与右侧楔叶的功能连接明显减低[31]。本研究中发现额上回、额中回及楔叶多个脑区的节点局部效率升高,与先前的研究不一致,推测T2DM患者大脑可能存在对认知功能受损的补偿机制。
本研究中T2DM 组的MMSE、MoCA、SDMT 评分低于HC 组,提示T2DM 患者总体认知状态和相应认知域的认知功能降低。此外T2DM患者WHR高于HC组,WHR是反映人体脂肪分布的重要指标,数值升高提示中心性肥胖,提示T2DM 患者腹部肥胖现象较为普遍。相关性分析结果显示σ AUC值、γ AUC值与SDMT评分呈负相关;λ AUC值与SDMT评分呈正相关,与MoCA评分呈正相关,提示T2DM 患者的认知水平可能会影响小世界属性。但本研究并未发现T2DM 组和HC 组的σ、γ、λ AUC 值有显著差异,推测可能与样本量小有关,有待进一步的研究。
本研究尚有一些局限性。第一,纳入的T2DM 组患者的样本量较小,可能会影响结果的可重复性。第二,本研究未对T2DM 患者按照认知障碍的亚型进一步分层,如合并认知障碍、抑郁或嗅觉障碍等,仅对T2DM患者整体进行研究。有研究发现伴有轻度认知障碍的T2DM 患者枕回和颞下回的ReHo 值显著降低,而在不伴有轻度认知障碍的T2DM 患者并未发现这些改变[12]。招募更多的T2DM 志愿者并按认知状态进行区分可能会在未来的研究中解决此问题。第三,本研究未考虑T2DM患者的病程、治疗用药及用药后反应的影响,且对照组中亦存在个别MoCA 评分低于26 分的被试,之后会进行更细致的研究以排除上述混杂因素。第四,本研究在预处理中使用带通滤波(0.01~0.08 Hz)过滤了rs-fMRI 数据,并使用平均时间序列进行了线性回归。在之后的研究中应在rs-fMRI 采集过程中测量生理信号,并对生理噪声进行校正。第五,尽管本研究发现T2DM 患者的数个脑区节点局部效率的显著降低,但部分脑区具体参与的机制仍不清楚,难以提供这些脑区变化的准确解释。在今后的研究中,我们将继续完善相关内容。
综上所述,我们对功能性大脑网络的图论研究表明,T2DM 组及HC 组的大脑网络均表现出经济的小世界属性。T2DM 会导致局部信息传递效率降低,且与认知功能、同型半胱氨酸和血红蛋白存在相关性。T2DM 患者右侧岛盖部额下回、右侧嗅皮质、右侧缘上回、左侧颞中回脑区的节点局部效率显著降低,左侧眶部额上回、左侧眶部额中回、右侧眶内额上回、左侧楔叶脑区的节点局部效率显著升高,提示T2DM 患者大脑中存在认知、记忆、情感和情绪等脑功能活动异常,也存在减轻脑功能损害的代偿机制,为DE的研究提供了新的视角,对T2DM 大脑网络改变机制进一步探索提供了线索。
作者利益冲突声明:全部作者均声明无利益冲突。