TNF-α对三种牙源性干细胞增殖分化能力影响的比较研究
赵 琦 齐 霞 李 雅 鲁晓琪 李淑娟
牙周炎是累及牙周支持组织的破坏性疾病,通常伴有牙槽骨吸收,目前修复缺失软硬组织的有效方法是牙周组织再生,而选取合适的种子细胞是实现再生的关键。牙源性干细胞取材方便、来源普遍,体外增殖能力强,免疫原性低,无致瘤反应[1~3]。其中,牙龈干细胞(gingival mesenchymal stem cells,GMSCs)、牙髓干 细胞(dental pulp stem cells,DPSCs)和牙周膜干细胞(periodontal ligament stem cells,PDLSCs)已被证实在特定的诱导环境下可分化成骨细胞、成软骨细胞、成脂细胞等[4],诸多特性使得它们在牙周组织再生研究中受到广泛关注,但关于三者特性的比较鲜有报道。
牙周炎最主要的临床表现是牙槽骨吸收,在骨吸收过程中炎性介质起重要作用。肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)是一种具有先导性、多向性的炎症因子,其主要由巨噬细胞分泌释放,被认为是牙槽骨吸收过程中典型炎症因子之一[5,6]。有研究表明,牙周炎患者体内的TNF-α 含量明显高于牙周健康者,而调节患者龈沟液内TNF-α水平,可促进牙周状态的修复[7],证实TNF-α 与牙周炎发病及疾病进展密切相关。
因此,本实验在体外分离培养同一供体来源的人牙龈干细胞(human gingival mesenchymal stem cells,hGMSCs)、人牙髓干细胞(human dental pulp stem cells,hDPSCs) 和人牙周膜干细胞(human periodontal ligament stem cells,hPDLSCs),对三种干细胞的增殖、成骨及成脂能力进行综合对比,并探究特定浓度的TNF-α 对三种干细胞性能的影响,从而为牙周组织再生中种子细胞的选取和优化提供理论依据。
资料和方法
1.标本来源
本实验获得河北医科大学口腔医院医学伦理委员会批准(批号:2019-036),收集河北医科大学口腔医院患者年龄在18 岁到25 岁之间因正畸或阻生等原因拔除的健康第三磨牙及阻生齿拔除术中切取的少量废弃牙龈组织,患者知情同意。所有收集的牙齿保证牙体完整,无龋坏、牙髓炎、根尖周炎、牙周炎等疾病,牙龈组织正常无炎症。牙齿及牙龈收集过程中保证无菌操作,标本离体后迅速置于样本收集液中,并迅速运至实验室进行后续操作。
2.主要试剂及仪器
胎牛血清(FBS,美国Gibco 公司);DMEM 培养基、青霉素/链霉素、胰蛋白酶(美国Hyclone 公司);TNF-α、细胞活性检测试剂盒(CCK-8)、茜素红S 染色液(0.2%)、油红O 染色液(细胞专用)、碱性磷酸酶染色试剂盒(北京索莱宝公司);成骨诱导分化试剂盒、成脂诱导分化试剂盒(广州赛业公司);碱性磷酸酶检测试剂盒、BCA 蛋白浓度试剂盒(碧云天生物技术公司);恒温CO2细胞培养箱(美国NUNR 公司);台式冷冻高速离心机(德国EPPENDORF 公司);Bio-tek 酶标仪(美国伯腾仪器有限公司);倒置相差显微镜(日本OLYMPUS 公司)。
3.hGMSCs、hDPSCs 和hPDLSCs 的分离培养与诱导分化
在超净工作台下分离牙龈组织、牙髓组织及牙周膜组织(为了避免供体不同导致的差异性,选择同一供体来源的牙齿),用PBS 冲洗2~3次,将其剪至1.0 mm3;将组织块贴于25 cm2的培养瓶底部,瓶内添加含10%FBS、2%青霉素/链霉素的DMEM 培养基,于37℃、5% CO2的细胞培养箱中静置培养,每2~3 d 换液一次,期间在显微镜下观察细胞状况。细胞生长80%后,用0.25%胰酶消化传代,并接种到6孔板中,分别加入正常和含10 ng/mL TNF-α 的成骨、成脂诱导液连续培养21 d。
4.检测指标
表面标记物检测:取第3 代的hGMSCs、hDPSCs和hPDLSCs 用胰酶消化,置于分别加入适量FITC标记的CD29、CD34、CD45、CD105 抗体EP 管中,避光孵育20min 后上流式细胞仪检测干细胞表面标记物。CCK-8 法检测细胞增殖情况:同时将第3 代细胞接种于96 孔板(2.5×103个/孔),待细胞贴壁后分别加入正常和含10 ng/mL TNF-α 的DMEM 培养基,放入培养箱培养0 h、24 h、48 h、72 h、96 h、120 h、168 h,PBS 冲洗后加10 μL CCK-8 检测液,避光孵育3 h,酶标仪测定450 nm 波长下的吸光度。成骨分化情况:成骨诱导液培养7 天后进行ALP 染色,ALP 检测试剂盒和BCA 蛋白浓度试剂盒检测ALP 活性;21 天后进行茜素红染色,弃原液,多聚甲醛固定10 min,吸干加入茜素红S 染色液20 min,加蒸馏水镜检(每个步骤之间均用PBS 冲洗3次)。成脂分化情况:成脂诱导液培养21 天后进行油红O 染色,弃原液,加入ORO 固定20 min,60%异丙醇浸洗5 min,吸去后加ORO 染色液15 min,Mayer 苏木素染色液复染2 min,加入ORO 缓冲液1 min,弃去后加入PBS 镜检(每步之间用PBS 冲洗3次)。然后用异丙醇将脂滴溶解,检测酶标仪下波长520 nm 时的吸光度,检测脂滴形成量。
5.统计学处理
采用SPSS 21.0 统计软件分析,计量资料采用均数标准差(χ±s)表示,单因素方差分析用于组间比较;如方差齐,运用Bonferroni’s检验,如方差不齐,则运用Tamhane’s T2检验,P<0.05 时,差异具有统计学意义。
结 果
1.hGMSCs、hDPSCs 和hPDLSCs 的分离培养
三种干细胞在正常和10 ng/mL TNF-α 条件下均能贴壁生长,显微镜下形态为多角形或长梭形,两组细胞形态类似,无明显差异(图1)。
图1 正常和TNF-α 条件下三种干细胞的形态( ×200)
2.hGMSCs、hDPSCs 和hPDLSCs 表面标记物的鉴定
流式细胞仪检测结果,三种干细胞的间充质干细胞特异性表面标志物均表达为阳性,造血干细胞表面标志物表达为阴性(图2、表1)。
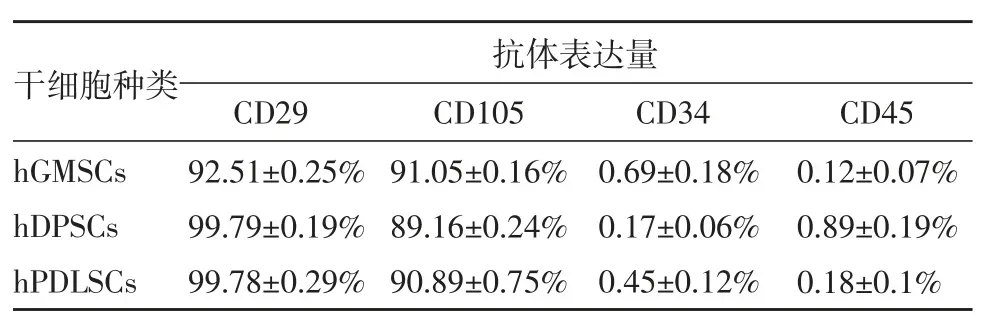
表1 hGMSCs、hDPSCs、hPDLSCs 的抗体表达量
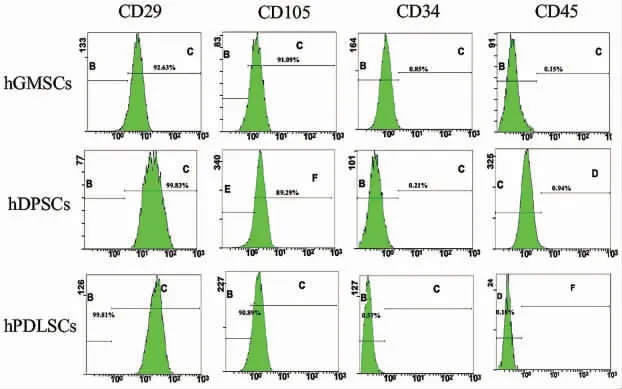
图2 hGMSCs、hDPSCs、hPDLSCs 表面标记物检测
3.hGMSCs、hDPSCs 和hPDLSCs 的增殖情况
48 h 以内,对照组和TNF-α 组的增殖情况差异不明显(P>0.05);干预48 h 后,相比于对照组,TNF-α 组三种干细胞增殖速率呈下降趋势,其中hGMSCs 的增殖速率在三种干细胞中仍最高,hPDLSCs 增殖速率显著降低(P<0.05)。因此,10 ng/mL TNF-α 对hGMSCs 增殖产生的抑制作用最小,对hPDLSCs 的抑制作用最明显(图3)。
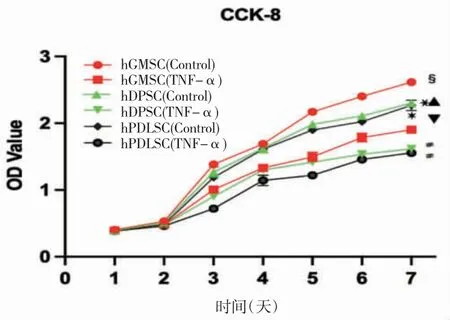
图3 三种干细胞在不同环境下的生长曲线
4.hGMSCs、hDPSCs 和hPDLSCs 的ALP 表达量比较
ALP 染色显示,染色深度如下:hPDLSCs>hDPSCs>hGMSCs;与单纯成骨诱导组(Osteo 组)相比,成骨诱导+TNF-α 组(Osteo+TNF-α 组)染色较浅,空白对照组(Control 组)染色最浅,染色深浅即代表ALP 活性的高低(图4A)。ALP 活性检测显示,10 ng/mL TNF-α 条件下hGMSCs、hDPSCs 和hPDLSCs 的ALP 活性均降低(P<0.05),其中hPDLSCs 在正常成骨诱导和TNF-α 的成骨诱导环境下的ALP 活性均高于hGMSCs、hDPSCs(P<0.01),hDPSCs 的ALP 活性稍高于hGMSCs(P<0.05),而hPDLSCs 的ALP 活性下降受TNF-α 影响相对明显(P<0.01),此结果与ALP 染色结果相一致(图4B)。

图4 A:体外成骨诱导7 天时ALP 染色。B:hGMSCs、hDPSCs、hPDLSCs 的ALP 活性(注:*P<0.05,**P<0.01,***P<0.001)
5.hGMSCs、hDPSCs 和hPDLSCs 的成骨能力比较
茜素红染色发现,正常和含10 ng/mL TNF-α的成骨培养液中均有明显的钙化结节产生,单纯成骨诱导组(Osteo 组)的钙化结节明显多于成骨诱导+TNF-α 组(Osteo+TNF-α 组)(P<0.05),三种干细胞成骨能力比较:hPDLSCs>hDPSCs>hGMSCs(图5)。
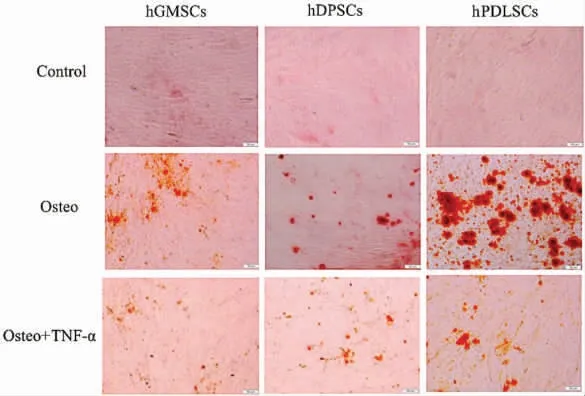
图5 体外成骨诱导21 天时茜素红染色( ×200)
6.hGMSCs、hDPSCs 和hPDLSCs 的成脂能力比较
油红O 染色发现,正常和含10 ng/mL TNF-α的成脂诱导液中均有脂滴形成,单纯成脂诱导组(Adipo 组)脂滴明显多于诱导+TNF-α 组(Adipo+TNF-α 组)(P<0.05),成脂能力比较:hGMSCs>hDPSCs>hPDLSCs(图6A);三种干细胞的脂滴形成量比较,10 ng/mL TNF-α 环境下三种干细胞的脂滴形成量均减少,其中hGMSCs 脂滴形成量多于hDPSCs,hDPSCs 脂滴形成量略多于hPDLSCs(P>0.05),hGMSCs 脂滴形成量显著多于hPDLSCs(P<0.01)(图6B)。
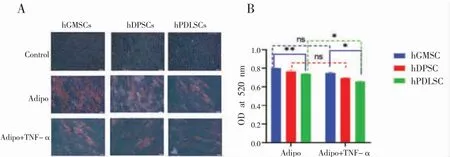
图6 A:体外成脂诱导21 天时油红O 染色( ×200),B:脂滴定量比较(注:*P<0.05,**P<0.01,NS P>0.05)
讨 论
牙槽骨缺损的修复是牙周炎治疗中的难点所在,随着牙周组织再生工程技术的发展,将干细胞(mesenchymal stem cells,MSCs)应用于牙周软硬组织缺损的治疗逐渐成为研究热点。但在MSCs 修复牙周组织缺损的过程中,不可避免地接触炎症微环境,在炎症刺激下,来自正常组织的MSCs 的生物学特性会发生怎样的变化,是否会影响牙周软硬组织的修复,以及理想种子细胞的选取与优化是我们需要解决的问题。与其他组织来源的MSCs 相比,牙源性间充质干细胞具有更强的增殖分化能力和优异的多向分化潜能,在特定诱导条件下可分化为骨、软骨及脂肪等细胞。因其来源广泛、易于存活、多次传代后性能稳定、免疫原性低以及对患者造成创伤小的特性[8],现已成为牙周再生研究的种子细胞,目前常用于实验及临床研究的牙源性间充质干细胞主要包括GMSCs、DPSCs 和PDLSCs。因此,本实验选取这三种MSCs 进行研究,同时为了避免供体差异性,我们采用同一供体来源的GMSCs、DPSCs 和PDLSCs,进而得出更为准确可靠的比较结果。
ALP 是一种广泛分布于人体内的磷酸单酯水解酶,是牙周组织中成骨细胞的重要标志物,在骨组织矿化过程中起重要作用,同时可以准确反应成骨细胞的代谢水平[9]。当成骨细胞向成牙本质细胞开始分化时ALP 活性最高,在矿化结束时活性处于最低水平[10,11]。随干细胞体外扩增代数增加细胞增殖能力和ALP 分泌量呈逐渐下降趋势,表明ALP 含量的多少对干细胞诱导成骨的能力有重要影响,同时成骨细胞增殖能力与ALP 水平呈正相关[12]。因此,检测ALP 表达情况对于评价干细胞的成骨代谢水平具有重要意义。
TNF-α 是牙周炎中主要炎症因子,与牙周炎的活动性密切相关,其主要由激活的巨噬细胞、NK细胞和T 淋巴细胞分泌产生[13]。在炎症牙周组织中,TNF-α 可直接抑制成骨细胞生成分化,并干扰成骨基因及蛋白表达;同时可促进IL-6(interleukin-6)和IL-1β(interleukin-1β)等炎症因子侵入牙周组织,产生金属蛋白酶降解细胞外基质,间接激活免疫反应,扩大炎症反应并加速骨破坏[14~16]。此外,TNF-α也可通过抑制前脂肪细胞分化或已定型的脂肪细胞去分化,从而抑制成熟脂肪细胞的形成[17]。骨形成蛋白(bone morphogenetic protein,BMP)对诱导MSCs成骨分化具有重要作用。有研究表明[13],TNF-α 可通过激活核转录因子kappa B(nuclear transcription factor kappa B,NF-κB)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/c-Jun 氨基 末 端 激 酶(c-Jun N-terminal kinase,JNK)、P38/MAPK 等信号通路间接抑制BMP 的表达,进而抑制MSCs 成骨分化;也有学者[18]认为TNF-α 可通过上述途径促进BMP 表达和成骨分化。TNF-α 对BMP 不同的调控作用主要取决于TNF-α 干预的浓度及时间。低浓度TNF-α(0.1~10 ng/mL)在干预较短时间(48 h 以内)时, TNF-α 会促进BMP 表达及MSCs 成骨分化,但对MSCs 的增殖能力影响不大;随着干预时间延长,MSCs 的增殖及成骨分化均受到明显抑制;较高浓度TNF-α(20~200 ng/mL)干预时,BMP 表达增强,但MSCs 的成骨分化受到明显抑制[19,20]。其原因可能是较高浓度的TNF-α 及其活化的NF-κB 信号通路提升BMP 抑制因子的表达水平,从而使细胞对BMP 刺激的反应性降低[21]。此外,较高浓度TNF-α 可诱导部分MSCs 发生凋亡[22]。有学者[23]采用不同浓度的TNF-α 对人脱落乳牙牙髓干细胞进行干预,结果发现相比于其他浓度的TNF-α,10 ng/mL 的TNF-α 对人脱落乳牙牙髓干细胞成骨分化抑制作用显著,且破骨相关蛋白明显增高。而陈小燕[24]利用含10 ng/mL TNF-α 的成骨诱导液培养hPDLSCs,发现hPDLSCs 成骨分化能力同样显著降低。因此,本实验选用对MSCs 增殖分化有抑制作用,又不会使其发生凋亡的10 ng/mL TNF-α 进行干预。实验结果显示,在48 h 内,10 ng/mL的TNF-α 对hGMSCs、hDPSCs、hPDLSCs 的增殖均无明显影响,在48 h 以后,三种干细胞的增殖能力受到不同程度的抑制作用;此外,在10 ng/mL TNF-α 的成骨、成脂诱导液中培养21 天后,三种干细胞的成骨、成脂能力均受到不同程度抑制。其中hPDLSCs 的增殖及成骨成脂能力受抑制作用最明显,hGMSCs 受抑制影响最小。
从牙周组织再生的临床应用出发,我们在实验中重点关注三种干细胞在炎症刺激下的成骨能力,其中hGMSCs 的成骨能力受TNF-α 的影响小,这可能与GMSCs 强大的免疫调节能力有关。有研究表明[25],利用GMSCs 的免疫调节可促进组织再生和伤口愈合,并抑制过敏反应,也为类风湿性关节炎等自身免疫性疾病提供了一种新型治疗策略。也有学者[26]发现,正常牙龈组织和炎症牙龈组织来源的GMSCs 生物学特性基本相同,均具有自我更新和多向分化潜能,进一步证实了GMSCs 强大的抵御炎症能力。而PDLSCs 的成骨能力受TNF-α 的抑制作用相对明显,这可能与成骨相关的信号通路有关,TNF-α 不仅可以直接作用于NF-κB、Wnt、MAPK、BMP、PI3K/AKT 等成骨相关信号通路,还能够通过信号通路之间的相互干扰影响PDLSCs 成骨。有研究发现[27,28],在牙周炎症微环境会激活NF-κB 通路,可促进β 连环蛋白(β-catenin)降解,同时,Wnt/β-catenin 信号通路使β-catenin 高表达,从而抑制PDLSCs 的成骨分化并促进其向破骨细胞分化。有学者[29]利用颗粒蛋白前体抑制TNF-α 激活的NF-κB 信号通路,从而促进了PDLSCs 成骨分化。
综上所述,本实验发现10 ng/mL TNF-α 对hGMSCs、hDPSCs、hPDLSCs 的增殖和成骨成脂分化能力均具有抑制作用,其中hGMSCs 表现出的增殖能力和抵御TNF-α 刺激的能力最强,提示在应用过程中应尽量诱导提高其分化能力;hPDLSCs 的成骨分化能力最强,但提高其对TNF-α 的抵抗能力至关重要,本研究为后续牙周组织再生过程中种子细胞的选取及优化提供了实验参考。

