青稞转录因子HvnANT1基因的克隆与表达分析
陈 林 姚晓华* 苏乐平,4 姚有华 魏 婵 吴昆仑
(1.青海大学 农林科学院,西宁 810016; 2.国家麦类改良中心青海青稞分中心,西宁 810016; 3.青海省青稞遗传育种重点实验室,西宁 810016; 4. 延安市农业科学研究所,陕西 延安 716000)
青稞(Hordeum
vulgare
L. var.nudum
Hook. f.)属于禾本科大麦属,也称为裸大麦或米大麦(一些地区称为元麦)。青稞因具有抗逆性强和适应性广的特点,因此能适应高寒地区的环境。它还是青藏高原重要的粮食、经济和饲料作物,距今已有约3 500年的种植历史。青稞的生产直接影响着藏区的粮食安全和经济发展。大麦籽粒颜色分为黑、紫和蓝色等,大麦颜色的差异主要是由花青素的积累引起的。花青素在植物中广泛存在,是一类水溶性色素,属于黄酮类次生代谢产物。有研究表明,花青素在籽粒的糊粉层积累,形成蓝粒大麦;在籽粒的颖和颖片中积累会形成黑、红和紫粒大麦。大麦籽粒中含有纤维、酚酸、黄酮类和植物甾醇等30多种功能成分,能辅助糖尿病、癌症、降低胆固醇治疗和预防心血管疾病的等功效,可防治20多种慢性病,大麦籽粒中的15种功能成分可预防11种慢性病。β-葡聚糖是具有降胆固醇、降血脂、抗肿瘤和预防心血管疾病的多糖,西藏青稞品种‘藏青25’中β-葡聚糖的含量高达8.62%。青稞中的维生素E具有抗氧化和抗癌等生理功能,黑青稞中B族维生素丰富,有助于维持人体的正常代谢活动。因此,大麦作为功能性食品而受到学者们地广泛关注。
已有研究表明,ANT1
基因是属于花青素合成通路中R2R3-MYB家族的转录因子,是MBW调控复合体中的一部分。ANT1
在植物生长发育和花器官发生中发挥着重要作用,Liu等研究认为玉米ANT1
能通过靶基因调控细胞增殖和叶片生长、维管和叶脉发育、叶绿体发育和光合作用。Shoeva等研究认为大麦ANT1
的启动子区域含有与光、生物、非生物逆境胁迫因子、植物激素相关的顺式调控元件和控制植物生长、发育及组织分化的一系列信号识别的元件。目前,关于大麦(青稞)粒色方面的研究主要集中在含量测定和基因定位等方面,尚未见花青素合成调控机制的研究报道。目前,青稞紫粒基因定位的7H候选区段内获得1个MYB类转录因子ANT1
,但并未进行该基因的克隆及表达研究。本研究以紫粒青稞品种‘涅如姆扎’和白粒青稞品种‘昆仑10号’为试验材料,从中克隆了该基因,并对其序列进行相关的生物信息学分析、亚细胞定位分析及HvnANT1
基因与花青素合成相关结构基因HvnCHI
、HvnANS
、HvnDFR
在不同生育阶段的表达模式分析,旨在探究HvnANT1
基因在青稞粒色形成过程中的基因表达模式,以期为揭示青稞紫粒形成的机制奠定基础。1 材料与方法
1.1 材料
供试青稞品种为‘涅如姆扎’和‘昆仑10号’由青海大学农林科学院作物栽培与育种研究所青稞研究室提供。2020年4月栽植于青海大学农林科学院试验田,根据Zadoks等对谷物生长阶段的分类,在籽粒着色不同时期:乳熟早期(播种后11周)、乳熟晚期(播种后13周)和软面团期(播种后15周)取籽粒种皮,每样品3次生物学重复。在液氮中进行速冻后于-80 ℃保存。
1.2 青稞HvnANT1基因的克隆
利用简化基因组GBS(Genotyping-by-Sequencing)对青稞紫粒进行基因定位,在7H染色体上84.30—86.00 cM候选区段内获得1个MYB类转录因子HvnANT1
(Gene ID: MLOC_6171)。利用Primer 5.0设计该基因引物(表1)。取‘涅如姆扎’和‘昆仑10号’的籽粒种皮,按照植物提取RNA试剂盒(TaKaRa MiniBEST Plant RNA Extraction Kit)提取青稞籽粒种皮的总RNA,用超微量核酸蛋白测量仪(Nano Photometer)测定RNA的浓度和纯度,用1.0%琼脂糖凝胶电泳检测其质量。参照cDNA合成试剂盒(PrimeScript 1 st Strand cDNA Synthesis Kit)反转录成cDNA,-80 ℃保存。以青稞种皮的cDNA为模板进行PCR扩增。PCR扩增体系及琼脂糖凝胶电泳检测结果参考姚晓华等的方法。目的条带用柱式DNA胶回收试剂盒(DNA Gel Extraction Kit)回收,用超微量核酸蛋白测量仪(NanoPhotometer)测定回收产物的浓度和纯度,与全式金生物公司的亚克隆载体连接,转化至大肠杆菌,送至上海生物工程股份有限公司测序。
1.3 青稞HvtANT1基因生物信息学分析
HvnANT1蛋白的蛋白质理化性质用Expasy Protparma(http:∥www.expasy.org/tools/protparam.html)和Protscale(https:∥web.expasy.org/protscale/)进行预测。HvnANT1蛋白的信号肽和跨膜结构分别用SignalP4.1(http:∥www.Detaibio.com/tools/signal-peptide.html)和TMHMM-2.0(http:∥www.cbs.dtu. dk/services/TMHMM-2.0/)进行预测。用SMART(http:∥smart.embl-heidelberg.de/)预测结构域。HvnANT1蛋白的二级结构和三级结构运用SPOMA(https:∥npsaprabi.ibcp.fr/cgibin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)和SWISS-MODEL(https:∥swissmodel.expasy.org/)分别预测。在NCBI的Blastp功能中,查询与HvnANT1蛋白同源植株的ANT1蛋白序列,DNAMAN 6.0软件进行多序列比对,用Mega 7.0软件的Maximum Likelihood法构建系统进化树。
1.4 亚细胞定位
采用pBI221-GFP载体用于亚细胞定位研究,设计带有Xba
Ⅰ和Kpn
Ⅰ酶切位点的正向引物与反向引物,采用高保真酶KOD-FX扩增HvnANT1
基因,构建C端与GFP融合的表达载体。PCR扩增体系与HvnANT1
基因克隆时体系相同。PCR产物和PBI221-GFP载体质粒经Kpn
I 和Xba
I双酶切后,T连接酶连接混合后的产物并将其转入大肠杆菌DH5α
感受态中,筛选阳性克隆及测序验证。将青稞种子在30 ℃黑暗萌发15 d取叶片切成碎段(<0.5 mm),总量5~10 g,用于原生质体制备,具体操作步骤参考李彦华等方法。1.5 青稞HvnANT1基因表达模式分析
根据扩增获得的HvnANT1
基因序列和大麦参考基因组(ftp: ∥ ftp.gramene.org/pub/gramene/release-63/fasta/hordeum_vulgare/dna/)的HvnCHI
、HvnANS
、HvnDFR
基因序列(https: ∥ www.gramene.org/),用Primer 5.0软件设计HvnANT1
、HvnCHI
、HvnANS
和HvnDFR
的qRT-PCR引物(表1)。以‘涅如姆扎’和‘昆仑10号’的乳熟早期、乳熟晚期和软面团期的籽粒种皮cDNA为模板,18SrRNA
作为内参基因(表1),采用TB Greenpremix ExTaq Ⅱ (TaKaRa公司)荧光染料利用Light Cycler 480 System进行qRT-PCR。反应体系参考苏乐平的方法。用2法计算各基因的相对表达量,应用SPSS 25.0软件进行显著性检测。表1 本试验用到的引物序列
Table 1 Primers used in this study
引物名称Primer name引物序列(5'→3')Primer sequence (5'→3')用途PurposeHvnANT1-1F: ATGGGGAGGAGGGCR: CGCAACGTACGGG基因克隆GenecloneHvnANT1-2F: AACAGCACGCTCGGCAGGAAR: AAGAAGAGGCCGCCAGTGCAqRT-PCR引物qRT-PCR primerHvnCHI F: GAACCACGATAAAACGCCCGR: AACGGAATGCCCTCCACTTCqRT-PCR引物qRT-PCR primerHvnANSF: GTATCTGCGAGCCAGACGATR: GTGCGCTATCCAGAAGACGGqRT-PCR引物qRT-PCR primerHvnDFRF: CCGTTCATCGAGCCATTGTCR: AGACGTAGTCGCCGTAAACCqRT-PCR引物qRT-PCR primerHvnANT1-GFPF: CGGCTACCACATCCAAGGAAR: CGGGTACCCACCGGCCATGTGCAGGGAC亚细胞定位载体Subcellular localization vector18SrRNAF: CGGCTACCACATCCAAGGAAR: GCTGGAATTACCGCGGCT内参引物Control primer
2 结果与分析
2.1 青稞HvnANT1基因的克隆及序列分析
以‘涅如姆扎’和‘昆仑10号’种皮反转录cDNA为模板,用表1中HvnANT1-1
(Geneclone)为引物,扩增得到1条1 033 bp的目的条带(图1(a))。经测序后用DNAMAN 6.0分析表明,该基因完整开放阅读框(ORF)为762 bp,编码253个氨基酸。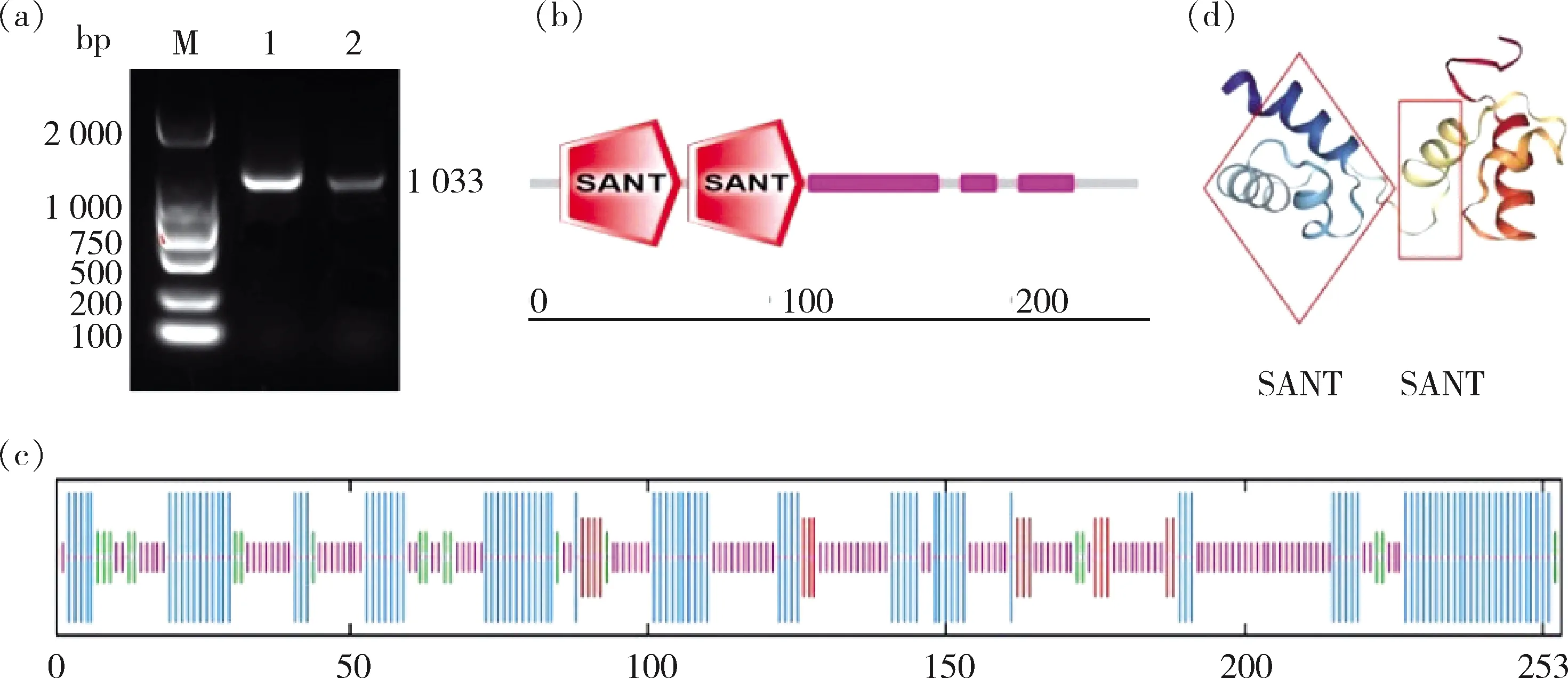
(a)HvnANT1基因扩增产物;(b)HvnANT蛋白结构域预测;(c)HvnANT蛋白二级结构预测图;(d)HvnANT蛋白三级结构的预测M,ML2000;1,青稞品种涅如姆扎PCR产物;2,青稞品种昆仑10号PCR产物;蓝色表示α-螺旋;红色表示延伸链;绿色表示β-转角;橙色表示无规则卷曲。(a) PCR amplified product of HvnANT1; (b) Domain prediction of HvnANT1 protein; (c) Secondary structure prediction of HvnANT1; (d) Teritary structure prediction of HvnANT1M, DL2 000; 1, PCR product of Nierumuzha; 2, PCR product of Kunlun10; Blue color, α-helix; Red color, extended chain; Green color, β- turn; Orange color, randon coil.图1 HvnANT1基因的PCR扩增产物及序列预测Fig.1 PCR amplification products and sequence prediction of HvnANT1 gene
测序后比对,‘涅如姆扎’和‘昆仑10号’的ORF区碱基序列和氨基酸序列一致性为100%,启动子序列比对结果为82.77%。利用SMART对其氨基酸序列进行保守结构域预测,发现该基因具有2个典型的SANT结构域,分别位于第13—第63个和第66—第114个氨基酸(图1(b))。
HvnANT1蛋白分子式为CHNOS,分子量为27.14 kU,不稳定指数为71.53,脂溶系数是69.21,pI 9.32,其中负电荷残基(Asp+Glu)为27个,正电荷残基(Asp+Glu)为35个。平均疏水性为-0.464。预测结果表明,HvnANT1蛋白是一个亲水性的不稳定碱性蛋白。HvnANT1蛋白跨膜结构与信号肽预测结果表明,该蛋白不存在跨膜结构,且无信号肽。
通过对HvnANT1蛋白的二级结构与三级结构进行预测,结果表明,HvnANT1蛋白的二级结构是由无规卷曲、α-螺旋、延伸链、β-转角组成,其中无规卷曲占47.04%,α-螺旋39.13%,延伸链5.93%,β-转角7.91%,可见该蛋白是以无规则卷曲和α-螺旋为主,这两个结构在蛋白行使功能时可能发挥重要作用(图1(c))。HvnANT1蛋白的三维结构预测结果表明,HvnANT1蛋白的功能结构域为‘V’形(图1(d))。Uniprot基因注释结果表明该蛋白为HvnANT1。
2.2 HvnANT1蛋白的同源比较及进化树分析
由图2可知,青稞HvnANT1蛋白与大麦(Hordeum
vulgare
)、乌拉尔图小麦(Triticum
turgidum
)、高粱(Sorghum
bicolor
)、玉米(Zea
mays
L
)、二型花(Dichanthelium
oligosanthes
)、小米(Setaria
italica
)、水稻(Oryza
rufipogon
)、土瓶草(Cephalotus
follicularis
)、车轴草(Trifolium
affine
)和杨梅(Morella
rubra
)10种植物的ANT1蛋白序列相似性分别为100.00%、88.85%、54.64%、60.95%、60.82%、58.46%、57.61%、37.76%、36.05% 和36.33%,这些序列都具有2个高度保守的SANT结构域。由图3可知,在7种禾本科植物中,青稞HvnANT1蛋白与大麦的亲缘关系最近,与水稻的亲缘关系较远。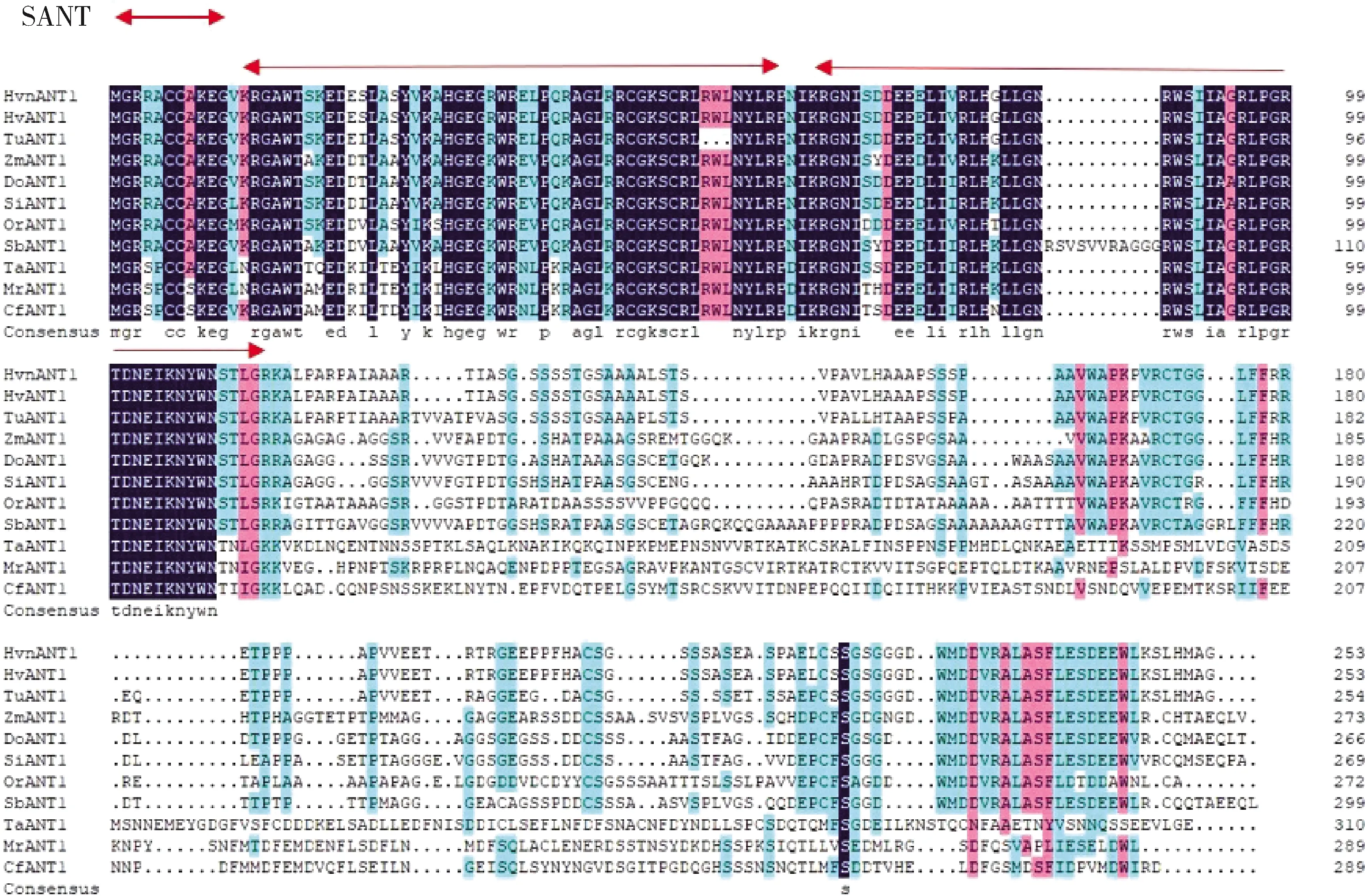
Hvn,青稞;Hv,大麦;Tu,乌拉尔小麦;Zm,玉米;Do,二型花;Si,小米;Or,水稻;Sb,高粱;Ta,车轴草;Mr,杨梅;Cf,土瓶草。红色箭头之间代表HvnANT1蛋白的SANT保守功能域。Hvn, Hordeum vulgare; Hv, Hordeum vulgare; Tu, Triticum urart; Zm, Zea mays; Do, Dichanthelium oligosanthes; Si, Setaria italica; Or, Oryza rufipogon; Sb, Sorghum bicolor; Ta, Trifolium affine; Mr, Morella rubra; Cf, Cephalotus follicularis. The red arrows represent the SANT conserved functional domain of HvnANT1 protein.图2 HvnANT1与其他植物ANT1蛋白氨基酸序列的多重比对Fig.2 Multiple alignment of amino acids sequences of HvnANT1 and ANT1 proteins from other plants
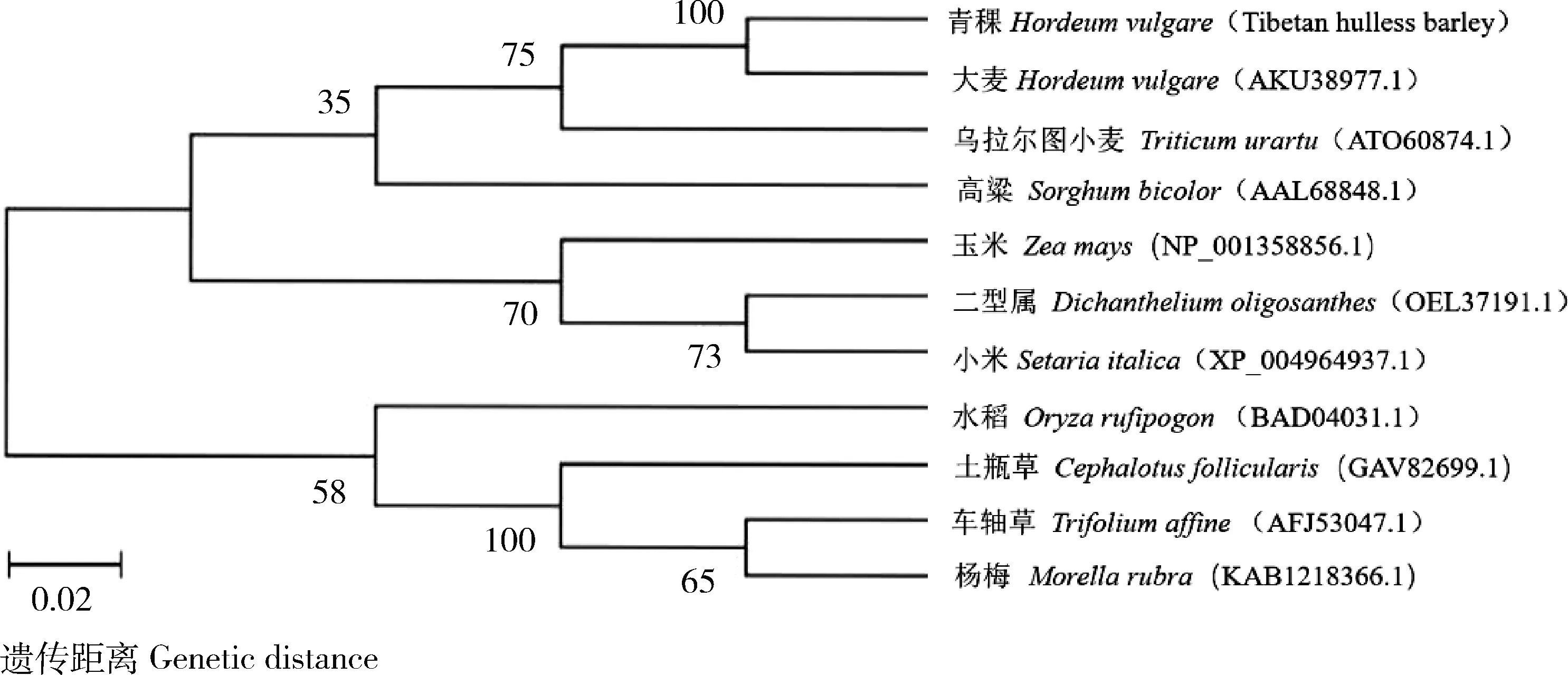
图3 HvnANT1蛋白与其他植物系统进化树Fig.3 Phylogenetic tree analysis of the HvnANT1 protein and other plants
2.3 HvnANT1亚细胞定位
由图4可知,HvnANT1-GFP融合蛋白在细胞核中有较强的绿色荧光信号,说明青稞HvnANT1蛋白定位于细胞核中。

激光共聚焦显微镜的激发波长的设置为:GFP 448 nm(绿色);叶绿体400 nm(红色)。The excitation wavelength of the confocal laser microscope: Chloroplaste ia set as GFP 448 nm (green), chloroplasts 400 nm (red).图4 HvnANT1亚细胞定位Fig.4 Subcellular location of HvnANT1
2.4 HvnANT1基因表达分析
由图5可知,在青稞籽粒颜色形成的乳熟早期、乳熟晚期和软面团期,‘涅如姆扎’的HvnANT1
基因的表达量逐渐升高,乳熟晚期表达量为乳熟早期的5.76倍,软面团期表达量为乳熟晚期的6.96倍;而‘昆仑10号’3个时期HvnANT1
表达量差异均不显著;且软面团期‘涅如姆扎’籽粒HvnANT1
基因的表达量极显著高于‘昆仑10号’(P
<0.01)。
不同大写字母表示差异极显著(P<0.01)。Different capital letters are extremely significantly different at P<0.01.图5 HvnANT1(a)、HvnCHI(b)、HvnANS(c)和HvnDFR(d)在不同青稞品种乳熟早期、乳熟晚期和软面团期的表达量Fig.5 Expression of HvnANT1 (a), HvnCHI (b), HvnANS (c) and HvnDFR (d) in the early milk, late milk and soft dough of different hulless barley varieties
HvnCHI
和HvnANS
与HvnANT1
表达量趋势一致(图5(b)和(c));HvnDFR
基因在‘涅如姆扎’的乳熟早期、乳熟晚期的表达量均低于‘昆仑10号’但差异不显著;但在软面团期,高于‘昆仑10号’且具有极显著差异(P
<0.01),与乳熟早期和乳熟晚期相反。3 讨 论
花青素广泛的存在于植物中,是一种黄酮类化合物,通过普遍存在的次生代谢途径合成。常见的花青素有天竺葵素(pelargonidin)、矢车菊素(cyanidin)、飞燕草素(delphinidin)、芍药素(peonidin)、矮牵牛素(petunidin)和锦葵素(malvidin)。花青素作为天然色素而具有很强的药用价值,例如抗氧化性、抑制氧化应激和神经炎症、预防心血管疾病、抗肿瘤、抗糖尿病和抗癌等作用。MBW(MYB-bHLH-WD40)复合物在花青素生物合成途径中发挥重要的作用,MYB、bHLH和WD40三类转录因子常通过形成三元复合体来发挥功能。其中MYB基因在植物界中是最大的转录因子家族之一,也是植物花青素合成途径中最广泛的调节因子。本研究中的HvnANT1
基因即属于MYB家族,因此,探究该基因对青稞花青素的合成有着重要的意义。拟南芥ANT
基因家族相关研究较多,与生长发育有着密不可分的关系,ANT
是AP2/EREBP转录因子家族的成员,含有2个高度保守的AP2结构域,在调节胚珠、胚珠发育和花器官生长中起着关键作用。在拟南芥中,ANT蛋白属于AP2相关基因家族,对胚珠发育至关重要。大麦ANT1
是玉米C1
基因的同源物,C1
基因是编码R2R3-MYB转录因子家族的一个成员,在大麦中ANT1
基因(或称为Rs
)被定位在7H染色体短臂的着丝粒区域内。本研究中,青稞HvnANT1和大麦ANT1蛋白相似性为100%(图2)。系统进化树也表明,两者遗传距离最近。Zakhrabekova等研究表明,大麦ANT1
是一个MYB家族的转录因子,与高粱Sb10g006700相似,可能具有编码花青素C1/MYB转录因子的功能。因此推测青稞HvnANT1
也具有类似的功能。HvnANT1蛋白结构域预测结果显示该蛋白含有2个高度保守的SANT结构域。Aasland等研究表明,SANT结构域与MYB相关蛋白的DNA结合结构域相似性很高。通过亚细胞定位分析,HvnANT1
基因定位在细胞核中,这与暴志茹在二球悬铃木(Platanus
acerifolia
)中的研究结果一致,符合转录因子的特性。因此推测在花青素合成过程中,转录因子HvnANT1在细胞核内发挥重要作用。已有研究表明,ANT1
基因在花青素合成的途径中起关键作用,Jende等与Franckowiak等研究认为ANT1
突变后在大麦的茎、叶耳、芒、外稃或基生叶鞘中花青素均不再累积,ANT1
基因可决定大麦叶鞘的花青素色素沉着;ANT
1是玉米C1
基因的同源物,是花青素合成调控网络的重要组成部分,Zakhrabekova等研究表明,对无花色素苷1(ert-m ant1)双突变体表型观察可知,ANT
1基因产物参与花青素的生物合成;等研究表明,番茄中过量表达ANT1
基因,会使花青素大量积累导致植株变为紫色。本研究认为紫粒青稞品种‘涅如姆扎’随种皮颜色的加深,HvnANT1
基因表达量显著升高;且在青稞籽粒颜色形成的过程中,尤其是软面团期紫粒种皮的HvnANT
1表达量极显著高于白粒品种种皮中的表达量;与花青素合成相关的3个结构基因HvnANS
、HvnDFR
和HvnCHS
的表达量也具有类似的结果(图5)。已有研究表明,CHI
、F3
′H
、DFR
和ANS
这4个基因的转录依赖于ANT1
的等位基因状态。本研究发现HvnCHI
和HvnANS
表达量与HvnANT1
趋势一致。推测,HvnANT1
基因在紫粒青稞‘涅如姆扎’粒色形成过程中对花青素合成关键基因HvnANS
、HvnDFR
和HvnCHI
存在调控的作用。Nakatsuka等研究结果表明,DFR
基因的表达量在被片、花药、花丝、雌蕊和红色的鳞片中随着花的生长发育而增加,因此认为该基因仅在花色素苷着色的器官中表达,并且此种基因的表达量与花色素苷的含量呈正相关。本研究中,乳熟早期和乳熟晚期HvnDFR
基因在‘昆仑10号’和‘涅如姆扎’中均有显著表达,但差异不显著,这可能是由于DFR
基因不仅是催化生成不稳定花色素苷的限速酶,而且还是单宁和芦丁等次生代谢途径中的关键酶。由此推测DFR
基因参与了单宁和芦丁等次生代谢物的合成,但具体调控过程尚需进一步验证。4 结 论
综上所述,本研究从简化基因组GBS中对青稞紫粒花青素合成相关基因定位,在7H染色体的84.30—86.00 cM中定位到HvnANT1
基因,分别在‘昆仑10号’和‘涅如姆扎’中克隆到该基因。生物信息学分析发现,青稞HvnANT1
完整开放阅读框为762 bp,编码253个氨基酸,属于MYB家族,定位于细胞核。荧光定量PCR检测结果显示,在乳熟晚期青稞HvnANT1
、HvnANS
、HvnDFR
和HvnCHI
基因在‘涅如姆扎’中的表达量均显著高于‘昆仑10号’。
