髁突骨折翼外肌解剖复位动物模型建立相关研究*
孙二灿,刘 喆,武 辉,夏飞飞,黎昌学
1.石河子大学医学院口腔医学系,新疆 石河子 832008;2.石河子大学第一附属医院口腔科,新疆 石河子 832008
下颌骨是颌面部体积最大,位置较突出的骨骼,在解剖中,髁突处于结构和力学上的薄弱区域[1],是下颌骨骨折的常见部位之一,占全部下颌骨骨折的29%~52%[2],且由于髁突骨折多发生于翼外肌附着下方的髁突颈部,折断的髁突由于受翼外肌的牵拉而经常容易发生移位[3]。由于髁突骼结构和功能的特殊性,决定了骨折愈合时间长且受到许多因素的影响,若措施不当会对患者造成不可逆的伤害,尤其是处于儿童和青少年生长发育期,处理不当会导致颞下颌关节强直和咬合关系紊乱,甚至严重影响患儿下颌骨和颌面部发育[4],髁突骨折有效的治疗方式为手术治疗,其目的是尽量恢复患者颌面部形态异常及下颌骨运动功能。根据骨折部位及骨折线性质可将手术复位方式分为髁突翼外肌解剖复位及髁突游离复位[5]。而采用哪种方式对患者的预后较好,迄今为止国内外仍有争论,但采用翼外肌—髁状突骨折解剖复位方式近年来在国际上不断有相关报道并予以肯定[6]。为研究临床髁突骨折翼外肌解剖复位后的愈合过程,因此建立适宜的动物模型可以模拟人类骨折发生时的各种状态,在动物模型基础上进行骨折防治、愈合机制和临床治疗的研究,可以很好地指导临床治疗,为临床治疗工作提供切实依据。本研究主要探讨建立新西兰兔下颌骨髁突骨折翼外肌解剖复位愈合动物模型的建立,现报告如下。
1 资料与方法
1.1 实验动物
选取健康状况良好且进食正常的6月龄新西兰兔15只,新西兰兔体重范围在2.3~2.5 kg,全部新西兰兔由石河子大学医学院动物试验中心提供,24 h有专门饲养人员监管。其中实验组12只,防止动物意外丢失或死亡预备3只。实验用牙科低速涡轮机和微型接骨板接骨钉由石河子大学第一附属医院口腔颌面外科提供,实验用全麻药物1%丙泊酚,局麻药物2%利多卡因,试验抗生素由石河子大学医学院试验动物中心提供。
1.2 动物模型的建立
对选取的实验动物进行编号,分别用耳钉标记“1~15”号,在实验动物中随机选取12只用于髁突骨折翼外肌解剖复位动物建模,另外3只用于实验预备。新西兰兔在术前禁饮禁食6~8 h,并称重,全麻药物1%丙泊酚缓慢从建立的耳缘静脉通道注入,初始剂量为2 mg/kg,至角膜反射消失。麻醉成功后取侧卧位固定于实验台上,随机选取一侧颞下颌关节进行手术,对新西兰兔消毒铺巾后2%利多卡因局部麻醉手术区。做耳屏前皮肤切口,后钝性逐层分离组织至下颌升支及髁突。自髁突下1.0 cm以牙科低速涡轮机横行截骨,确认完全离断,再将其进行组织复位,髁突原处完全复位。牙科高速涡轮机钻通骨质制备钉洞,微型钛板固定,青霉素生理盐水反复冲洗术腔后逐层严密缝合(图1~2)。术中及术后3 d口服抗生素预防感染。术后流食喂养10 d后改为常规饲料,10 d后拆线,所有动物均无意外丢失和死亡。

图1 翼外肌解剖复位组确认骨折
1.3 动物处死取材
分别在术后第2、4、6、8周,随机选取3只建模的新西兰兔,均在1%丙泊酚全麻下处死实验动物切取双侧完整的颞下颌关节,将颞下颌关节放置在10%福尔马林溶液中固定。

图2 翼外肌解剖复位组骨折固定
1.4 石蜡切片制作
将实验动物髁突按编号放入相应固定器皿中,加将颞下颌关节放置10%福尔马林溶液中固定中固定一周。组织固定完成后自来水冲洗24 h,置入10%EDTA溶液中室温下脱钙4周,然后放入无水乙醇中脱水。沿关节冠状面制备5 mm厚切片,分别用苏木素一伊红(HE)和甲苯胺蓝(toludine blue)染色,以备组织学分析。
1.5 统计学方法
采用SPSS 25.0软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 术后各周下颌支和髁突标本测量结果
动物术后2、4、6、8周使用游标卡尺测量实验侧与对照侧下颌支高度,差异无统计学意义(P>0.05),同时测量实验侧与对照髁突内外径、前后径,差异无统计学意义(P>0.05),两组动物髁突前后径比较,差异无统计学意义(P>0.05),见表1。
表1 术后各周下颌支和髁突标本测量结果(±s)
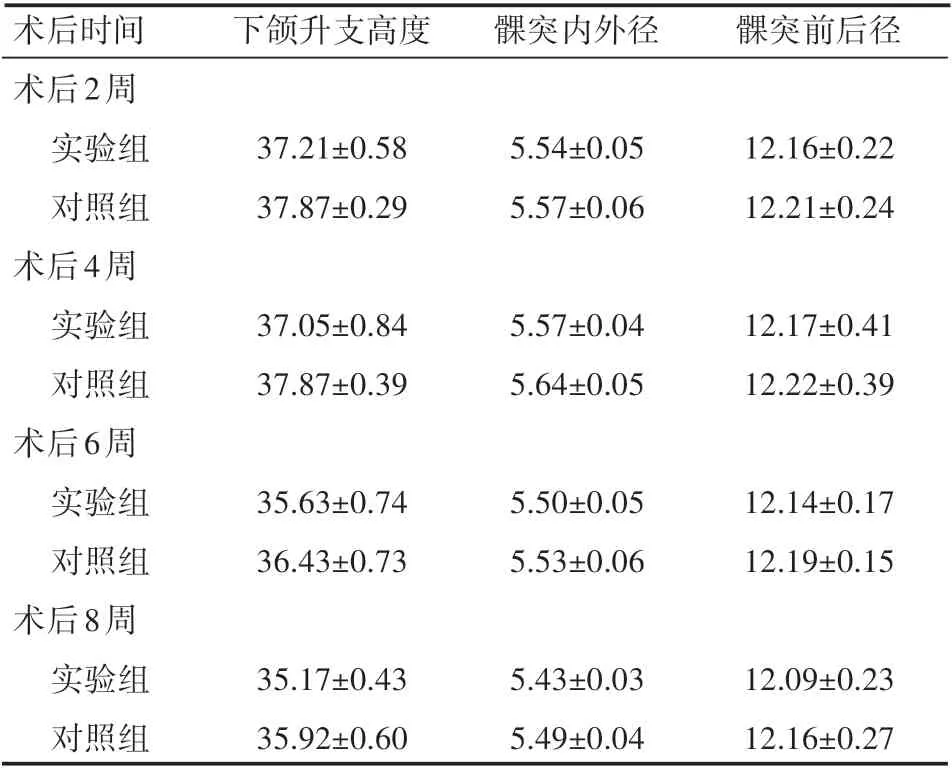
表1 术后各周下颌支和髁突标本测量结果(±s)
术后时间术后2周实验组对照组术后4周实验组对照组术后6周实验组对照组术后8周实验组对照组下颌升支高度髁突内外径髁突前后径37.21±0.58 37.87±0.29 5.54±0.05 5.57±0.06 12.16±0.22 12.21±0.24 37.05±0.84 37.87±0.39 5.57±0.04 5.64±0.05 12.17±0.41 12.22±0.39 35.63±0.74 36.43±0.73 5.50±0.05 5.53±0.06 12.14±0.17 12.19±0.15 35.17±0.43 35.92±0.60 5.43±0.03 5.49±0.04 12.09±0.23 12.16±0.27
2.2 微血管计数
动物术后2、4、6、8周进行微血管数目统计,术后2、4、6周术后实验组微血管数目均高于对照组,差异有统计学意义(P<0.05),术后8周实验组微血管数目与对照组比较(图3~4),差异无统计学意义(P>0.05),见表2。
表2 术后各周微血管数目情况(±s)

表2 术后各周微血管数目情况(±s)
术后时间术后2周术后4周术后6周术后8周实验侧12.26±0.57 16.52±0.62 12.48±0.73 10.29±0.57对照侧9.04±0.57 9.30±0.62 9.22±0.73 8.96±0.57
图3 术后8周实验组与对照组微血管数(实验组)
3 讨论
下颌骨在解剖中位置较为突出,因此易遭外力作用引起损伤而导致骨折发生。髁状颈部属于下颌骨解剖结构的薄弱区,又是颞颌关节的重要组成部分。颞颌关节由髁突、关节窝、关节盘、关节囊、关节韧带和翼外肌组成[7],使其成为一个动、静平衡的统一复合体。一旦某个部位损伤,破坏了其动静平衡,可以造成颞颌关节生物力学负重力的改变,从而影响关节各种功能,引起颞颌关节功能紊乱[8]。正因为髁状颈部的薄弱性,使其成为维持颞颌关节保持稳定的关键因素。外力直接作用在髁部可发生直接骨折,当颏部或体部受到打击时,当下颌骨受到损伤时,髁突颈部由于应力集中发生间接骨折。至今为止,人们对于下颌骨髁突骨折的治疗方法尚存在争论,一些学者坚持保守治疗,一些学者坚持手术治疗,正确的选择治疗方式还需进一步探索。应用动物模型研究人类骨折愈合的相关问题是最为有效的方法。研究者对骨折愈合的相关知识,主要来自于动物实验模型并得到临床治疗与流行病学调查支持。关于骨折的生物学基础和分子生物学基础的知识,也源于动物实验模型。现在常用的实验动物模型主要有6种:鼠模型、兔模型、羊模型、犬模型、猪模型及灵长类动物模型等[9]。相比之下,新西兰兔价格相对低廉,易于得到和饲养管理,兔骨结构中含有哈佛小管系统,下颌骨形态及功能与人类相近,因此在本实验中选用新西兰兔作为下颌骨髁突动物模型的建立。
髁突骨折后髁突软骨表面无血管或手术阻断血供是髁突吸收的主要原因。据报道[10],骨折块附着翼外肌时影像学检查提示髁突骨折段愈合良好,翼外肌剥离时髁突骨段块吸收,证明翼外肌血供的重要性。一些临床研究同样证明翼外肌剥离髁突游离复位术后髁突吸收率较高,部分患者预后不佳[11],有学者通过对髁突骨折行坚强内固定手术治疗患者定期随访发现,术中保存翼外肌附着可以提高骨肌瓣成活率、减轻髁突吸收、更有助于关节功能的恢复[12]。其他临床研究[13]也证明了翼外肌在髁突骨折手术中具有重要作用,而本研究通过对术侧与健康侧两组动物髁突标本测量分析均证明髁突骨折解剖复位后无明显骨吸收。这与颞颌关节较强的适应和改建能力有关,有研究认为翼外肌解剖复位可短期内实现关节功能重建防止髁突吸收[14],减少颞下颌关节功能和结构的紊乱,防止颞下颌关节强直的发生[15]。
骨折的愈合是一个非常复杂的过程,其中有多种重要因素参与[16],正常的血供对髁突骨折愈合起着决定性作用,在很大程度上决定了骨折愈合的快慢和结果,因此血管新生和血供的重建是骨折愈合的关键环节。骨折部位微血管重建可分为三个阶段,初期骨折部位形成血肿,周围血管扩张充血,血肿内无或仅有少量再生血管;中期随着血肿机化,髁突骨折部位微血管形成达高峰;后期髁突骨折部位进入稳定的恢复阶段,新生微血管数量减少并逐渐转为正常形态。此外下颌骨周围组织代偿能力强大,在正常血供被破坏后,初期能通过周围侧枝循环建立和吻合支开放,使周围软组织血液量提升,局部血管密度增大,以此促进骨折愈合。因此髁突骨折后组织再血管化对骨愈合起着关键作用。本研究通过对微血管计数证实手术愈合后骨折实验组与对照组前期手术组微血管数量明显高于对照组,后期微血管数量无明显改变。此外,随着现代化工业和交通事故成为髁突骨折的主要致伤原因,其作用力强大,所致骨折可能翼外肌附丽极少甚至完全丧失或髁突粉碎性骨折,只能游离状态进行骨折复位。而对于陈旧性髁突骨折,髁突被纤维组织包裹、黏连,难以进行翼外肌解剖复位,只能将周围组织切开掏出髁状突后游离再值。因此,本研究存在一定的局限性,对于髁突粉碎性骨折的动物模型的建立还需要进一步探索。
综上所述,下颌骨髁突骨折常因骨折后局部缺血造成骨吸收,手术后血管生成和数量对组织的愈合有着重要的影响,骨折常因局部缺血引起组织坏死无法愈合或延期愈合本实验评价了骨吸收量和微血管数量,实验组与对照组无明显差异,提示我们髁突骨折翼外肌解剖复位动物模型成功建立。

