迎春花轮斑病病原物鉴定及其致病力分析
王乐怡 王子硕 卓涛

关键词:迎春花;轮斑病;尾孢属;致病力;发病率
迎春花(Jasm in u m n u difloru m ) 又名金梅、清明花、黄素馨,系木犀科落叶灌木,与梅花、水仙和山茶花统称为“雪中四友”,是中国名贵花卉之一,具有极高的观赏价值和药用价值,在中国广泛种植。福建省地处亚热带,是迎春花的主要生长地之一。目前迎春花常见的病害有斑点病、花叶病、褐斑病、灰霉病等,但关于这些病害的病原物鉴定的文献报道较少。已有的关于迎春花病害的分离鉴定大多利用分子生物学方法分析其rDNA相关基因序列的方法,如2021 年报道的一种由Phlebiopsis crassa 引起的迎春花叶枯病,此病原物的鉴定是通过对致病菌形态特征的观察和rDNA-ITS、nLSU 基因序列的分析确定得出的[1]。
2022 年3 月2 日,在福建農林大学校园西北区域以及西区大田均发现了不同于常见迎春花病害症状的迎春花病株,共64 棵,其症状不同于常见的迎春花枯叶症的病害,初期症状类似于褐斑病或者斑点病,而后呈现轮斑症状。为此,本研究利用柯赫氏法则对福建农林大学校园内的感病迎春花进行病原菌鉴定,并对病原菌致病力进行评估,以期为迎春花病害扩充知识库。
一、材料与方法
(一) 材料
病株采集于2022 年3 月2 日福建农林大学校园西北区域以及西区大田迎春花病株,利用剪刀剪取病健交界处叶片并浸泡于75%的乙醇溶液中3s,接着用1.3%的次氯酸钠溶液进行冲洗消毒处理,之后用无菌水冲洗5 次。以福建农林大学校内距离病株以外的健康植株为对照。用马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA) 作培养基对病原物进行组织培养。
(二) 试验方法
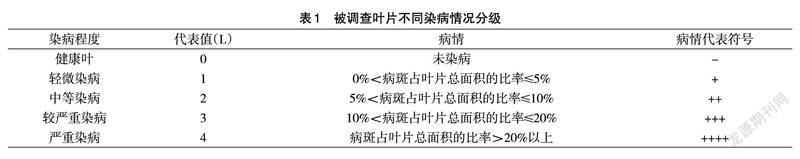
1、症状观察。对发病的植株进行症状观察并进行拍照采集标本,选取典型的病叶进行徒手切片并制成玻片,观察病原物的特征并进行鉴定。依据感病植株感病的严重程度,即叶片表面病斑的大小形态学方法对感病的植株进行分级、分组。
2、病情鉴定。选取典型的病叶进行徒手切片并制成玻片,观察病原物的特征并进行鉴定。利用公式(1) 计算发病率[2],利用公式(2) 计算发病指数[3]。
3、病原体的分离、培养、纯化。将处理过的叶片放入制作好的PDA 培养基中,用保鲜膜封口保存,在室温下培养3d 后对分离的病原物进行纯化。切取菌落边缘的菌丝约2×2m m 至新的PDA 平板培养基纯化培养,仍用保鲜膜封闭保存以防菌种污染,将其倒放在28℃恒温培养箱中培养4~6d 后对纯化后的病原物进行镜检观察,根据病原菌的形态特征,查找相关资料,确认病原菌。
4、病原菌接种。将培养出的病原菌接种于健康迎春花植株上,用涂抹法、针刺法进行病原菌的接种[4]。取迎春花健康植株枝条,插在锥形瓶内水中进行培养。实验分为两组同时进行:一组为新叶接种,另一组为老叶接种,比较病原菌对新叶或老叶的致病力。每一组实验处理方式为:a.以迎春花枝条为对称中心,取右边的叶片用菌饼贴附法,即挑取一小块菌丝直接贴附于叶片表面,用锡纸包扎;b.左边的叶片用针刺法(即用挑针轻轻扎伤),再挑取一小块菌丝贴在伤口处,用锡纸包扎。在未染病植株所有健康叶片上重复以上操作。然后用保鲜膜套住锥形瓶,并用橡皮筋扎好,湿度达到95%以上。24h后把锡纸取掉,观察植株的发病情况。对发病情况进行观察、记录、拍照。
(三) 病情分级
根据植物叶片的病斑面积占叶片总面积的百分比将植物叶片从健康叶到严重染病分为5 个等级,以此来区分植物叶片的染病程度,其分级标准见表1。
二、结果与分析
(一) 症状观察
叶片受害后初期为褐色圆形小病斑,扩大后呈轮纹状病斑;病菌若从叶尖或叶缘侵入,呈现轮纹状,病斑多时连成大斑块(图1d 和e);病斑无明显边界或具有淡紫色晕圈,稍内层是褐色圆圈,中央变灰白(图1e);气候温暖不过分炎热且潮湿时,有小黑点产生。
(二) 发病率与致病力测定
共调查了200 片叶子,其中有170 片叶子表现出症状,根据公式1 得到以下计算结果:
R (%) = (170×100) /200=85%即在被调查的迎春花植株中,感染目的病原物的概率为85%。
病情指数作为评测病原物致病力的另一个重要指标,本试验不同染病等级各级(0≦L≦4) 的叶片数量见表2。根据公式2 计算病情指数,结果如下。
I=(0×30+1×36+2×51+3×49+4×34)×100(/ 200×4)=52.625表明该病原体在迎春花中的平均致病率约为52.625%。
(三) 病原物鉴定
通过切片观察,迎春花叶片病部的小黑点是分生孢子座,部分为埋生,其余部分为表生;分生孢子梗褐色至橄榄褐色,全壁芽生合轴式产孢,呈屈膝状,孢痕明显;分生孢子为多细胞,线形、针形、倒棒形、鞭形或蠕虫形,无色或淡灰色,基部脐点黑色,加厚明显。经文献查询[5],该病原菌的形态特征与尾孢属的特征一致。此外,根据柯赫氏法则(Koch’s Rule),实验在L=0 的叶片中无法分离出病原物,在L>0 (L=1,2,3,4) 的叶片中均可以分离出相同的病原物,且此种病原物被从寄主体内分离纯化培养后可以复染L=0 的叶片使其叶片的等级变为L>0 (即染病叶片)。在复染叶片中分离纯化到该病原菌。因此,经切片观察及柯赫氏法则验证,迎春花轮斑病病原物属于尾孢属(Cercospora)的真菌。
(四) 侵入途径鉴定
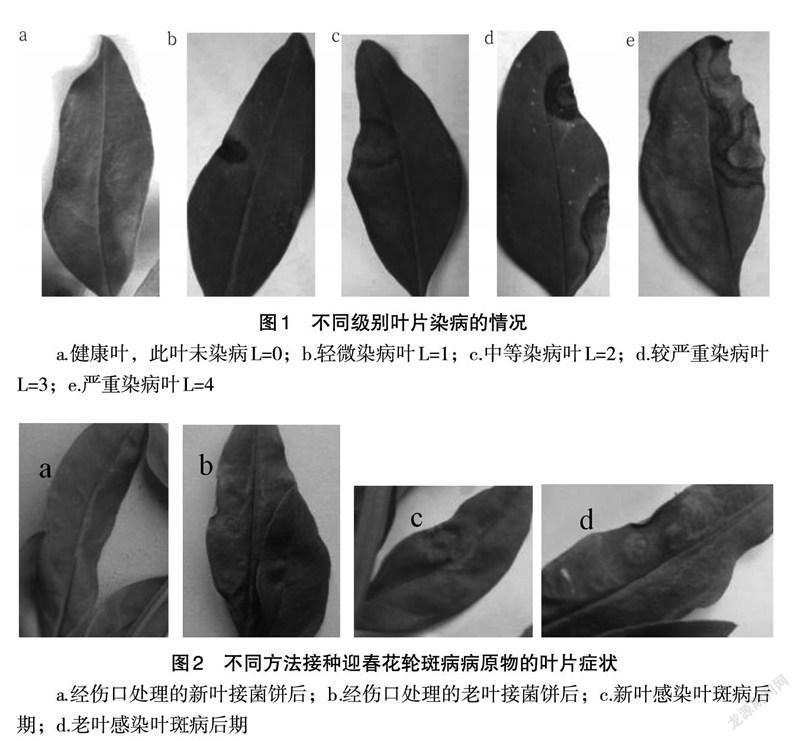
为确定尾孢属侵入迎春花的方式,PDA 培养基处理作为对照,以排除培养基对迎春花叶片的影响。结果表明,在接种菌饼3d 后用针刺的叶片都出现了一个小病斑,相比较于新叶(图2a),老叶的病斑会比较明显(图2b),而直接接菌饼的叶片上无病状;PDA 培养基的对照组也无任何现象,因此排除PDA 培养基药害的影响。当迎春花枝条继续培养下去时,针刺叶片的病斑越来越明显并且呈现轮纹状的病斑(图2c 和d),与在校园里发现的染病迎春花植株症状一致,而直接接菌饼的叶片仍未观察到任何异常。
综上可得,该尾孢属真菌主要从伤口侵入,而且对新叶和老叶均能侵染;从病害症状发展来看,对老叶的致病力更强。
三、讨论
在本研究中,用PDA 培养基对病原菌进行分离培养及纯化,仅得到白色的菌丝体,且将纯化出的菌丝在PDA 上放置于26℃~28℃培养箱中,12h光照12h黑暗交替培养,均观察到产包孢。但是用纯化培养的病原物接种健康的迎春花叶片,可以观察到与校园中染病迎春花一样的症状;且在此人工接种并发病的迎春花叶片病部能观察到埋生或表生的小黑点。显微观察病原物切片照片,其病原物形态特征与尾孢属或假尾孢属真菌相似。由于其分生孢子座基部疤痕明显而非锥形平截,通过文献对尾孢属和假尾孢属真菌的特征描述比较,确定该迎春花轮斑病病原物属于尾孢属(Cercospora)真菌,而非假尾孢属。目前,这是有关尾孢属病原真菌对迎春花致病的首次报道。但是,对于该真菌属于尾孢属以下的分类地位还未明确,因此,在之后的研究工作中,可以提取分离培养的病原菌的基因組,扩增rDNA-ITS序列,测序并在NCBI 数据库中进行序列比对,从而确定其精确的分类地位。
尾孢属真菌以菌丝体和分生孢子在病残体中越冬,成为翌年初侵染源;大量的分生孢子经风雨传播,从伤口间接侵入,为害寄主[6];尾孢属感染寄主后有一定的潜育期,经分生孢子多次再侵染,病原菌大量积累,遇有适宜条件即流行[7]。福建福州地处我国东南沿海,属亚热带地区属亚热带海洋性季风气候,春夏两季环境条件适合尾孢属真菌生长繁殖,因此在这两季,校园内该迎春花病害多发。
迎春花病害的药剂防治。发病初期,可喷洒0.5%波尔多液,或65%代森锌600 倍液,每隔7~10d1 次,连续3~4次,可以控制病情[8]。此外,有文献表明,喷施纳米TiO2 光半导体溶胶材料可以缓解植物病害[9];利用短波UV 对植物进行照射可以降低病情指数[10]。
结语
通过对福建农林大学内迎春花病株的采样、标记、统计分析、培养鉴定,可知其发病率85%,病情指数52.625,表明校园内迎春花发病率高,但是大部分植株的病情不太严重,病害极度严重的较少。引起该病害的病原物属于尾孢属(Cercospora) 真菌,这是首例报道尾孢属感染迎春花致其产生轮斑症状的病例,为迎春花的保护提供依据。

