普通小麦4个主要矮秆基因的分子检测
牟丽明,田秀苓,刘 丹,董亚超,何中虎
(1. 甘肃省定西市农业科学研究院,甘肃定西 743000; 2. 中国农业科学院 作物科学研究所,北京 100081)
株高是影响小麦生产潜力的重要农艺性状,适当降低株高能够增强小麦的抗倒伏能力,有助于提高收获指数,促进高产稳产[1]。20世纪60年代,矮秆基因Rht1和Rht2的应用,促使了矮秆和半矮秆小麦品种的选育和推广,极大地促进了全球小麦产量的增长[2-3]。
小麦中正式命名的矮秆基因有25个,但应用到育种中的却很少,其中Rht1、Rht2、Rht8和Rht24应用最为广泛[4-9]。Rht1和Rht2属于赤霉素迟钝型基因,来自于Norin10,降低株高15%,增产24%左右[5]。Rht1和Rht2分布广泛,世界上70%的育成品种中至少含有其中一个矮秆基因[10]。Rht8和Rht24都属于赤霉素敏感基因,其中Rht8来自于日本品种Akakomugi,降低株高10%,对产量无不利影响[11-14];Rht24起源较早,在Norin10和Akakomugi中都能检测到,降低株高6~8 cm,并且在世界小麦品种中分布广泛,其中在国内小麦品种(系)中分布频率约为84%,国外小麦品种(系)中分布频率约为67%[5]。
分子标记辅助选择是一种有效的技术手段,利用分子标记对小麦品种(系)进行分子检测是开展分子育种工作的基础。矮秆基因Rht1和Rht2已经通过同源克隆的方法被克隆,Ellis等[15]开发具有互补性质的STS标记,但在实际应用中因其特异性不足,并不能够有效区分矮秆基因型和高秆基因型;随着高通量KASP检测平台的建立,Rasheed等[16]根据Rht1和Rht2的基因序列开发KASP高通量功能标记,能够准确、快速地检测育种材料;随后Tian等[5]也根据Rht1和Rht2的基因序列开发了检测效果更好的CAPS功能标记。矮秆基因Rht8近期已被克隆,最初SSR标记Xgwm261常被用做检测Rht8的有效分子标记,但该标记距离Rht8较远且检测出的变异类型较多[17-20];随着对Rht8研究的深入,Gasperini等[12]开发与Rht8共分离的分子标记DG273,扩增条带391 bp代表矮秆类型, 421 bp代表高秆类型。Tian等[21]通过图位克隆的方法克隆了矮秆基因Rht24并开发功能标记,可利用该CAPS标记TaCRY2对Rht24进行检测。
为更好的了解现有小麦品种和骨干亲本中矮秆基因分布,本试验利用目前发布的最有效的矮秆基因分子标记对312份小麦材料进行检测,为杂交组合的配制提供参考。
1 材料与方法
1.1 试验材料与田间种植
共检测小麦品种(系)312份,包括40份北部冬麦区材料、229份黄淮麦区材料和43份国外材料,其中63份材料于2018-2019和2019-2020年度种植于北京,中国农业科学院作物科学研究所东圃场,2 m行长,2行区,均匀撒播;将149份材料于2018-2019和2019-2020年度种植于中国农业科学院棉花所安阳试验站,2 m行长,2行区,均匀撒播(附表1)。所有材料均由中国农业科学院作物科学研究所提供。
1.2 DNA提取
取苗期幼嫩的叶片0.2 g左右放入提前装有钢珠的2 mL离心管中,液氮迅速冷冻并用研磨仪(德国RETSCH MM400型)进行磨样。采用CTAB法提取小麦基因组DNA[22],利用紫外分光光度计检测DNA浓度并调整至50 ng/μL,转移至96孔中保存待用。
1.3 KASP检测
矮秆基因Rht1和Rht2采用Rasheed等开发的KASP标记进行检测(表1)。KASP标记共3条引物A、B和C,其中C为共用引物,A带Fam荧光基团,激发蓝光,检测野生型,B带Hex荧光基团,激发红光,检测突变类型。KASP反应体系为5 μL,主要包括DNA 1 μL(45 ℃烘干),2.5 μL Master Mix (LGC,北京),1.444 μL去离子水,0.056 μL混合引物(100 μmol/L的A、B、C工作原液按照A∶B∶C∶ddH2O = 12∶12∶ 30∶46的比例混合)。KASP反应程序采用Touchdown程序,起始退火温度设定为65 ℃,每个循环下降0.8 ℃。采用KASP荧光扫描仪(Pherastar,LGC)进行结果扫描,用Kluster caller软件进行基因分型。
1.4 PCR检测
利用各分子标记对312份供试材料进行基因型检测。矮秆基因Rht8采用共分离标记DG273进行检测,Rht24采用CAPS标记TaCRY2进行检测(表1)。PCR反应体系为15 μL,包括1.5 μL模板DNA,7.5 μL 2×TaqPCR Mix(天维,北京),10 μmol/L上下游引物各1 μL,4 μL去离子水。PCR反应在BioRad公司(http://www.bio-rad.com)MyCycler PCR仪上完成,其反应程序为标准程序,DG273和TaCRY2的退火温度分别为58 ℃和67 ℃。对TaCRY2标记的PCR产物进行酶切,酶切体系为10 μL,包括5 μL PCR产物,1 μL 10×缓冲液,0.2 μL限制性内切酶DpnⅡ(NEB,北京),3.8 μL去离子水,37 ℃孵育3 h。在20 g/L琼脂糖凝胶电泳上进行电泳,200 V电泳45 min,在凝胶成像系统中波长为254 nm的紫外灯下观察并拍照。
1.5 数据统计与分析
在小麦成熟期,分别测量安阳试验点149份材料和北京试验点63份材料的株高,株高为茎基部到穗顶端的距离(芒除外)。采用Excel 2010对数据进行统计。

表1 检测矮秆基因的分子标记序列Table 1 Sequences of molecular markers for detection of dwarfing genes
2 结果与分析
2.1 4个主要矮秆基因检测结果
利用Rht1和Rht2位点的KASP标记对供试材料进行检测,若检测结果是蓝色(Fam)类型,则材料中含有高秆等位基因;若检测结果是红色(Hex)类型,则材料中含有矮秆等位基因;若检测是粉色则代表无信号,针对粉色结果,进行二次检测(图1-A和1-B)。检测结果显示:在312份小麦品种(系)中,294份材料都至少含有一个“绿色革命”基因Rht1或Rht2,7份同时含有矮秆基因Rht1和Rht2,18份不含有这2个矮秆基因(表1)。
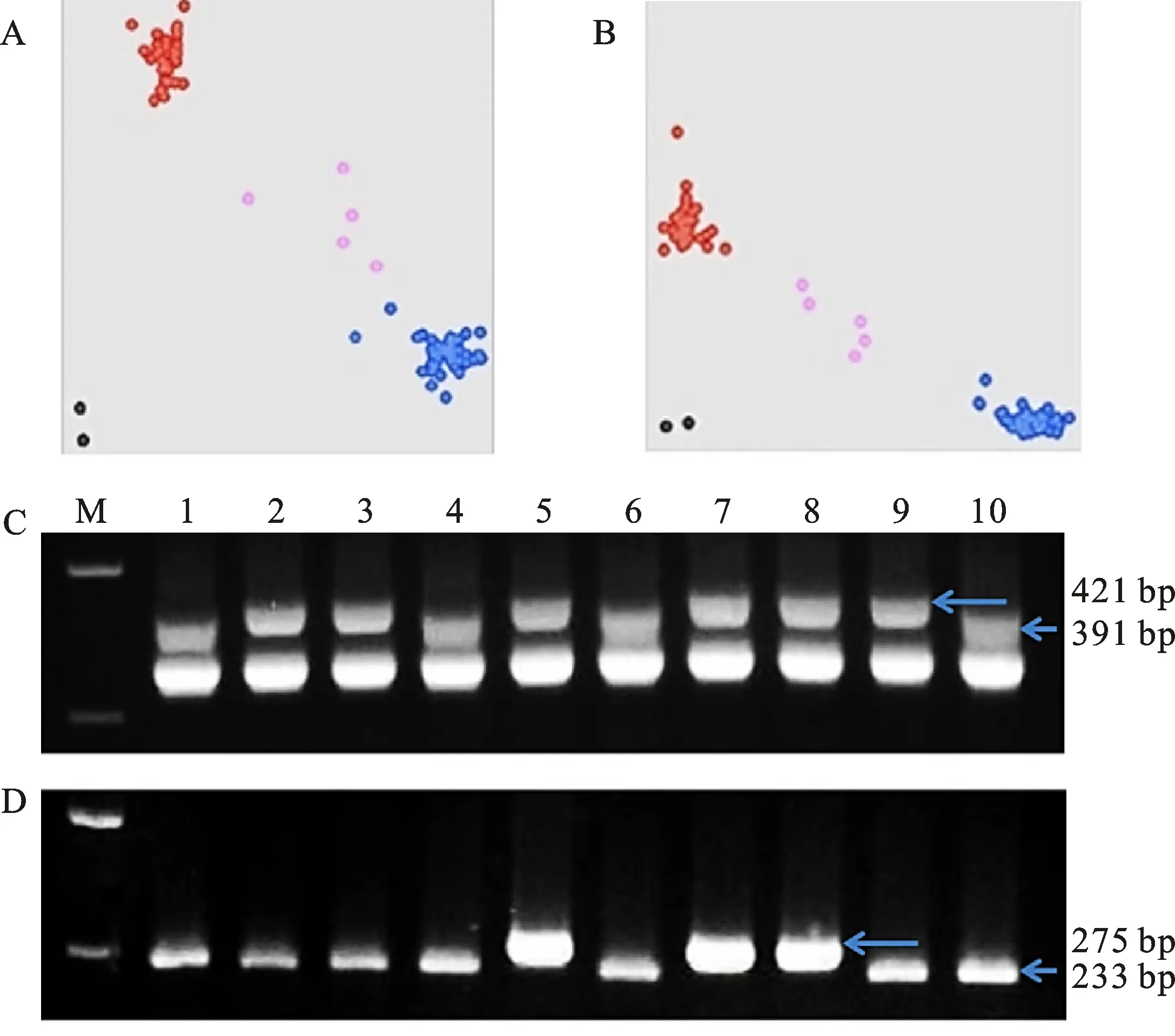
图A和B分别为 Rht1和 Rht2位点检测结果;黑点代表对照水,红点代表矮秆等位基因类型,蓝点代表高秆等位基因类型,粉色代表无信号;图C和D分别为 Rht8和 Rht24位点检测结果;M代表DL 2 000,泳道1~10分别是‘良星66’‘北京0045’‘中麦415’‘中麦996’‘泛麦8号’‘济麦20’‘泛育麦17’‘CA14043’‘农大212’‘中麦895’
利用与Rht8共分离标记DG273对供试材料进行检测,若扩增片段为421 bp,则表示该品种(系)含有Rht8矮秆等位基因;若扩增片段为391 bp,则表示该品种(系)含有Rht8高秆等位基因(图1-C)。利用与Rht24紧密连锁的CAPS标记TaCRY2对供试品种(系)进行检测,含有Rht24矮秆等位基因品种(系)的扩增条带275 bp会被酶切成233 bp和42 bp两个条带;不含有矮秆基因Rht24的品种(系)的扩增条带275 bp不会被酶切开(图1-D)。
2.2 4个矮秆基因及其组合分布频率
在供试的312份品种(系)中,Rht1、Rht2、Rht8和Rht24的分布频率分别为18.9%、 77.6%、50.0%和91.3%。在国内品种(系)中,Rht24的分布频率(98.1%)最高,Rht2的分布频率(83.6%)次之;在国外品种(系)中,Rht8的分布频率(55.8%)高于Rht24(48.8%)、Rht1(39.5%)和Rht2(39.5%)。
大多数品种(系)中至少含有2个或2个以上的矮秆基因。2个矮秆基因组合分析结果显示:Rht2+Rht24的分布频率(73.4%)最高,随后依次是Rht8+Rht24(45.5%)、Rht2+Rht8(35.9%)、Rht1+Rht24(15.7%)、Rht1+Rht8(12.2%)和Rht1+Rht2(2.2%)。在3个矮秆基因的组合中,Rht2+Rht8+Rht24分布频率最高(33.7%),然而,只有4份材料同时含有4个矮秆基因(表2)。
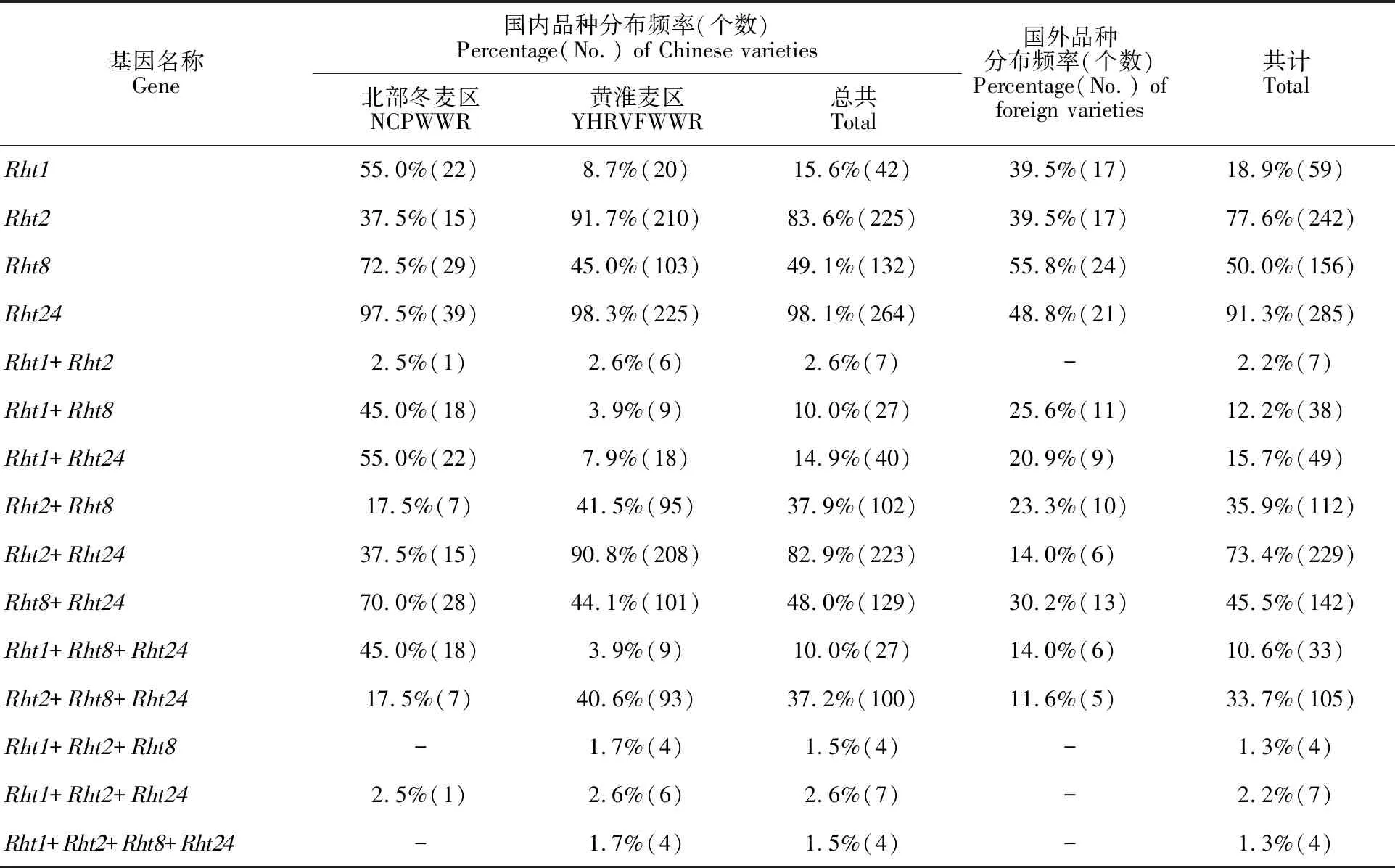
表2 312份品种(系)中矮秆基因及其组合分布频率Table 2 Distribution frequency of dwarfing genes and their combinations in 312 varieties
2.3 不同麦区4个矮秆基因及其组合分布频率
在本研究选用的国内276份冬小麦品种(系)中,北部冬麦区材料40份,黄淮麦区229份。Rht1在北部冬麦区的分布频率(55.0%)高于黄淮麦区(8.7%),Rht2在黄淮麦区的分布频率(91.7%)高于北部冬麦区(37.5%),Rht8在北部冬麦区的分布频率(72.5%)高于黄淮麦区 (45.0%),值得注意的是,Rht24在2个麦区的分布频率都是最高的,其中40份北部冬麦区的品种(系)含有Rht24的品种(系)有39份;229份黄淮麦区品种(系)中,含有Rht24的品种(系)有225份。
由于Rht1+Rht2同时存在的频率很低,因此不再分析该组合类型。在含不同矮秆基因组合中,Rht2+Rht24在黄淮麦区的分布频率最高,占90.8%,Rht8+Rht24在北部冬麦区的分布频率最高,占70.0%。由于Rht1在北部冬麦区的分布频率高,而Rht2在黄淮麦区的分布频率高,因此在矮秆基因的组合分布频率中表现为Rht1+Rht8、Rht1+Rht24和Rht1+Rht8+Rht24在北部冬麦区的分布频率高于黄淮麦区,而Rht2+Rht8、Rht2+Rht24和Rht2+Rht8+Rht24在黄淮麦区的分布频率均高于北部冬麦区(图2)。
2.4 不同矮秆基因及其组合对株高的影响
通过对供试材料4个主要矮秆基因(Rht1,Rht2,Rht8和Rht24)的检测,结合两年度其株高表型数据,对不同基因及组合对株高的效应进行了解析。不同矮秆基因和组合的株高在2个试验点表现出类似的趋势。在安阳试验点149份材料中,Rht2的降秆效应最强,平均株高84.5 cm,Rht1的平均株高为90.2 cm;在含有2个矮秆基因的材料中,Rht2+Rht24的材料株高最矮,平均株高84.5 cm,Rht1+Rht24的材料株高最高,平均株高91.8 cm;含有3个基因时,Rht2+Rht8+Rht24材料的平均株高矮于Rht1+Rht8+Rht24的材料,这也反映出Rht2的降秆效应强于Rht1。在北京试验点的63份材料中,在含有一个矮秆基因的材料中,Rht2的株高最低,为75.4 cm,Rht8的株高最高,为78.7 cm;在含有两个矮秆基因的材料中,Rht2+Rht24组合类型株高最矮,为75.4 cm,Rht1+Rht8组合类型株高最高,为78.5 cm;在含有3个矮秆基因的材料中,Rht2+Rht8+Rht24组合类型的株高为 76.2 cm,低于Rht1+Rht8+Rht24组合类型,与安阳试验点材料表现一致(表3)。
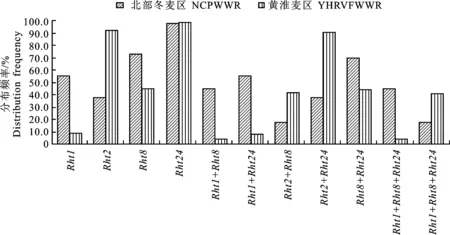
NCPWWR=Northern China Plain Winter Wheat Region; YHRVFWWR=Yellow & Huaihe River Valley Facultative Winter Wheat Region

表3 各基因型材料平均株高Table 3 Plant height under dwarf genes and their combinations cm
3 讨 论
312份材料分子检测结果分析表明,Rht24的分布频率最高,广泛存在于国内外小麦品种中,其次分别为Rht2、Rht8和Rht1。前人研究对黄淮麦区129份小麦材料进行分子标记检测,发现含Rht8的材料最多(89份),含Rht2的材料73份,含Rht1的材料37份。这与本研究结果略有不同,可能与供试材料的遗传背景及分布区域有关[23]。在中国,来自不同麦区的冬小麦品种(系)矮秆基因的分布频率不同,主要体现在Rht1、Rht2和Rht8上,此外,Rht1在北部冬麦区的分布频率高,而Rht2在黄淮麦区的分布频率高,这种现象可能与不同麦区最初所用的矮源有关。
在分析这4个矮秆基因的效应时发现,单独含有某一矮秆基因的材料较少,很难对其进行单独分析,各矮秆基因大多以组合的形式存在,这一方面是由于不同品种(系)所含矮秆基因类型和数目不同所造成的,另一方面可能与同一麦区矮秆背景相似有关[10]。同时,发现矮秆基因的降秆效应存在叠加特性,育种利用时需注意选配矮秆基因组合。值得注意的是,本研究发现矮秆基因Rht2无论是单独存在,还是与其他基因互作,其降秆效应都稍强于其他几个矮秆基因,这4个矮秆基因的降秆效应由强到弱依次为Rht2>Rht24>Rht8>Rht1,在前人研究中,Rht1和Rht2的降秆效应相差不大[24],这可能与供试材料的遗传背景相关,Rht8的降秆效应与前人研究相似[25]。另外,含有矮秆基因越多的材料其株高不一定最矮,譬如Rht1+Rht8+Rht24基因型材料的平均株高为84.1 cm,均高于这3个基因单独存在时的株高,一方面可能与材料有关,另一方面可能由于矮秆基因间产生相互作用,导致株高发生变化。
分子标记开发是分子标记辅助选择育种的基础和关键。随着标记开发技术的不断发展,标记类型也不断更新,由最初的STS和SSR标记逐渐发展为通量高、价格低的KASP标记。检测Rht1和Rht2的标记,有最初的STS基因特异标记,也有后来开发的KASP和CAPS基因功能标记。针对同一基因开发不同类型的多个标记不仅为大家的检测提供了多种选择也可以使标记间得到相互验证。

