兼性贫营养净水菌株微胶囊的制备及其性能研究
邱锦鸣,刘 哲,吴佳佳,薛陈杰,刘雪梅
(淮阴工学院化学工程学院,江苏 淮安 223003)
贫营养微生物又称为寡营养微生物,能够在土壤、湖泊河水、地下水、沙表土等有机质匮乏的环境中生长[1]。将贫营养微生物从环境中分离提纯出来,用于自来水工艺中低浓度溶解性污染物的去除,这是近年来在给水处理领域形成的一个新思路[2,3]。
研究表明,自来水深度处理工艺中存在自然条件下形成的菌落,其对水质提升具有积极作用,但自然形成菌落世代周期长,净水效率低[4]。通过人工筛选的优势菌群投放可显著缩短生物挂膜过程,并有针对性地对靶向污染指标实施高效净化。当前中国的集中式饮用水水源地微污染形势十分严峻,自来水厂对溶解性污染物去除率亟待提高,积极研发贫营养净水微生物制剂,将实验室成果尽快产业化具有重要而迫切的现实意义[5,6]。
微囊化技术可以通过一定的理化手段将益生菌包裹在微小且封闭的胶囊中,不仅能在加工或贮藏过程中提高菌株的有效活菌数,还能在不利环境中对菌株进行保护,提高其抗性[7,8]。由于Ca2+-藻酸盐凝胶的安全和无毒性质,是最常用的微囊化壁材[9]。本研究利用淮阴工学院净水微生物制剂研发课题组前期筛选出的兼性贫营养净水碳源微生物菌株,将多菌株复配,采用乳化法制备微生物制剂,并研究其在微污染水体中的净化效果。
1 材料与方法
1.1 试剂与仪器
复配兼性贫营养菌株包括变形杆菌(Proteus)、短小芽孢杆菌(Bacillus pumilus)和蜡样芽孢杆菌(Bacillus cereus),由淮阴工学院净水微生物制剂研发课题组优选并经16S RNA 进行基因测序鉴定;MRS 培养基,宜兴市永信生物有限公司;其他试剂均为分析纯,由国药集团化学试剂有限公司提供。
立式压力蒸汽灭菌器(LDZX-75KBS 型),上海申安医疗器械厂;高速冷冻大容量离心机(ST16R型),赛默飞世尔科技(中国)有限公司;超净工作台(SW-CJ-1D 型),苏州博莱尔净化设备有限公司;TOC 测定仪(M5310C 型),苏伊士水务技术(上海)有限公司;紫外分光光度计(752 型),上海美析仪器有限公司;激光粒度分析仪(MS-2000 型),英国马尔文仪器有限公司;扫描电镜(Hitachi 型),日立科学仪器有限公司。
1.2 方法
1.2.1 菌悬液的配制 将保藏在冰箱中的菌种在固体培养基上划线,于37 ℃培养箱中培养12 h,挑选单菌落接种于液体培养基中,在振荡培养箱中37 ℃培养24 h。4 ℃、4 000 r/min 离心15 min 分离菌悬液。菌泥用0.9%生理盐水悬浮后,4 ℃、4 000 r/min离心15 min,洗涤2 次,用生理盐水悬浮细胞,将浓缩菌液浓度调节至1010CFU/mL,4 ℃冰箱保存。
1.2.2 乳化法制备微胶囊 采用外源乳化法,将菌悬液、灭菌的海藻酸钠溶液(30 mg/mL)和含有(2 μL/mL)Tween-80 的植物油按照2∶3∶25(V/V)的比例混合,按200 r/min 对混合液进行搅拌,待乳化完全后,加入100 mL 灭菌CaCl2溶液(20 mg/mL),继续搅拌20 min。350 r/min 离心5 min,4 ℃条件下收集微胶囊,用灭菌生理盐水清洗2 次除去残余的CaCl2。将微胶囊放入-20 ℃冰箱中预冻2 h 后,置于-40 ℃,5.9 Pa 真空冷冻干燥机中冷冻干燥24 h,得到微胶囊冻干粉。
1.2.3 微胶囊理化性质表征
1)外观形貌测定。将样品均匀分散在无水乙醇介质中,取少量分散液滴在超薄碳膜上,待乙醇挥发后,在200 kV 电子加速电压下进行测试。
2)粒径分析。以去离子水为分散介质,对微胶囊的粒径大小及其分布进行测试。
3)微胶囊耐酸碱性的测定。锥形瓶中加入100 mL 去离子水,通过加盐酸和氢氧化钠调节pH从2 到12,分别加入原菌悬液和微胶囊,控制原菌悬液中的菌量,使其与微胶囊中含菌量相同。处理2 h后,测其活菌数并比较其耐酸碱性能力。
4)微胶囊定储存稳定性试验。根据经典恒温法的指数理论,将未微胶囊化的菌种和微胶囊化的菌种置于恒温57 ℃、相对湿度60%~65%条件下储存7 d,相当于室温下储存1 年,测其活菌数的变化。
5)净水试验。取淮阴工学院湖水,用脱脂棉过滤,除去湖水中的悬浮物,得到有机质均一的水作为试验用水,每个锥形瓶中平均分装200 mL。将原菌悬液2 mL 接种到装有198 mL 湖水的锥形瓶中,投菌量保持在108~109CFU/mL,同时称取1 g 的冻干粉投入到装有200 mL 湖水的锥形瓶中,于28 ℃条件下静置培养7 d,测定总有机碳(TOC)的变化。
2 结果与分析
2.1 微胶囊外观形态
微胶囊产品为淡黄色粉末,分散性、流动性较好,易溶于水。由图1 可知,微胶囊大体呈圆球状,囊壁较平滑,有凹陷。从破碎的微胶囊中看到内部包埋的大量细菌。造成囊壁凹陷的原因可能是由于分子之间的结合力不同,导致囊膜薄厚程度呈现差异。不同厚度的囊壁抵抗变形能力不同,从而导致在冷冻干燥过程中,薄壁处出现凹槽,从而造成微胶囊表面凹凸不平。

图1 不同放大倍数下微胶囊扫描电子显微镜(SEM)观测
2.2 微胶囊粒径分布测定
粒径相关分析测定结果(图2)表明,微胶囊的比表面积(SSA)为326 cm2/g,比表面积较小,表明包埋效果较好。微胶囊的粒径大小为2.512~954.993 μm;d(0.5)(中位径)为134.272 μm,表明微胶囊中大于和小于134.272 μm 的颗粒各占50%;颗粒分布主要集中在104.713~239.883 μm。微胶囊粒径分布较宽的原因可能是乳化过程中,搅拌器周边不同空间范围的微粒受到的作用力不同所致[10]。

图2 微胶囊粒径分布统计
2.3 微胶囊耐酸碱性的测定
分别在不同pH 的体系中投加菌悬液与微胶囊,保持初始含菌量相同(活菌浓度约为2.2×109CFU/g),2 h 后测定各个体系中的活菌数。由图3 可知,在菌悬液体系中,中性条件下(pH 6~8)活菌数最高;随着酸性或碱性的增强,活菌数均显著下降。微胶囊的活菌数受pH 变化影响较小,活菌数始终高于菌悬液中的最高活菌数。由此可知,微胶囊化明显增强了菌株的耐酸碱性。
2.4 微胶囊稳定性测定
将微胶囊化的菌株和未微胶囊化的菌种在恒温57 ℃、相对湿度60%~65%条件下储存7 d,其活菌数测定结果如图4 所示。在恒温57 ℃条件下储存7 d后,未微胶囊化的活菌数降低较快,当储存到5 d 时已基本检测不到活菌数。微胶囊化的活菌数降低缓慢,储存7 d 后活菌数为8.6×108CFU/g,相当于在室温条件下储存1 年的活菌数,仅降低了1 个数量级。可见,未微胶囊化的细菌储存稳定性较差,不利于细菌的保存;将细菌微胶囊化,可以有效提高细菌在常温下的存活率。

图4 微胶囊的储存稳定性
2.5 TOC 测定
从图5 可以看出,菌悬液对水体的TOC 降解速度先快后慢,后期基本趋于缓和,7 d 时TOC 去除率达48.82%;微胶囊化的菌种对水体的TOC 降解速度前期比较缓和,中期比较迅速,后期仍然保持较高的去除效率,7 d 时TOC 去除率达61.21%。分析原因可能是由于微胶囊化的细菌前期处于休眠状态,需要时间来恢复活性;待活性恢复后,逐步向水体释放,对水体中的TOC 进行降解。由于微胶囊化后,菌株具有缓释作用,因而能够持续地发挥净水作用,并且能够耐受营养元素逐步降低的外部环境,而未微胶囊化的细菌可能随着可利用营养物质含量的降低而整体代谢活性降低。因此,微胶囊化有利于细菌在各种复杂的条件下保持持续的高效净水效率。
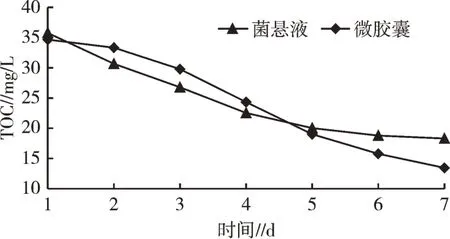
图5 TOC 浓度随时间的变化
3 小结
本试验采用外源乳化法制备了贫营养复合菌微胶囊制剂。结果表明,该微生物制剂粒径分布合理,耐酸碱性及稳定性较未胶囊化的菌株明显提高,可在较低的浓度水平下,实现对水体TOC 的高效降解,具有良好的应用前景。

