小分子药物的新靶点—RORs
李天行 杨淼 沈硕 仲兆民 刘超


摘要:视黄素相关孤核受体家族(RORs)是昼夜节律、代谢和免疫系统发育的重要调节因子,通过作用于不同组织器官的RORE元件,在信号分子与转录应答间建立起紧密的联系,从而调控细胞的生长与分化。RORs对小分子药物极为敏感,具有作为治疗不同疾病的药物靶点的潜力。3种不同亚型RORα、RORβ、RORγ,广泛分布于机体各处,分别在各项活动中行使相同或不同的功能。本文将对RORs作为药物靶点,在昼夜节律、代谢与T细胞发育3个方面的调控机制进行综述。
关键词:RORs 昼夜节律 代谢调控 T细胞发育 药物靶点
核受体家族是一类由对应配体激活的转录因子家族,其在激活后能直接进入细胞核结合至靶DNA的靶序列,从而对机体的各种生理活动发挥重要的调控作用。孤核受体是一类没有天然配体或尚未发现配体的核受体家族,视黄素相关孤核受体家族(RORs)就是其中之一。
利用配体靶向调节核受体的药物研究在近些年快速发展,引起了人们对孤核受体可能存在的配体的极大兴趣,从而促使了具有药代动力学和药效学特性的人工合成配体相似化合物的研究进一步发展,进而研发出能治疗相关疾病的药物。这种策略已经发现几种孤儿受体可以作为潜在的药物靶点,其中就包括了能调节昼夜节律、新陈代谢和免疫功能的RORs。
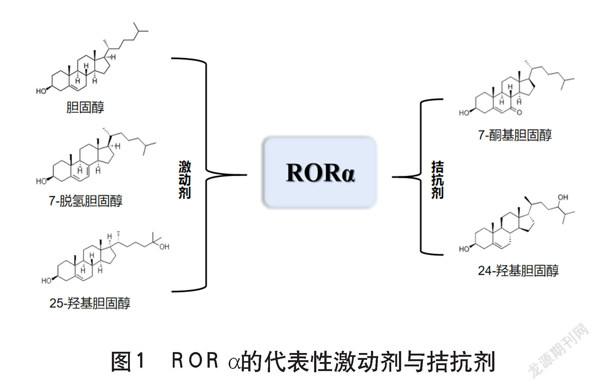
RORs基因家族有3种不同亚型,分别是RORα、RORβ、RORγ,这3个RORs家族成员作为昼夜节律振荡器的一个子组件,是多种生理功能发育的重要调节因子。随着对RORs的研究逐渐深入,目前已经确定了一些与RORs的配体结合域相互作用的配体,它们可以作为RORs转录活性的激动剂或拮抗剂(见图1)。这些配体主要包括甾醇及其衍生物,例如胆固醇、7-脱氢胆固醇和25-羟基胆固醇,可以作为激动剂与RORα的配体结合域相互作用;而一些含氧甾醇,如7-酮基胆固醇和24-羟基胆固醇,却可以作为RORα和RORγ的拮抗剂发挥作用。
此外,硬脂酸和全反式维甲酸虽然不与RORα或RORγ结合,却可以作为RORβ的拮抗剂与其配体结合域相互作用。这些观察结果不仅推翻了原来的认识,证明RORs是一种可以受配体影响的转录因子,也表明RORs具有作为治疗不同疾病的药物靶点的潜力,其作为靶点的治疗效果将取决于配体的性质和其所处的局部环境。
由于RORs在昼夜节律调控、代谢与T细胞发育3个生理功能中扮演了不可或缺的角色,目前以RORs为药物靶点开发药物逐渐成为了热门的研究课题,以期能找到能调控昼夜节律或代谢过程,或是能影响免疫功能的全新药物。下文将着重介绍RORs在昼夜节律、代谢与T细胞发育中发挥的作用与相关疾病,更加详尽地阐明RORs作为药物靶点开发药物的必要性。
1昼夜节律调控
生物钟是包括人类在内的绝大多数生物对地球周期性变化的长期适应所产生的内在计时机制,一般以24h为周期。昼夜节律的异常将会严重影响各项生理功能,从而导致各类疾病,如睡眠障碍和情绪障碍,更严重的甚至会导致糖尿病、肥胖和癌症的发生。
生物钟的分子核心是一个由几个相互关联的反馈回路组成的转录/翻译调控网络,其中转录激活因子BMAL1、CLOCK、隐花色素(CRY)和周期蛋白(PER)在生物节律的形成过程中起到了重要作用[2]。转录激活因子BMAL1与CLOCK结合形成BMAL1-CLOCK异二聚体,通过与靶基因启动子调控区E-box增强子相互作用,正向調控包括PER和CRY在内的许多基因的昼夜节律表达。而当PER和CRY蛋白积累到一个临界水平时,它们反过来会进行抑制BMAL1的转录,也抑制了BMAL1-CLOCK复合物的形成。这最终导致了PER和CRY蛋白水平的降低,从而出现了一个新的激活和抑制周期,这就是昼夜节律振荡表达的基本机制。
上述的生物钟反馈环路同样也会受到其他的辅助通路的调控,最典型的一条就是由RORs和REV-ERBs两种转录因子家族通过RORE元件对BMAL1的表达进行调控。RORs作为正调控因子,能通过促进BMAL1的转录,与之相反,REV-ERBs能抑制BMAL1的表达。因此,RORs的缺失将导致异常的昼夜节律行为的出现,其虽然并不是BMAL1或其他生物钟基因表达昼夜节律的关键因子,但确实可以对关键生物钟基因的表达量产生影响。
目前已经发现一些天然化合物可以通过与RORs作用来调节昼夜节律(见图2)——2,3-二氢-3β-甲氧基醉茄素A可作为RORα的拮抗剂,延长细胞的生物周期;肉叶芸香碱通过积累在细胞核中RORα数量来延长生物周期;巴伐卡尔酮可增强RORα的表达,控制BMAL1的昼夜节律转录,并抑制细胞衰老。这些化合物的发现,为研发治疗昼夜节律异常相关疾病的药物提供了参考依据,具有十分重要的意义。
2 代谢调控
昼夜节律与代谢调节之间的关系错综复杂,核心时钟基因的表达量变化造成一系列异常代谢疾病,如肥胖、血脂异常、Ⅱ型糖尿病和动脉粥样硬化。越来越多的证据表明,RORs作为中间体,可以将昼夜节律振荡与体内各种生理代谢过程的循环控制结合起来,如能量稳态的维持、脂质代谢等,从而发挥着重要的调控作用。
研究发现,RORα突变小鼠尽管食物摄入量较高,但它们的体脂指数却比对照小鼠低,具有明显的低脂蛋白血症,这是因为RORα的突变将使脂蛋白脂肪酶的活性大大增加,使得脂类代谢加快。RORγ敲除的小鼠虽然胆固醇和甘油三酯水平未发生改变,其血糖水平却有所降低。
对WT、RORα敲除、RORγ敲除和RORα;RORγ双敲除小鼠肝脏的基因表达谱进行比较,一些基因在敲除小鼠中都只上调或下调,从而发现RORα和RORγ都可以作为代谢基因表达的调控因子,这表明RORα和RORγ之间存在一定程度的功能重复。这可能和它们作为同一家族基因,在与RORE元件的结合亲和度上的相似性有关。
鉴于RORs在代谢调节中的重要作用,调节RORs活性的配体可能在多种代谢疾病的治疗中可以发挥作用。研究人员通过人工合成的方式获得了一种有效的强特异性的RORα拮抗剂——SR3335(见图3),使用SR3335对小鼠进行治疗,小鼠的血糖水平显著降低,而糖异生中限速酶的表达量也出现了降低。
3 T细胞发育调控
机体的健康程度与免疫系统的强弱有直接的关系,而RORs在胸腺生成、次级淋巴组织以及免疫细胞的分化成熟中皆有重要的意义。研究发现,RORα和RORγt在辅助T细胞分化过程中被激活,在辅助T细胞分化中起到了关键作用。
RORγt在辅助T细胞分化中的作用表明,从RORγ缺失小鼠中分离的T17细胞发育受损;相反,外源性RORγt使辅助T细胞能显著增加免疫因子的表达。与RORγt一样,RORα在辅助T细胞分化过程中同样被激活。RORα的缺失将会导致部分免疫因子含量的降低,而外源性RORα则增强了辅助T细胞中免疫因子的表达。另外,同时存在RORα和RORγ缺陷的小鼠完全缺乏T17细胞,并能抑制自身免疫性疾病的发展。
研究人员同样通过人工合成的方式获得了能治疗免疫紊乱相关疾病的RORs拮抗剂——SR1001(见图3),能够直接与RORα和RORγ结合,抑制RORα和RORγ的活性,从而抑制了T17细胞的产生。这意味着此化合物在治疗自身免疫性疾病中能发挥重要作用。
4结语
近年来,随着对RORs的研究逐渐深入,科学家逐渐发现RORs这种核受体家族在生物节律、代谢调节以及在免疫方面的生理功能。作为昼夜节律振荡器的一个子组件,RORs在昼夜节律时钟的控制和代谢基因表达的节律性等方面作出了巨大的贡献,同时参与了免疫器官的发育和辅助T细胞的分化。因此,RORs的缺失或失活将会导致节律异常、代谢紊乱和免疫削弱等各类疾病。
令人惊喜的是,RORs作为转录因子,其对小分子药物极为敏感,RORs缺陷的模式动物的构建也为了RORs可能作为干预这些疾病过程的潜在新靶点提供了可能性。RORs的表達活性可以被小分子配体调节的发现也有力地支持了这一前景。也许在未来的某天,以RORs为靶点的临床用药将会成为治疗相关疾病的新宠儿。
参考文献
[1] Kojetin, D. J., Thomas P.Burris. REV-ERB and ROR nuclear receptors as drug targets[J].Drug Discovery,2014,13(3):197-216.
[2] Tomita, T.,Onishi, Y. Epigenetic Modulation of Circadian Rhythms: Bmal1 Gene Regulation[M]. In Chromatin and Epigenetics; Colin Logie and Tobias Aurelius Knoch, IntechOpen.,2020:125-143.
[3] Deepak Langade, Vaishali Thakare, Subodh Kanchi, et al.Clinical evaluation of the pharmacological impact of ashwagandha root extract on sleep in healthy volunteers and insomnia patients: A double-blind, randomized, parallel-group, placebo-controlled study[J].Journal of Ethnopharmacology,2021,264(1):113276.
[4] Tomita, T., Renu Wadhwa, Sunil C. Kaul,et al.Withanolide Derivative 2,3-Dihydro-3β-methoxy Withaferin-A Modulates the Circadian Clock via Interaction with RORa[J]. Journal of Natural Products,2021, 84(7):1882-1888.
[5] Yoshiaki onishi, Katsutaka oishi, Yasuhiro kawano,et al. The harmala alkaloid harmine is a modulator of circadian Bmal1 transcription[J]. Bioscience Reports,2012,32(1):45-52.
[6] Yanqi Dang, Shuang Ling, Jing Ma, et al. Bavachalcone Enhances RORα Expression, Controls Bmal1 Circadian Transcription, and Depresses Cellular Senescence in Human Endothelial Cells[J], Evidence-Based Complementary and Alternative Medicine 2015,Article ID 920431:11 pages.
[7] Anneleen Segers, Louis Desmet, Theo Thijs,et al. The circadian clock regulates the diurnal levels of microbial short-chain fatty acids and their rhythmic effects on colon contractility in mice[J]. Acta Physiol (Oxf), 2019,225(3):e13193.
[8] Naresh Kumar, Douglas J Kojetin, Laura A Solt,et al. Identification of SR3335 (ML-176): a synthetic RORα selective inverse agonist[J]. ACS Chemical Biology,2011,6(3):218-222.
[9] Liora Haim-Vilmovsky, Johan Henriksson, Jennifer A Walker, et al. Mapping Rora expression in resting and activated CD4+ T cells[J]. PLoS One,2021,16(5):e0251233.
[10] Laura A Solt, Naresh Kumar, Philippe Nuhant,et al. Suppression of TH17 differentiation and autoimmunity by a synthetic ROR ligand[J]. Nature,2011,472(7344):491–494.
中圖分类号:R91DOI:10.16660/j.cnki.1674-098x.2202-5640-7602
基金项目:江苏省“大学生创新创业训练计划(项目编号:202010285135Y)”;国家自然科学基金项目(项目编号:31571204,81701347);江苏省自然科学基金青年项目(项目编号:BK20170351)。
作者简介:李天行(2000—)男,本科在读,研究方向为药物筛选。
杨淼(1999—),女,硕士在读,研究方向为生物化学。
沈硕(1985—),女,本科,研究方向为生物制药。

