实时剪切波弹性成像技术对孕晚期子痫前期胎盘的评估价值
陈 璐,陈 莉,刘志兴
(南昌大学第一附属医院超声医学科,南昌 330006)
子痫前期(preeclampsia,PE)是一种在妊娠20周以后发生的复杂妊娠特异性高血压伴多系统受累及受损的综合征[1-2],是孕产妇和围产期死亡的重要原因。大多数学者[3-5]认为PE的发病机制与胎盘功能不全有关,包括胎盘血管功能障碍、滋养层结构异常、炎症水平升高、遗传及营养等。PE孕妇胎盘血管功能异常引起血流减少、纤维蛋白沉积增多,滋养层结构异常导致胎盘功能及弹性发生改变[6]。剪切波弹性成像技术(shear-wave elastography,SWE)通过测量感兴趣区组织杨氏模量值反映组织弹性硬度,广泛应用于肝脏、宫颈、甲状腺、乳腺、睾丸、腮腺等实质脏器,组织越硬,杨氏模量值越高,而组织硬度增加常反映组织可能发生一系列疾病状态[7]。该技术应用于产科相对较少,本研究通过SWE测量孕晚期PE及健康孕晚期孕妇胎盘杨氏模量值,评估该量值对预测及诊断PE的临床应用价值。
1 资料与方法
1.1 资料收集
连续性收集2017年10月至2018年10月就诊于南昌大学第一附属医院妇产科的PE孕妇76例及正常妊娠监督的孕晚期孕妇210例。患者的既往病史、体格检查、实验室检查等资料均来源于本院电子病历系统数据库。
排除标准:1)后壁胎盘;2)孕妇胎盘及脐带畸形、胎盘内可见粗大钙化等异常;3)胎儿发育畸形或多胎妊娠;4)不良妊娠史;5)重度贫血(HB<60 g·L-1)或合并其他疾病(如糖尿病、肾病等)的孕妇;6)羊水异常。患者均签署知情同意书。
1.2 分组
286例孕妇中55例剔出研究队列,包括23例孕妇胎盘位于后壁,1例胎盘巨大血池,双胎妊娠5例,7例既往有不良妊娠结局史,5例妊娠合并糖尿病,羊水异常12例(羊水多8例,羊水少4例),2例胎死宫内。最终共纳入60例PE孕妇(PE组),171例正常对照组孕妇(正常组)。
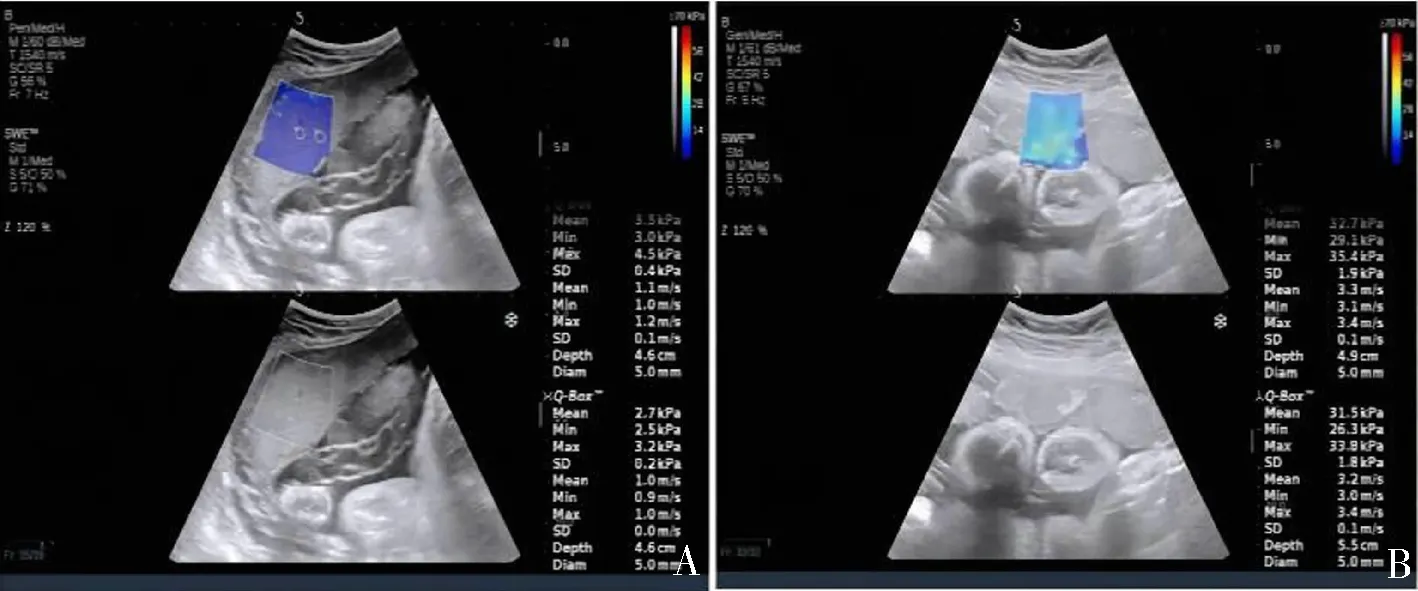
A:正常组孕妇,28岁,孕34+1周,胎盘中央Emean值为2.7 kPa;B:PE组孕妇31岁,孕36周,胎盘中央Emean值为31.5 kPa。
正常组:单胎妊娠,前壁胎盘,孕期血压正常(收缩压<140 mmHg和舒张压<90 mmHg,1 mmHg=0.133 kPa);28~32周50例,>32~36周55例,>36~40周66例,正常组不同孕周孕妇年龄、BMI等比较差异无统计学意义。
PE组:单胎妊娠,前壁、侧壁及宫底壁胎盘,收缩压≥140 mmHg和/或舒张压≥90 mmHg,伴有24 h尿蛋白≥0.3 g,或随机尿蛋白(+)及以上。由妇产科医师根据妊娠期高血压疾病诊疗指南2015版[4]诊断为PE。28~32周11例,>32~36周18例,>36~40周31例。PE组BMI、年龄,血压均高于正常组,且差异具有统计学意义(P<0.05)。见表1。
表1 2组一般资料比较
1.3 仪器设备及检查方法
使用搭配凸阵探头SC 6-1(频率:1~6 MHz)法国声科公司Supersonic Imagine AixPlorer型声蓝系列实时剪切波弹性成像超声诊断仪。
检查方法:孕妇取仰卧位,充分暴露腹部,选择中晚孕检查模式,常规行测量胎儿生长发育指标(股骨长、双顶径、头围、腹围、胎心率),随后对胎儿胎盘进行扫查,观察胎盘位置、分级、胎盘形态等。对符合纳排标准的孕妇进行胎盘杨氏模量值测定,具体方法:探头轻放于皮肤,尽可能与胎盘垂直后,操作过程中禁止施压,扫查至胎盘最大厚度切面,转换至SWE模式,弹性阈值范围设置为0~70 kPa,待图像稳定2~3 s后冻结图像,将感兴趣区域(ROI)(设定Q-BOX直径5 mm)分别放置在中央部分(胎盘中央的1/3)及边缘部分,获得胎盘各部位杨氏模量值Emean。各部位均重复3次测量后取平均值。
1.4 观察指标
2组孕妇均随访至新生儿出生并记录新生儿1 min Apgar评分。均利用SWE测量胎盘不同部位(中央和边缘)的Emean值;比较正常组孕妇不同孕周(28~32周,>32~36周,>36~40周)的胎盘整体Emean值,分析该量值诊断PE的诊断效能,及与新生儿1 min Apgar评分的关系。胎盘整体Emean值=(胎盘边缘Emean值+胎盘中央Emean值)/2。
1.5 统计学方法

2 结果
2.1 2组孕妇胎盘不同部位Emean值比较
2组孕妇胎盘中央和胎盘边缘Emean值比较,差异无统计学意义(P>0.05)。较正常对照组:PE组孕妇胎盘中央和边缘的Emean值更高(P<0.05),PE组孕妇胎盘整体Emean值亦更高(P<0.05)。见表2。2组胎盘中央部位Emean值SWE成像见封四图1。
表2 2组孕妇胎盘不同部位Emean值比较
2.2 正常组孕妇不同孕周的胎盘整体Emean值比较
正常组28~32周、>32~36周、>36~40周孕妇Emean值分别为(6.05±1.24)、(6.39±1.04)、(6.29±1.25)kPa,正常组孕妇不同孕周的胎盘整体Emean值比较,差异无统计学意义(P=0.309)。
2.3 Emean值对PE的诊断效能
胎盘中央、边缘、整体Emean值诊断PE的ROC曲线下面积(AUC)、其敏感性及特异性见表3、封四图2。

图2 胎盘不同部位的Emean值诊断PE的ROC曲线 图3 PE组胎盘整体Emean值与新生儿1 min Apgar评分散点图

表3 不同部位胎盘Emean值诊断PE的ROC诊断效能
2.4 PE组胎盘整体Emean值与新生儿1 min Apgar评分
PE组孕妇胎盘整体Emean值与新生儿1 min Apgar评分无关(r=0.037,P=0.779),见封四图3。
3 讨论
SWE是基于“马赫锥”现象,由超高速成像技术收集组织横向传播的横波并计算其速度,通过彩色编码的二维图像可直接测量组织杨氏模量值,颜色越红提示组织越硬。与应变式弹性成像及声脉冲辐射力弹性成像技术相比具有重复性高、受操作者经验影响小等优点,越来越多地被应用于临床的诊断[8],如SWE评价肝纤维化程度可有效减少对肝活检的依赖[9],而乳腺恶性结节由于其恶性细胞数量增多致密且浸润周围组织,使其变性,硬度也随之增高[10]。
本研究发现2组孕妇中央区及边缘区胎盘弹性值比较,差异无统计学意义(P>0.05),胎盘是构成蜕膜和绒毛膜板的富含血管的组织网,其随孕周变化或病变(如高血压)因素影响程度是均一的,因此胎盘中任意一点的弹性值均可代表整个胎盘,与相关报道一致[11-15]。本研究中PE组胎盘杨氏模量值较正常组高,PE组胎盘硬度增高可能是因为胎盘血管功能障碍及滋养层结构异常,孕妇胎盘缺血缺氧,刺激胶原沉积、血管纤维蛋白沉积以及纤维化发生。
国内有学者[16]比较妊娠晚期高血压患者与正常孕妇胎盘不同部位(中央与边缘)的弹性值,结果显示胎盘中央与边缘弹性值差异均有统计学意义(P<0.05);本研究发现,健康孕妇和PE孕妇胎盘中央和胎盘边缘Emean值比较,差异均无统计学意义(P>0.05),两者结果存在一定的差异。为进一步探寻更多的诊疗信息,本研究发现SWE技术测量胎盘中央、边缘和整体杨氏模量值诊断PE病变的ROC曲线下面积分别为0.915、0.896、0.908。KILIÇ等[17]使用SWE评估PE患者胎盘,发现PE孕妇胎盘杨氏模量值明显增高,得出PE诊断的最佳SWE Emean截断值为7.35 kPa,其敏感性,特异性和准确性分别为90%、86%和88%;此外,该作者使用SWE评估PE患者胎盘的弹性,发现PE患者胎盘硬度明显比正常对照组增高(P<0.05),因此认为SWE可作为PE患者胎盘评估的辅助诊断技术。SUGITANI等[13]研究声辐射力弹性成像技术测量离体胎盘硬度,发现胎儿生长受限组的离体胎盘杨氏模量值明显大于正常妊娠组胎盘(P<0.05),继而提出应用SWE可评估体内胎盘功能。另有学者[12]采用SWE评估早发型PE患者的胎盘弹性,发现早发型患者的胎盘杨氏模量值明显高于正常对照者(P<0.05)。以上结果与本研究结果相类似,因此笔者认为SWE可成为临床评价胎盘功能的辅助技术。
有文献[6]指出,在胎儿生长受限或PE孕妇胎盘中可观察到合胞体周围的纤维蛋白样物质的沉积。既往认为胎盘老化其超声表现多为胎盘实质内可见钙化灶,而在乳腺及甲状腺结节内研究中发现大多数含钙化结节较无钙化者杨氏模量值偏高,大多数学者认为钙化出现可能影响其杨氏模量值[18]。本研究对孕晚期健康孕妇不同孕周胎盘杨氏模量值进行比较,结果显示不同孕周孕妇的胎盘整体Emean值比较,差异无统计学意义(P=0.309),提示胎盘杨氏模量值与胎盘老化相关性不高;张维维等[19]亦对胎盘钙化是否对弹性杨氏模量值有影响进行探讨,结果显示Ⅱ级及Ⅲ级胎盘钙化对胎盘弹性杨氏模量无影响,与本研究结果相类似。但也有学者[20]提出,晚孕期胎盘内钙化灶是否影响胎盘杨氏模量值仍然需增大样本量进一步研究。由于本研究排除胎盘粗大钙化孕妇,且在成像过程中也避开胎盘钙化处,因此钙化是否对胎盘硬度有关系,后期需加大样本量进一步研究分析。
本研究随访追踪发现,PE孕妇胎盘杨氏模量值与新生儿1 min Apgar评分无关,这与袁胜美等[16]观点一致,其原因可能是纳入的新生儿预后均较好、缺乏重症患儿及Apgar评分具有一定主观性。
超声作为一项无创诊疗技术长期运用于诊断妊娠期病理状况,有效避免放射性成像或侵入性检查,SWE频率与彩超相当,对妊娠期胎儿无明显不良影响,且多项研究[17-23]均表明SWE评估胎盘硬度不会危害胎儿。总之,SWE可实时、定量评估胎盘硬度,SWE成像具有稳定性高、重复性好、分辨力高的特点,操作简单且价廉等,为临床早期预测及诊断子痫前期提供参考。

