慢性心力衰竭患者血清SDC4、CatS水平与心室重构及预后的关系
张海平,赵静敏,屠艳辉,刘京,杜雪莉,何靖蕊
慢性心力衰竭(chronic heart failure,CHF)一直是心血管领域治疗学的难题,我国35岁及以上人群中CHF患者约1 370万例,中重度CHF病死率高达50%,疾病负担严重[1]。目前CHF发病机制尚未完全阐明,临床普遍使用心脏动力学标志物B型脑利钠肽(B-type brain natriuretic peptide,BNP)对CHF进行诊断和预后评估,但BNP易受诸多非心源性疾病影响,还需开发其他生物标志物,以进一步阐明CHF发生发展机制[2]。心室重构是CHF基本病理生理表现,与炎性反应、心肌成纤维细胞增殖和细胞外基质重塑等密切相关[3]。多配体蛋白聚糖4(syndecan-4,SDC4)是一种跨膜糖蛋白,能结合多种配体介导炎性反应、细胞增殖和细胞外基质黏附[4]。研究发现,SDC4在糖尿病性心肌病小鼠中升高,并与小鼠心脏功能损害密切相关[5]。组织蛋白酶S(cathepsin S,CatS)是一种半胱氨酸蛋白酶,能通过水解肽链降解蛋白质介导炎性反应、细胞增殖、细胞外基质重塑等过程[6]。研究发现,CatS在糖尿病合并冠心病患者中升高,是糖尿病合并冠心病患者并发心力衰竭的独立危险因素[7]。目前,关于血清SDC4、CatS与CHF患者心室重构及预后的关系尚缺乏报道,现分析CHF患者血清SDC4、CatS水平变化,探讨二者与心室重构及预后的关系,报道如下。
1 资料与方法
1.1 临床资料 选取2020年1月—2021年8月唐山市人民医院心内科收治的182例CHF患者为CHF组。男98例,女84例,年龄36~82(62.69±10.48)岁;体质量指数18~28(22.57±2.13)kg/m2;纽约心脏病协会(New York Heart Association,NYHA)分级[8]:Ⅰ级53例,Ⅱ级54例,Ⅲ级45例,Ⅳ级30例。另选取同期医院体检健康者52例为健康对照组,男28例,女24例,年龄45~83(60.92±8.60)岁;体质量指数18~26(22.41±1.95)kg/m2。2组性别、年龄、体质量指数等资料比较差异无统计学意义(P>0.05),具有可比性。CHF组根据随访6个月预后情况再分为预后不良亚组56例与预后良好亚组126例。预后不良亚组患者年龄、病程、NYHA分级≥Ⅲ级比例、BNP、LVEDD、RVD、LVMI水平高于预后良好亚组,LVEF、LVFS低于预后良好亚组(P<0.01),见表1。本研究经医院伦理委员会批准(2020-024),受试者及家属均知情同意并签署知情同意书。
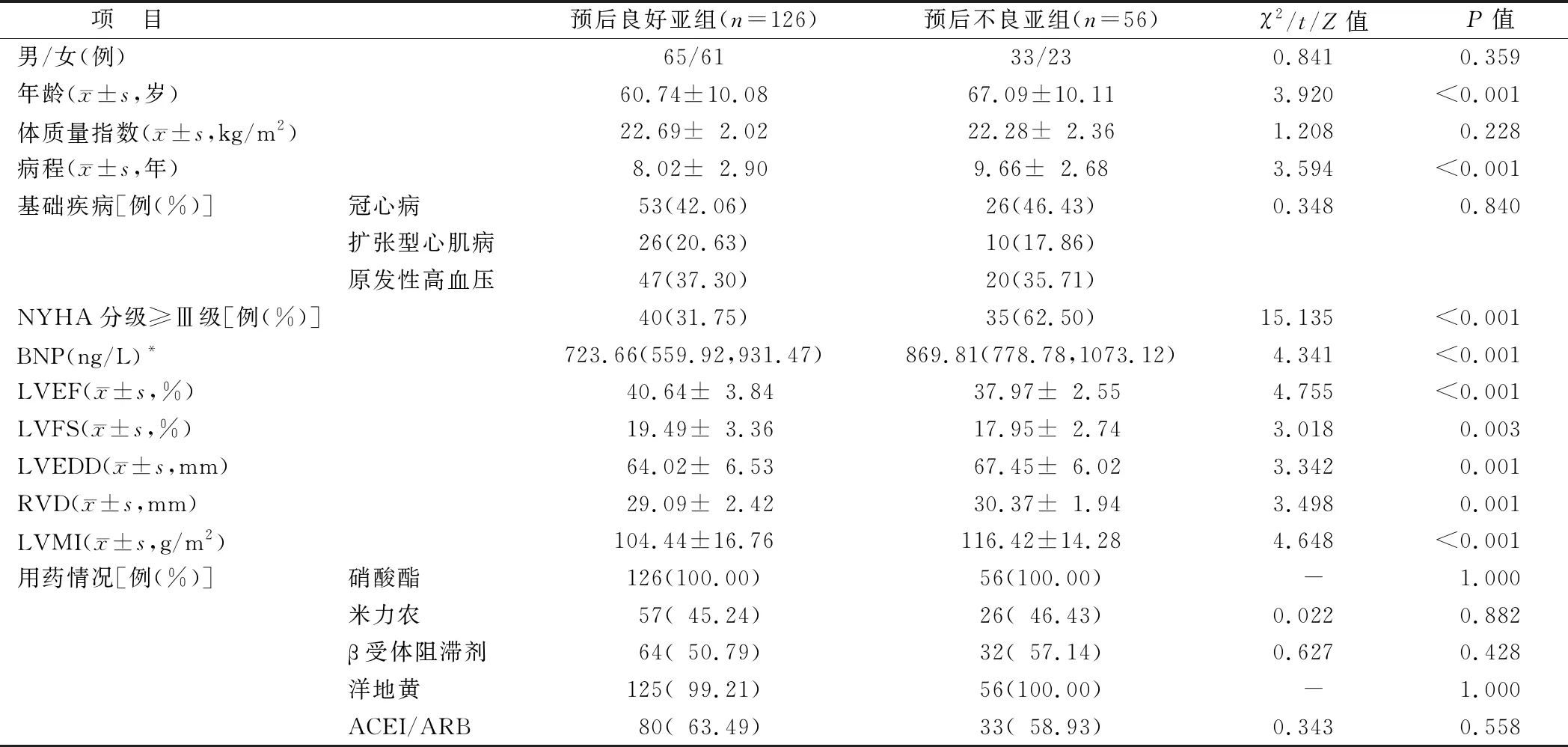
表1 预后良好亚组及预后不良亚组CHF患者临床资料比较
1.2 病例选择标准 (1)纳入标准:①符合“慢性心力衰竭基层诊疗指南(2019年)”[8]中CHF诊断标准;②年龄≥18岁。(2)排除标准:①临床资料不完整;②急性心力衰竭;③妊娠期及哺乳期妇女;④合并造血、免疫系统损害;⑤合并严重肝肾功能不全;⑥恶性肿瘤;⑦先天性心脏疾病;⑧院内死亡。
1.3 观测指标与方法
1.3.1 血清BNP、SDC4、CatS水平检测:患者入院后次日清晨和健康对照组体检时采集空腹肘静脉血6 ml,离心取上清存于-80℃冰箱内待检。采用酶联免疫吸附法检测血清BNP、SDC4、CatS水平,试剂盒购自武汉华美生物工程有限公司,所有操作严格按照试剂盒说明书进行。
1.3.2 心室重构指标:CHF患者入院后12 h内采用深圳迈瑞生物医疗电子股份有限公司生产的DC-N2T型彩色多普勒超声诊断仪(探头频率2~4 MHz,帧频>60/s)进行超声心动图检查。协助患者取左侧卧位,二维超声在心尖四腔心切面以单平面Simpson法测定左心室射血分数(left ventricular ejection fraction,LVEF);取胸骨旁左心室长轴M型超声测量左心室后壁厚度(left ventricular posterior wall thickness,LVPWT)、左心室短轴缩短率(left ventricular fractional shortening,LVFS)、左心室舒张末期内径(left ventricular end diastolic diameter,LVEDD)、舒张期末室间隔厚度(interventricular septal thickness,IVST);取胸骨旁右心室流入道长轴切面M型超声记录右心室内径(right ventricular diameter,RVD)。采用校正Devereux公式计算左心室质量指数(left ventricular mass index,LVMI)=0.8×{1.04×[(IVST+LVEDD+LVPWT)3-LVEDD3]}/体表面积[9],超声心动图检查所有参数均连续测量3个心动周期,取平均值。
1.3.3 预后情况:CHF患者入院后根据诊疗指南[8]接受相关治疗,病情稳定出院后通过门诊或电话随访6个月,统计心源性死亡和再发CHF入院比例。182例CHF患者中心源性死亡22例,再发CHF入院34例。

2 结 果
2.1 各组血清SDC4、CatS水平比较 CHF组血清SDC4、CatS水平高于健康对照组,预后不良亚组血清SDC4、CatS水平高于预后良好亚组(P<0.01),见表2。

表2 组间及亚组间血清SDC4、CatS水平比较
2.2 2组BNP水平及心室重构指标比较 CHF组 BNP水平、LVEDD、RVD、LVMI高于健康对照组,LVEF、LVFS低于健康对照组(P<0.01),见表3。

表3 CHF组与健康对照组BNP水平及心室重构指标比较
2.3 CHF患者血清SDC4、CatS水平与BNP水平、心室重构指标的相关性 Pearson/Spearman相关性分析显示,CHF患者血清SDC4、CatS水平与BNP、LVEDD、RVD、LVMI呈正相关,与LVEF、LVFS呈负相关(P<0.01),见表4。
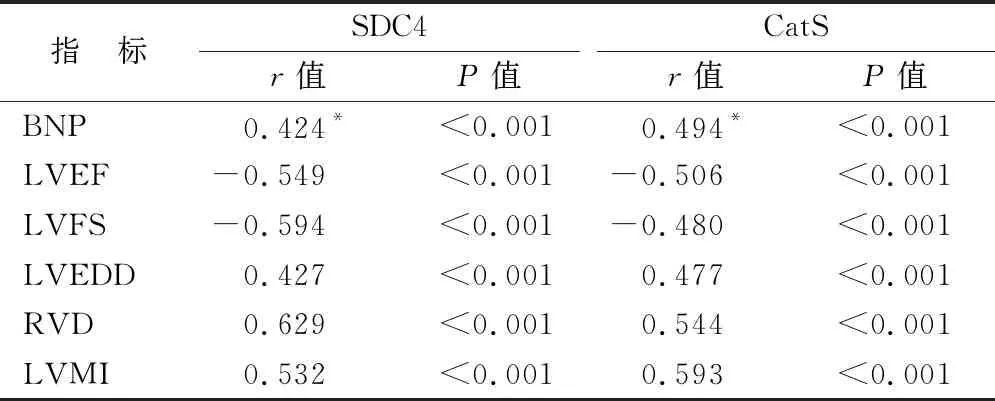
表4 CHF患者血清SDC4、CatS水平与BNP水平、心室重构指标的相关性
2.4 CHF患者预后不良的多因素Logistic回归分析 将表1~3中P<0.05者为自变量,以预后为因变量,多因素Logistic回归分析显示,病程长、NYHA分级≥Ⅲ级、LVEDD高、LVMI高、SDC4高、CatS高为CHF患者预后不良的独立危险因素,LVEF高为独立保护因素(P<0.01),见表5。
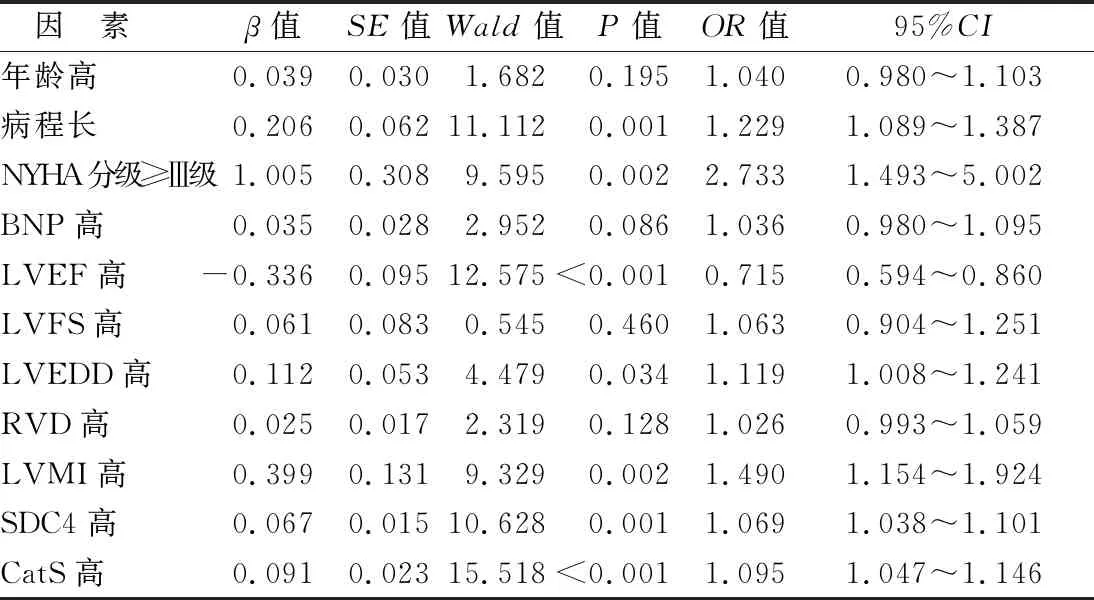
表5 CHF患者预后不良的多因素Logistic回归分析
2.5 血清SDC4、CatS水平对CHF患者预后不良的预测价值 ROC曲线显示,血清SDC4、CatS水平联合预测CHF患者预后不良的AUC大于SDC4、CatS单独预测(Z=2.832、3.100,P=0.005、0.002),见表6、图1。

表6 血清SDC4、CatS水平对CHF患者预后不良的预测价值
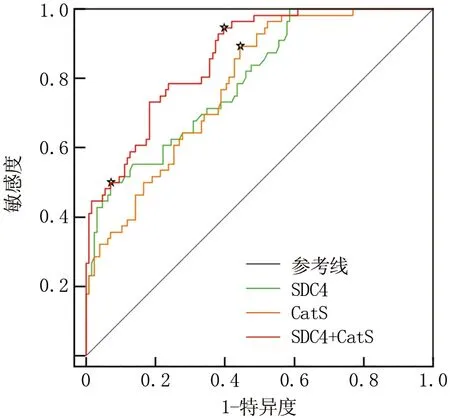
图1 血清SDC4、CatS水平预测CHF患者预后不良的ROC曲线
3 讨 论
CHF是在原有慢性心脏疾病上发展至心力衰竭症状和体征的一组复杂临床综合征,以呼吸困难、乏力和液体潴留为主要临床表现,近年来随着人口老龄化加剧和急性心血管疾病诊疗的进展,CHF患病率逐年上升[10]。尽管近年来CHF患者药物治疗取得了进展,出现了鸟苷酸环化酶激活剂、窦房结起搏电流通道阻滞剂、选择性钠—葡萄糖协同转运蛋白抑制剂等药物,但仍有部分患者疗效欠佳。另一方面,晚期CHF虽然可采取心脏移植疗法,但受限于心脏供体和技术等原因,不能普遍开展,因此CHF患者预后不容乐观[11]。本研究中,182例患者在病情稳定出院后,仍有30.77%(56/182)的患者在6个月内出现心源性死亡或再发CHF入院,也提示CHF患者预后较差。早期评估CHF患者预后有助于指导个体化治疗,降低医疗费用和改善预后。
心室重构指心室持续发生大小、形态、结构和功能的改变过程,涉及成纤维细胞增殖和分化、炎性反应、神经内分泌系统激活、心肌细胞外基质增多或过度沉积、心肌细胞凋亡等机制,是决定CHF预后的主要因素[3]。SDC4是细胞表面硫酸乙酰肝素蛋白聚糖家族的一个成员,由核心蛋白和糖胺聚糖侧链组成,广泛表达于多个组织中,参与调控细胞与细胞间作用、细胞与细胞外基质作用及细胞增殖、黏附、分化、迁移等功能[4]。在主动脉弓缩窄诱导的小鼠心力衰竭模型中,SDC4基因被敲除后,心力衰竭小鼠心肌细胞明显缩小,左心室功能明显恶化[12]。另一项主动脉束带诱导的小鼠心肌肥厚模型中,敲除SDC4基因的小鼠舒张功能被动增加反应明显减弱[13]。上述研究提示,SDC4对心脏功能具有保护作用。临床多采用心脏彩色超声评估CHF患者心功能和心室重构情况,心室重构后可表现为RVD、LVEDD、LVMI升高,LVFS、LVEF降低。BNP主要由心房细胞分泌,心肌受损后会立即释放进入血液,是反映心肌容量负荷和预后最经典的标志物[2]。本研究结果显示,CHF患者血清SDC4水平明显升高,与BNP、LVEDD、RVD、LVMI呈正相关,与LVEF、LVFS呈负相关,提示血清SDC4升高参与CHF发生,并与CHF患者心室重构有关。这与既往实验结论中SDC4在心脏中发挥保护作用不一致。研究表明,SDC4在近质膜区存在酶切位点,在炎性反应、细胞外基质的作用下能从胞外区脱落进入体液中[14]。因此笔者推测是CHF发生后激活的炎性反应和细胞外基质重构引起SDC4大量脱落至体液,导致SDC4对心脏保护作用降低,故血清SDC4水平越高患者心室重构情况越严重。近期实验也表明,SDC4能通过结合心脏成纤维细胞,保护骨桥蛋白不被凝血酶切割而发挥抑制心脏纤维化和保护心功能作用,但当SDC4从胞外区脱落后这种保护作用就会丧失,从而导致心脏纤维化和心室重构[15]。
CatS是半胱氨酸蛋白酶家族的主要成员之一,具有木瓜蛋白酶家族相似晶体结构,主要表达于组织相容性复合物Ⅱ的细胞中,不仅能通过降解蛋白质参与细胞外基质重塑,还在机体炎性反应、细胞增殖、血管生成、组织修复等病理生理中发挥重要的调节作用[16]。研究发现,心肌缺血/再灌注损伤后左心室组织中CatS表达显著上调,抑制CatS表达能通过抑制白介素-1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)表达和细胞凋亡减轻心肌缺血/再灌注损伤,保护心脏功能[17]。在左前降支冠状动脉结扎制备的小鼠心肌梗死模型中,CatS于受损心脏中高度表达,使用小干扰RNA敲低CatS基因能缩小梗死区域,并逆转细胞外基质更新、降解紊乱诱导的心室重构[18]。本研究结果显示,CHF患者血清CatS水平明显升高,与BNP、LVEDD、RVD、LVMI呈正相关,与LVEF、LVFS呈负相关,提示CatS升高参与CHF发生,并与CHF患者心室重构有关,分析与CatS能通过多种机制参与心室重构有关。CatS能通过激活核因子κB信号通路增加IL-1β、IL-6、TNF-α等促炎细胞因子表达,促进心肌细胞凋亡导致心室重构[19]。CatS能通过激活Smad2、Smad3促进成纤维细胞分化和破坏细胞外基质更新、降解平衡,导致心室重构[20]。本研究结果还显示,BNP并不是CHF患者预后不良的独立危险因素,既往研究也指出,BNP并不能反映心力衰竭患者预后,可能与BNP半衰期时间较短且易受药物影响有关[21]。心室重构是决定CHF患者预后的主要因素,本研究中血清SDC4、CatS水平与心室重构密切相关,因此笔者推测血清SDC4、CatS水平能反映CHF患者预后。本研究结果也显示,血清SDC4、CatS水平随着CHF预后不良风险增加而升高,说明血清SDC4升高参与CHF患者预后不良发生。ROC结果发现,血清SDC4、CatS水平均对CHF患者预后不良具有一定预测价值,提示SDC4、CatS可能成为CHF患者预后不良新的预测标志物,并且血清SDC4、CatS水平联合预测CHF患者预后不良的AUC较单项预测的AUC明显增加。
综上所述,CHF患者血清SDC4、CatS水平升高,与心室重构和预后不良密切相关,可作为CHF患者预后不良的辅助预测指标。但还需前瞻性多中心研究进一步证实,深入研究血清SDC4、CatS参与心室重构并影响CHF患者预后不良的机制。
利益冲突:所有作者声明无利益冲突
作者贡献声明
张海平:研究构思,统计分析,论文撰写;赵静敏:课题设计,数据获取,论文终审;屠艳辉、刘京、杜雪莉、何靖蕊:课题设计,参与撰写,论文修改

