芩黄方对DLBCL患者R-CHOP方案化疗后免疫功能的影响
阮 铭,林 瀚,王剑飚,吕玲玲,朱文华,徐佳悦,李维丽,朱伟嵘
(1.上海交通大学医学院附属瑞金医院中医科,上海 200025;2.上海交通大学医学院附属瑞金医院检验科,上海 200025;3.上海交通大学医学院,上海 200025)
淋巴瘤是一种起源于淋巴造血系统,并可累及全身各器官的恶性肿瘤。在我国,每年新增的非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)病例约为88 000例[1]。弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是临床最常见的NHL,其发生、发展与免疫损伤密切相关。近年来,由于利妥昔单抗的广泛应用,NHL患者获益明显,利妥昔单抗联合环磷酰胺+多柔比星+长春新碱+泼尼松(R-CHOP)方案被美国国家综合癌症网络(the National Comprehensive Cancer Network,NCCN)指南推荐为针对CD20阳性的多种类型淋巴瘤的一线化疗方案[2]。但目前使用的化疗方案均会导致患者出现不同程度的免疫功能紊乱,造成疗效和患者免疫功能下降。因此,寻找 R-CHOP方案治疗后免疫功能恢复的方法,有助于提高淋巴瘤患者的治疗效果和生活质量。本课题组前期通过小样本的随机对照研究发现芩黄(方黄芩、黄芪、姜黄、夏枯草)对DLBCL患者化疗后免疫功能损伤有明显的保护作用[3]。为进一步明确DLBCL患者长期随访期间免疫功能的动态变化,及采用中药治疗后免疫功能的恢复情况,本研究对DLBCL患者随访5年的临床数据进行分析,探讨芩黄方对其免疫功能的影响。
1 材料和方法
1.1 研究对象
选取2015年1月—2019年12月上海交通大学医学院附属瑞金医院确诊的行R-CHOP方案化疗的DLBCL患者300例,其中男164例、女136例,年龄19~91岁。根据化疗后是否接受芩黄方治疗分为中药治疗组[150例,其中男83例、女67例,年龄(59.36±13.60)岁;至少接受过6个月的芩黄方治疗]和对照组[150例,其中男81例、女69例,年龄(56.08±13.66)岁;未行中药治疗]。纳入标准:(1)符合DLBCL诊断标准[4];(2)年龄>18岁;(3)完成R-CHOP方案化疗。排除标准:(1)有其他恶性肿瘤史;(2)于外院接受其他中药治疗;(3)接受芩黄方的治疗时间<6个月。2个组之间年龄和性别差异均无统计学意义(P>0.05)。本研究经上海交通大学医学院附属瑞金医院伦理委员会批准,所有患者均知情同意。
1.2 治疗方案
所有患者均接受R-CHOP方案化疗,每21天为1个疗程,共6~8个疗程。中药治疗组在化疗结束后以芩黄方为基础,根据患者病情辨证论治,随证加减,治疗时间≥6个月。
1.3 方法
1.3.1 一般资料收集 通过医院信息系统收集所有患者的一般资料,包括年龄、性别、体力评分、肿瘤分期(Ann Arbor法)、分子分型(生发中心型、非生发中心型)、国际预后指数(international prognostic index,IPI)评分[5]。
1.3.2 免疫功能检测 采集所有患者化疗前、化疗3个月、化疗结束时、化疗结束后3个月、化疗结束后6个月、化疗结束后1年、化疗结束后2年的静脉血,检测T细胞亚群(CD3+T细胞、CD4+T细胞、CD8+T细胞绝对值及CD4/CD8比值)和IgG、IgA、IgM水平。采用FACSCantoⅡ流式细胞仪(美国BD公司)及配套试剂检测T细胞亚群。采用IMMAGE 800特定蛋白分析仪(美国贝克曼库尔特公司)及配套试剂(速率散射比浊法)检测IgG、IgA、IgM。
1.4 统计学方法
采用SPSS 18.0软件进行统计分析。呈正态分布的计量资料以±s表示,2个组之间比较采用t检验。呈非正态分布的计量资料以中位数(M)[四分位数(P25~P75)]表示,组间比较采用秩和检验。计数资料以例或率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 中药治疗组与对照组一般资料比较
中药治疗组与对照组体力评分、肿瘤分期、分子分型、IPI评分差异均无统计学意义(P>0.05)。见表1。
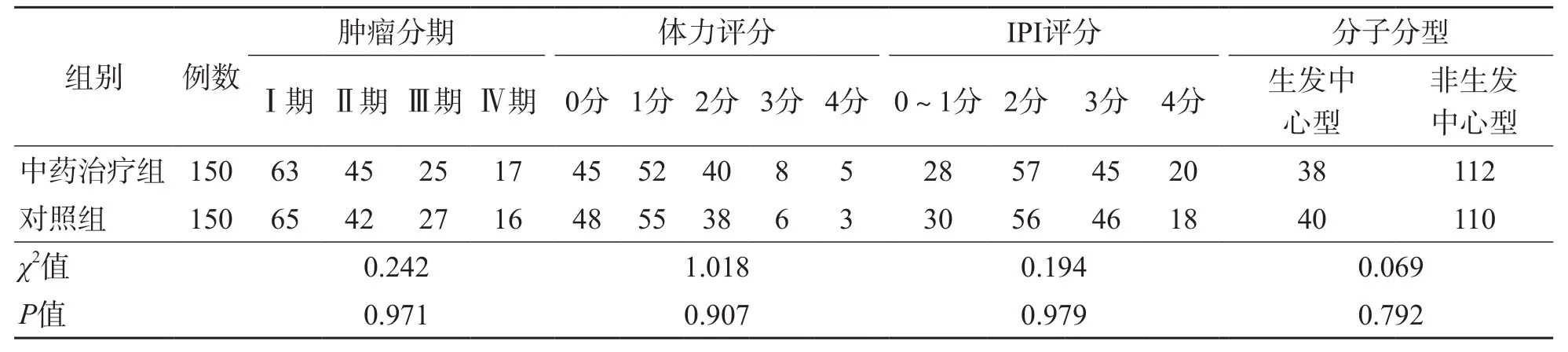
表1 中药治疗组与对照组一般资料比较 例
2.2 DLBCL患者不同时间点各项指标的比较
DLBCL患者化疗结束时CD3+T细胞和CD4+T细胞绝对值显著低于化疗前(P<0.05),化疗结束6个月显著高于化疗3个月(P<0.05);化疗3个月CD8+T细胞绝对值和CD4/CD8比值显著低于化疗前(P<0.05),停止化疗后呈升高趋势,但差异均无统计学意义(P>0.05);IgA、IgG化疗后较化疗前明显下降(P<0.05),化疗结束后2年明显升高(P<0.05);IgM化疗后各时间点较化疗前显著降低(P<0.05),化疗结束后随访2年未见明显变化,各时间点差异均无统计学意义(P>0.05)。见表2。
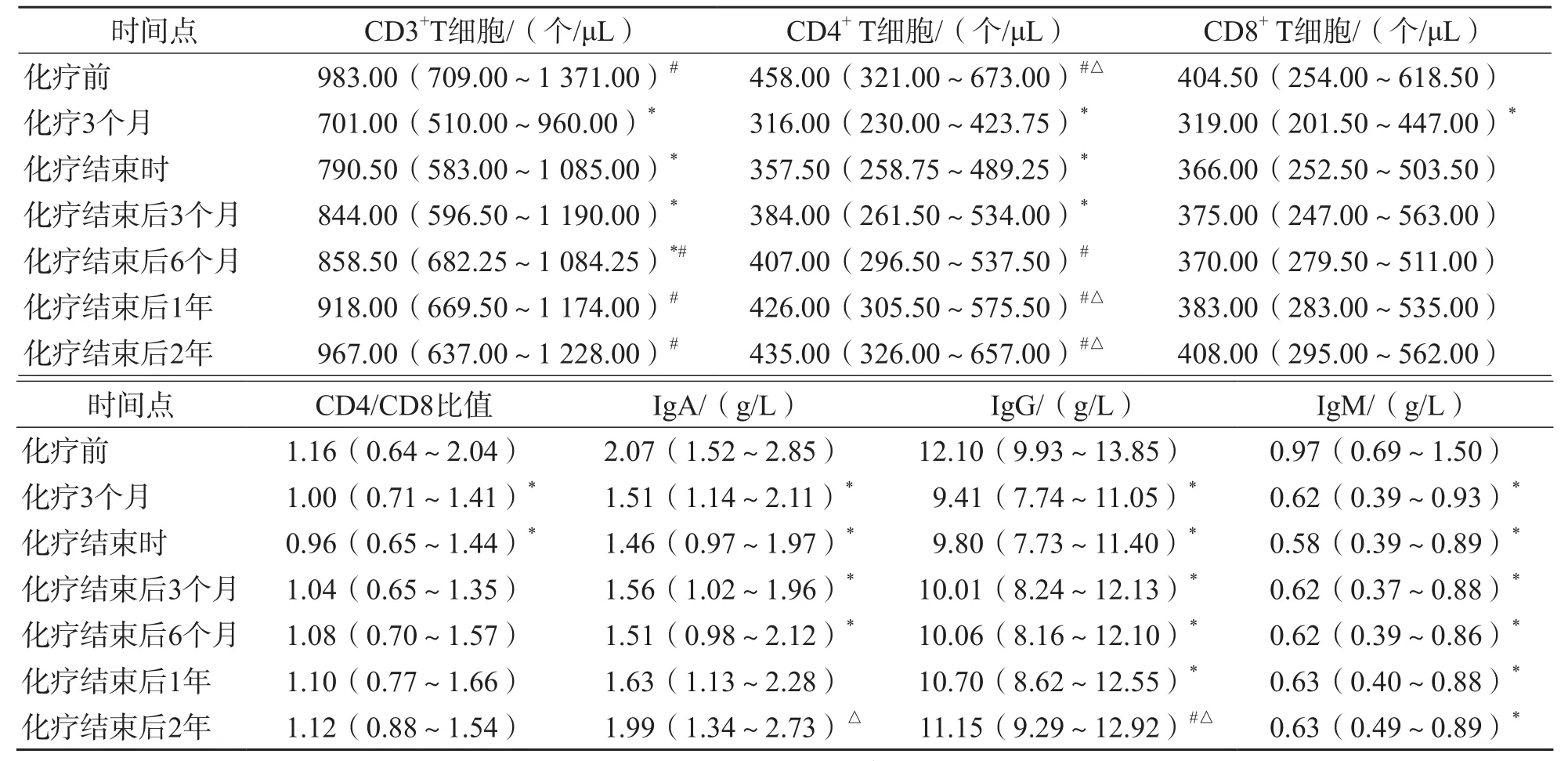
表2 DLBCL患者不同时间点各项指标的比较
2.3 中药治疗组与对照组不同时间点CD3+T细胞、CD4+T细胞、CD8+T细胞及CD4/CD8比值比较
与化疗前比较,中药治疗组和对照组化疗结束时CD3+T细胞、CD4+T细胞及CD4/CD8比值均显著降低(P<0.05);中药治疗组CD3+T细胞化疗结束后1年恢复到化疗前水平(P>0.05);对照组化疗结束后CD3+T细胞绝对值与化疗3个月比较,差异无统计学意义(P>0.05),化疗结束后2年仍低于化疗前(P<0.05)。中药治疗组和对照组CD4+T细胞绝对值化疗结束后1年与化疗前差异无统计学意义(P>0.05)。中药治疗组和对照组CD8+T细胞绝对值化疗结束后各时间点差异均无统计学意义(P>0.05)。中药治疗组化疗结束后1年的CD4/CD8比值与化疗前差异无统计学意义(P>0.05),对照组化疗结束后2年仍低于化疗前(P<0.05)。见表3~表6。
中药治疗组与对照组比较,各时间点CD3+T细胞、CD4+T细胞、CD8+T细胞绝对值差异均无统计学意义(P>0.05)。中药治疗组化疗结束后6个月、化疗结束后1年、化疗结束后2年的CD4/CD8比值均显著高于对照组(P<0.05)。见表3~表6。
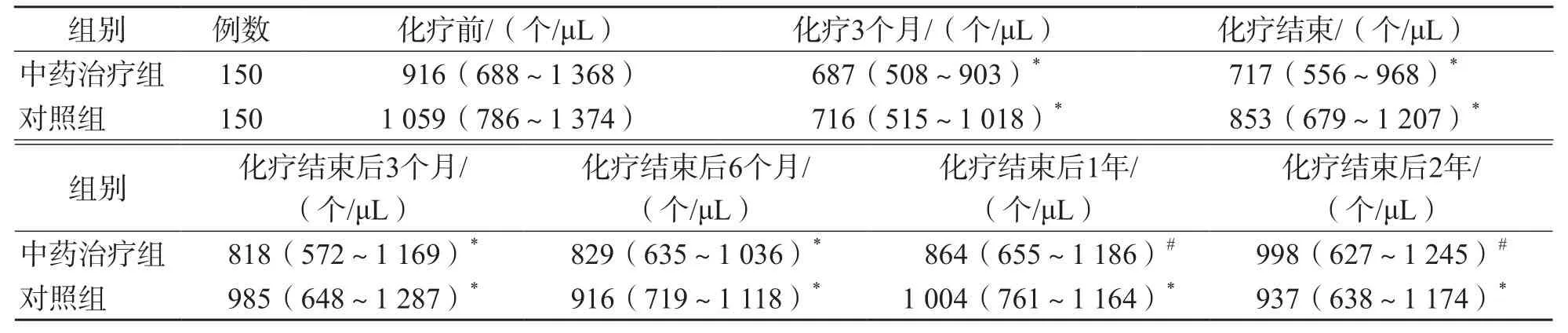
表3 中药治疗组与对照组不同时间点CD3+T细胞绝对值比较
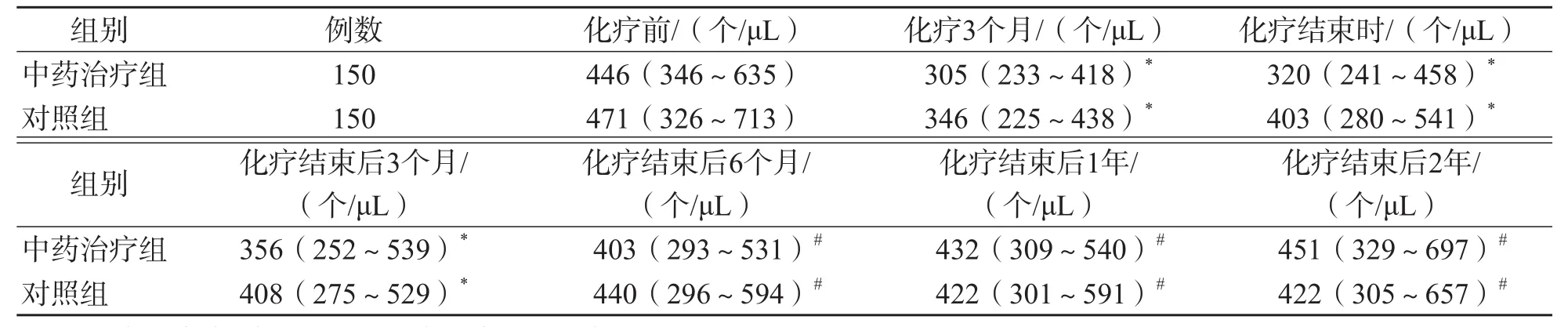
表4 中药治疗组与对照组不同时间点CD4+T细胞绝对值比较

表5 中药治疗组与对照组不同时间点CD8+T细胞绝对值比较
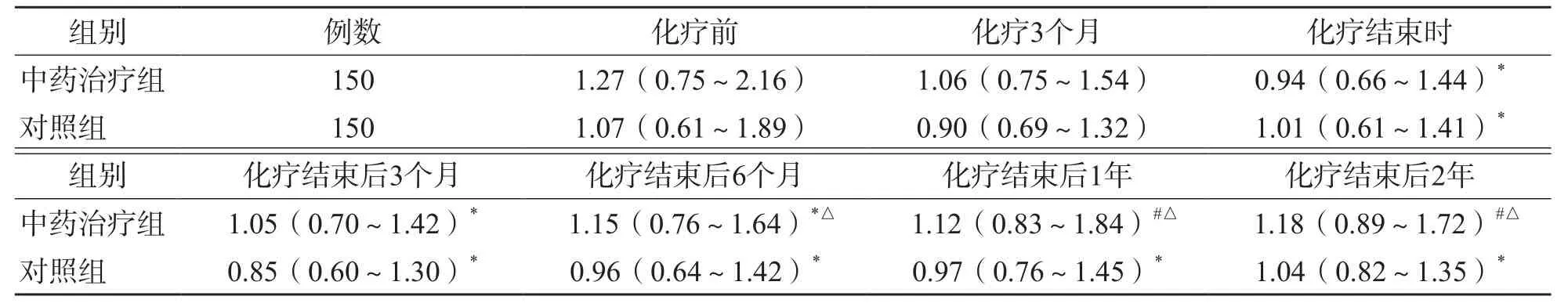
表6 中药治疗组与对照组不同时间点CD4/CD8比值比较
中药治疗组化疗结束后2年CD3+T细胞、CD4+T细胞绝对值及CD4/CD8比值与化疗3个月的差值,即升高程度显著高于对照组(P<0.05),CD8+T细胞绝对值的升高程度2个组之间差异无统计学意义(P>0.05)。见表7。

表7 中药治疗组与对照组化疗结束后2年与化疗3个月各项指标差值的比较
2.4 中药治疗组与对照组不同时间点IgG、IgA、IgM水平比较
中药治疗组和对照组化疗结束时IgG、IgA、IgM水平均显著低于化疗前(P<0.05);化疗结束后2年I g G水平才升高至化疗前水平(P>0.05),且显著高于化疗3个月(P<0.05);化疗结束后1年IgA水平与化疗前比较差异无统计学意义(P>0.05);化疗结束后2年IgM水平仍低于化疗前(P<0.05)。中药治疗组与对照组比较,各时间点IgG、IgA、IgM水平差异均无统计学意义(P>0.05)。中药治疗组与对照组之间化疗结束后2年IgG、IgA、IgM水平较化疗3个月的升高程度差异均无统计学意义(P>0.05)。见表8~表11。
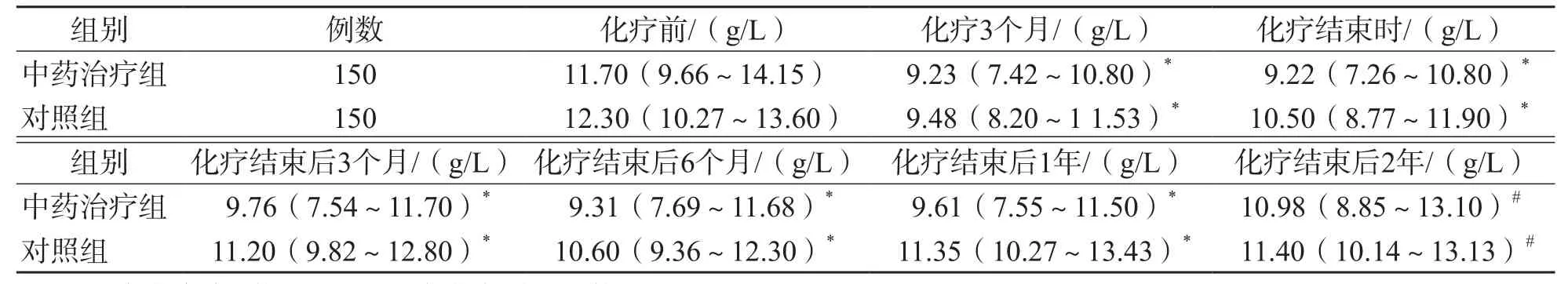
表8 中药治疗组与对照组不同时间点IgG水平比较
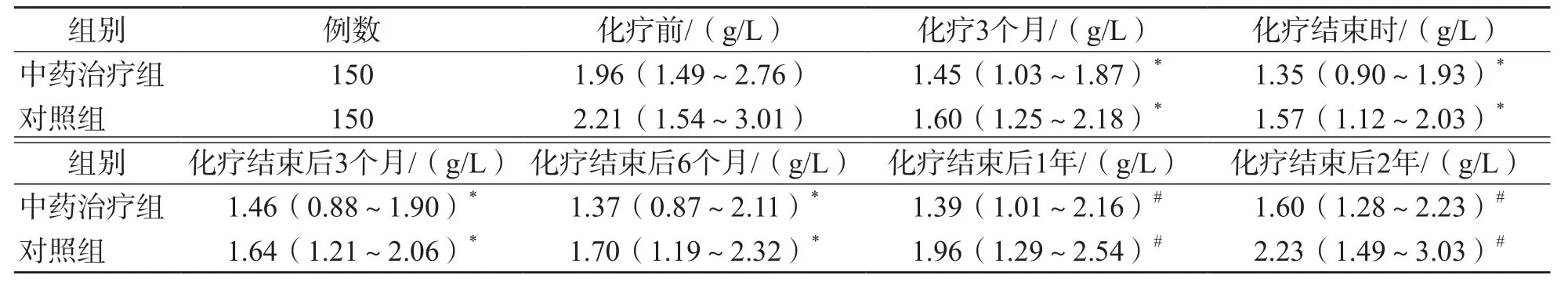
表9 中药治疗组与对照组不同时间点IgA水平比较
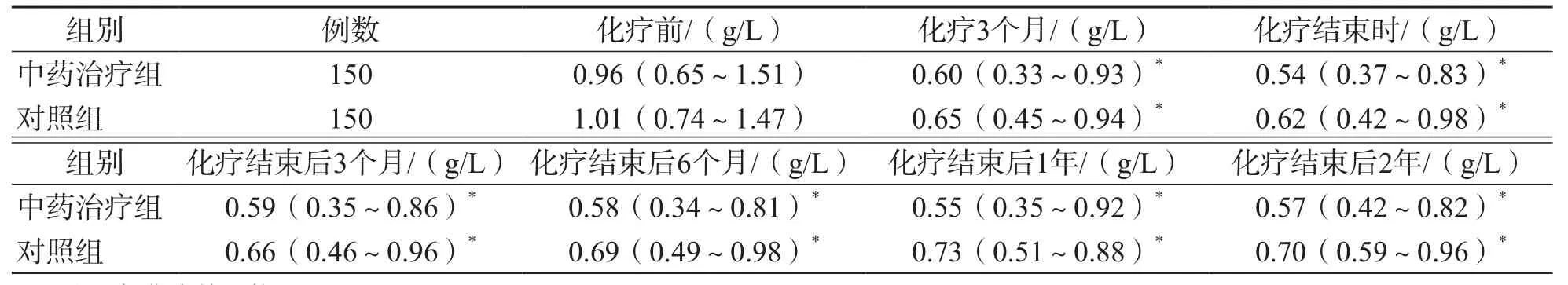
表10 中药治疗组与对照组不同时间点IgM水平比较

表11 中药治疗组与对照组化疗结束后2年与化疗3个月IgG、IgA、IgM差值比较
3 讨论
DLBCL属于中高危侵袭性NHL,疾病进展较迅速。随着靶向联合化疗方案的广泛应用,淋巴瘤患者在治疗过程中常伴随着程度不一的免疫功能紊乱[6-7],导致并发感染的风险增高,影响预后。
有研究结果显示,R-CHOP方案治疗1周期后,DLBCL患者外周血中CD19+、CD20+B细胞基本消失,直到6个月后会才出现,CD4+T细胞在6个周期的化疗后降至最低[8]。DLBCL患者使用R-CHOP方案化疗后细胞免疫功能紊乱、体液免疫抑制主要表现为CD3+CD4+辅助性T细胞及表达共刺激分子的CD4+CD28+辅助性T细胞、CD4+CD45RA+纯真T细胞受抑制,CD4/CD8比值下降,IgG、IgA、IgM、IgE水平显著降低[3]。CD4+T细胞绝对值降低可作为DLBCL独立的预后不良指标[9]。因此,为了了解DLBCL患者病情的变化、评估化疗效果及预后转归,本研究对其免疫功能进行了动态监测。
中医古籍中无“淋巴瘤”这一病名,目前常将淋巴瘤归属于“恶核”“失荣”“阴疽”等范畴,治疗多从益气扶正、清热解毒、化痰散结、祛瘀消癥入手。芩黄方由黄芩、黄芪、姜黄、夏枯草4味中药材组成,功效为清热解毒、化痰散结、益气扶正。经随机、安慰剂对照的临床试验研究证实,芩黄方联合R-CHOP方案可提高DLBCL患者的早期完全缓解率,尤其对高危、病理分期晚、卡氏评分(Karnofsky performance status,KPS)差者更明显,表明该治疗方案具有协同作用[10]。
本研究结果显示,DLBCL患者经R-CHOP方案治疗后出现免疫功能紊乱,主要表现为CD3+T细胞、CD4+T细胞及IgG、IgA、IgM水平显著下降,与文献报道[7]一致。中药治疗组CD3+T细胞、CD4+T细胞绝对值及CD4/CD8比值在化疗结束后1~2年恢复至化疗前水平(P>0.05),而对照组在化疗结束后2年这3项指标仍低于化疗前(P<0.05);且中药治疗组化疗结束后2年较化疗3个月3项指标的升高幅度显著高于对照组(P<0.05)。说明采用芩黄方干预可促进DLBCL患者化疗后T细胞的恢复。在体液免疫方面,DLBCL患者化疗后IgG、IgA、IgM水平显著低于化疗前(P<0.05),化疗结束后1~2年IgG、IgA水平才恢复到化疗前水平,而IgM在化疗结束后2年仍无法恢复至化疗前水平。中药治疗组与对照组之间各时间点IgG、IgA、IgM水平差异均无统计学意义(P>0.05)。因此,芩黄方对于DLBCL患者化疗后IgG、IgA、IgM水平的恢复可能无明显影响。
综上所述,芩黄方对DLBCL患者化疗后的细胞免疫功能有保护作用,可促进细胞免疫重建进程。关于中药干预淋巴瘤患者免疫功能的作用机制尚需在炎症细胞因子、肠道菌群等方面进行更加深入的研究。相信随着今后相关研究的逐步深入,会有更多的证据支持中药对淋巴瘤的治疗作用,并有助于完善淋巴瘤的中西医结合诊疗规范和临床路径。

