聚脲微胶囊反应动力学参数及其pH数值法测定
倪卓,莫少妮,郭震,朱龙晖,曾珊,肖阳
1)深圳大学化学与环境工程学院,广东深圳 518071;2)深圳飞扬骏研新材料股份有限公司,广东深圳 518101
聚脲(polyurea,PUA)由多异氰酸酯和多元胺通过缩聚反应合成[1-2],具有防水、防腐、抗冲击和耐磨等优点,应用范围十分广泛[3-7].目前,PUA的合成反应动力学研究方法包括差示扫描量热法(differential scanning calorimeter,DSC)、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)法和pH 数值模拟法[8-9]等.采用非等温DSC法将六亚甲基二异氰酸酯三聚体(hexamethylene diisocyanate trimer,3HDI)和恶唑烷类潜伏性固化剂混合均匀后,以不同升温速率进行DSC 测试,通过Kissinger 法和Crane 方程计算得到聚脲反应的活化能和反应级数[10-11].将4,4′-二苯甲烷二 异 氰 酸 酯(4,4'-diphenylmethane diisocyanate,MDI)和酰胺扩链剂的N,N-二甲基甲酰胺(N,Ndimethylformamide,DMF)溶液涂抹在溴化钾片上,跟踪特征峰随时间的变化关系,其中,异氰酸根基团(—NCO)和氨基基团(—NH2)的摩尔比为1∶1,根据朗伯比尔定律计算得到聚脲反应动力学参数[12].芳香族异氰酸酯(甲苯二异氰酸酯和MDI等)或部分脂肪族异氰酸酯(异佛尔酮二异氰酸酯和HDI等),低分子质量胺扩链剂(乙二胺、二乙烯三胺和三乙烯四胺(triethylenetetramine,TETA)等)或端氨基聚醚反应合成聚脲时,反应不需要催化剂,在极短的时间内就可以完成,在常温甚至低温时也能快速固化[13-15].但是反应速率过快对准确测量聚脲合成反应动力学造成了困难. 本研究采用pH 数值模拟法计算甲苯二异氰酸酯(toluene diisocya⁃nate,TDI)和TETA反应生成聚脲的动力学参数,并采用FTIR法验证pH数值模拟法的实验结果,以期为聚脲动力学研究提供一种操作方便、测量准确的新途径.
1 主要试剂与仪器
试剂:植物油(食品级)购自中粮新沙粮油工业(东莞)有限公司;辛基酚聚氧乙烯醚(OP-10)购自无锡市亚泰联合化工有限公司;Tween-80(化学纯)购自广东光华化学有限公司;Span-80(化学纯)购自西陇科学股份有限公司;甲苯二异氰酸酯(toluene diisocyanate,TDI,化学纯)购自上海麦克林生化科技有限公司;TETA(化学纯)购自国药集团股份有限公司;N,N-二甲基乙酰胺(化学纯)购自麦克林生化科技有限公司;溴化钾(KBr,光谱级)购自上海阿拉丁生化科技股份有限公司.
仪器:DF-101S 集热式恒温加热磁力搅拌器购自巩义市予华仪器有限责任公司;JJ-1电动搅拌器购自金坛市金城国胜实验仪器厂;PHS-3C 型酸度计购自上海仪电科学仪器股份有限公司;DMLP 光学显微镜购自德国Leica 仪器有限公司;傅里叶红外光谱仪购自日本岛津企业管理(中国)有限公司.
2 实验原理
2.1 pH数值模拟法原理
微胶囊合成方法主要有界面聚合法和原位聚合法等[16-17].PUA微胶囊采用界面聚合法,将异氰酸酯(或预聚体)和多元胺分别溶于油相和水相中,二者分别向油水界面处扩散并发生聚合反应形成聚脲外壳[18-19].假定含有单体TDI 的有机相以直径为d的液滴形式分散在水相中,研究聚合物层的扩散与界面反应对聚脲反应动力学的影响.假定只有亲水性单体TETA 的未质子化形式可以扩散到聚合物相中,与单体TDI进行反应,反应式为
其中,H=ct(H+)/c0(H+),为t时刻的H+浓度与初始时刻H+浓度的比值;p为拟合常数.
通常微胶囊壁厚比半径小得多,因此可忽略微胶囊曲率以平面表示PUA 在界面的合成反应过程,如图1.
根据动力学反应条件可知,得到函数fk(H)与H的关系方程.

2.2 红外光谱法原理
聚脲反应动力学过程为

用红外光谱跟踪反应过程中聚脲特征峰随时间的变化(扫描间隔为60 s),随着反应时间的延长,TETA分子中伯氨基特征峰逐渐变弱.根据朗伯-比尔 定 律:D(TETA) =ε(TETA)bc(TETA).其 中,D(TETA)为TETA的光密度;b=1 cm,为溶液吸收层厚度;ε(TETA)为TETA 摩尔吸光系数,单位:L/(mol·cm). 可通过特征峰面积计算不同时刻的转化率Xt.
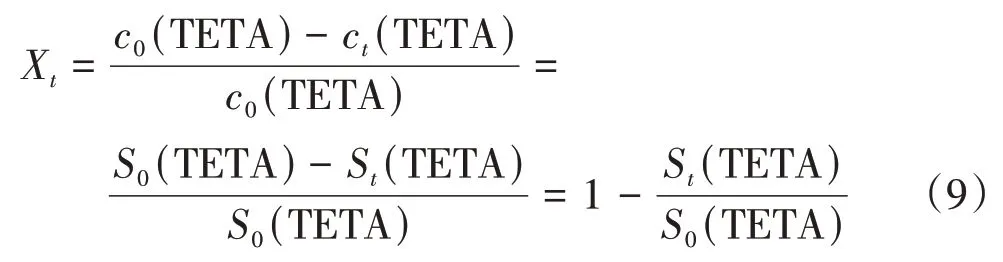
其中,c0(TETA)和ct(TETA)分别为初始时刻和t时刻TETA的浓度;S0(TETA)和St(TETA)分别为初始时刻和t时刻特征峰峰面积.
根据特征峰峰面积的变化,按照0 级反应、1级反应和2 级反应,以1 -Xt、ln(1 -Xt)和1/(1 -Xt)对时间t作图,并拟合成直线,相关系数最高的直线模型对应的级数为反应级数,通过直线斜率得到反应速率常数K.由阿伦尼乌斯方程(10)确定活化能E,以lnK对1/T作图,线性拟合后通过斜率计算得到活化能.

其中,A为指前因子;R为摩尔气体常数;T为反应的热力学温度.
3 实验方法
3.1 pH数值模拟实验
1)TETA标准溶液配制
在500 mL 容量瓶中配置浓度为0.1 mol/L 的TETA 溶液,以甲基橙为指示剂,用0.1 mol/L 的HCl标准溶液标定.使用移液枪精确量取上述标准TETA溶液稀释,在500 mL容量瓶中分别配置浓度为0.1、0.5、1.0、5.0 和10.0 mmol/L 的TETA 溶液待用.
2)乳液pH值测定
在25 ℃下,准确称取3 种乳化剂:2.50 g OP-10、2.50 g Tween-80 和2.50 g 复合乳化剂(1.25 g Tween-80+1.25 g Span-80),加入含有95.00 g不同浓度TETA溶液的250 mL三口烧瓶中,400 r/min下搅拌使其溶解,然后加入5.00 g植物油乳化5 min,插入pH计待读数稳定后,记录乳液pH值.每项实验重复3 次.另外,在5、35 和45 ℃重复上述实验,测量不同温度下含Tween-80 + span-80 复配乳化剂的乳液pH值.
3)聚脲反应动力学研究方法
分别称取Tween-80 和Span-80 各1.25 g,溶解于含90 mL蒸馏水的250 mL三颈圆底烧瓶中,记为乳液1.称量0.348 3 g TDI 和5.00 g 植物油于烧杯中混合并搅拌均匀,作为油相待用.称量0.292 4g TETA 溶于5 mL 蒸馏水中,用盖子盖好待用,其中,n(TDI)∶n(TETA)= 1∶1.在25 ℃水浴下,将油相加入乳液1中,混合物以400 r/min的搅拌速度乳化5 min,形成水包油乳液,然后插入pH计,并将TETA溶液快速滴加到乳液系统中,TDI和TETA在油-水界面反应,每隔10 s记录乳液pH值,直至读数基本不变. 在5、35和45 ℃的条件下重复上述实验.
3.2 红外光谱实验方法
将TDI 和TETA 溶于N,N-二甲基乙酰胺溶剂中,配置成等浓度溶液,取相同体积的TDI溶液和TETA 溶液均匀混合后立即涂抹在KBr 片上,每隔60 s 记录红外光谱曲线. 扫描范围为4 000~400 cm-1,共扫描16次.
4 结果与讨论
4.1 乳液pH值与TETA浓度关系
不考虑TDI,使用已知浓度的TETA 溶液,研究OP-10、Tween-80 以及Tween-80 + Span-80 复配乳化剂(m(Tween-80)∶m(Span-80)=1∶1)3种乳化剂的pH值与TETA浓度的关系,在对数坐标下绘制pH-c(TETA)曲线,见图2.
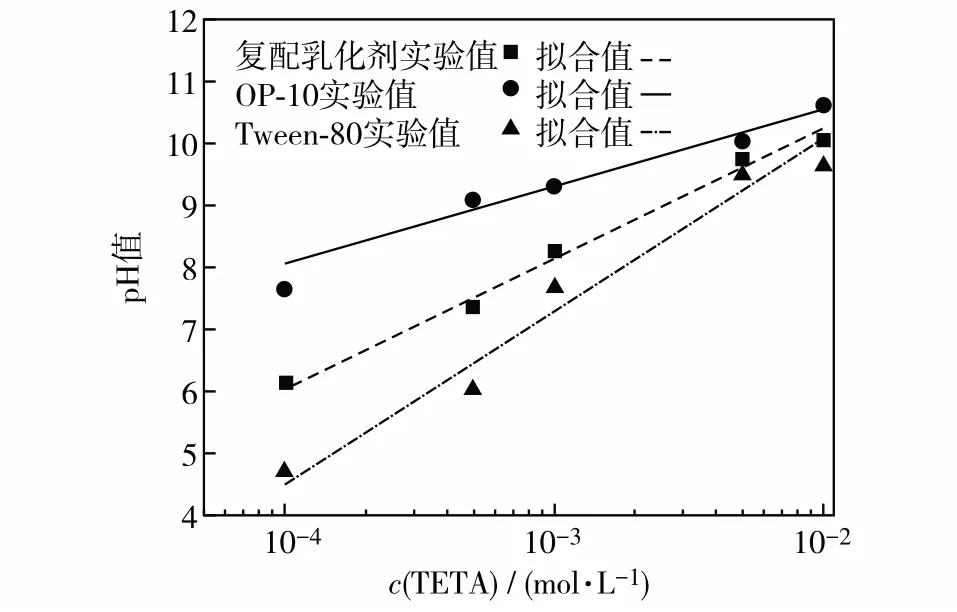
图2 25 ℃下3种乳化剂pH值随c(TETA)变化Fig.2 pH value as a function of c(TETA)for solutions containing three different emulsifiers at 25 ℃.
图3 为不同反应温度(θ)下Tween-80+Span-80复配乳液的pH-c(TETA)拟合曲线,拟合函数为y=a·c(TETA) +b,拟合结果见表1.由图3 可见,在不同反应温度下,Tween-80 + Span-80 复配乳液的pH-c(TETA)拟合直线具有较好的线性关系.
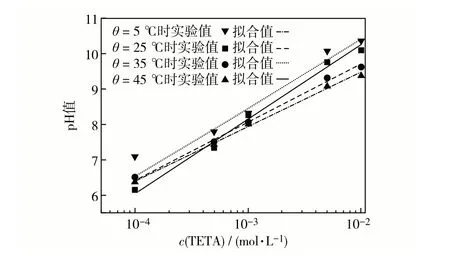
图3 不同温度下Tween-80+Span-80复配乳液的pH-c(TETA)曲线Fig.3 pH versus c(TETA)for Tween-80 and Span-80 compound emulsion at different temperatures.
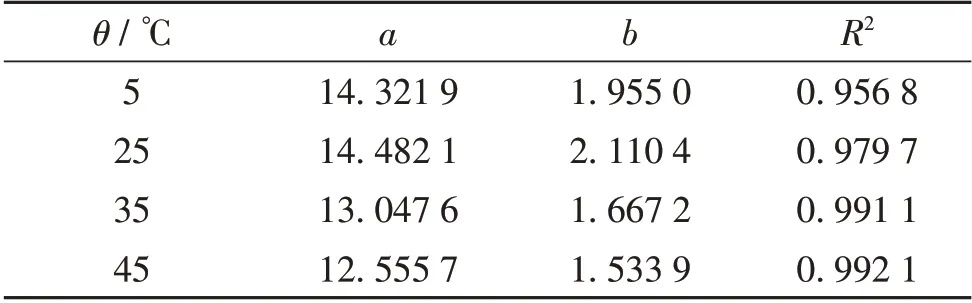
表1 pH-c(TETA)曲线的拟合结果Table 1 Fitting parameters of pH-c(TETA)curves
通过测定不同温度下Tween-80 + Span-80 复配乳液的PUA 合成体系中c(TETA)随c(H+)的变化,根据c(TETA) =Âc(H+)-p可计算得到不同温度下的Â和p,其中,Â为拟合常数. 结果见表2.

表2 不同温度下式(11)拟合参数Â和pTable 2 Fitting parameters Âand p of equation(11)at different temperatures
4.2 pH数值模拟聚脲反应动力学
本研究中所有实验乳化条件相同,微胶囊尺寸基本保持相同,固定油水两相体积比,研究反应温度对TDI 和TETA 反应动力学的影响.根据不同反应时间测得体系pH值,分别绘制H、X与反应时间t的关系曲线,如图4 和图5 所示.由图4 和图5 可见,在聚脲合成反应过程中,随时反应时间延长,体系的H值增加,单体TETA 转化率X在前期快速增加,后期变化较小或趋于稳定.
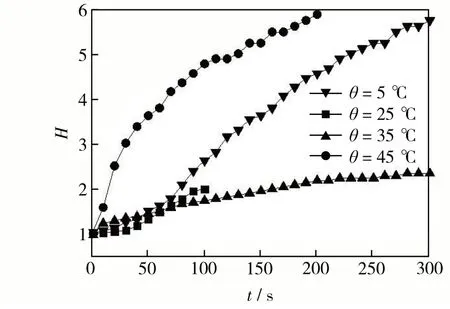
图4 H-t曲线Fig.4 H-t curves.

图5 X-t曲线Fig.5 X-t curves.
当n(TDI)∶n(TETA)= 1 时,通过式(5)和式(6)可分别得到fk(H)和fD(H)随反应时间t的变化关系曲线(图6和图7).由图6可见,fk(H)值随t的延长而增加,对fk(H)与t关系曲线进行线性拟合,通过fk(H)与t拟合直线的斜率可得到TETA 与TDI 的界面反应速率常数K.随反应温度升高,拟合直线的斜率越大,表明界面K越高.由图7可见,fD(H)值随着t延长而增加.对fD(H)与t进行线性拟合,根据fD(H)与t的关系曲线的斜率得到扩散系数DB.随反应温度越高,拟合直线的斜率越大,表明单体TETA 的扩散系数越高,K和DB结果见表3.由表3可见,K和DB在置信区间内数值模拟可靠性较高.

图6 不同温度下fk(H)-t的关系Fig.6 Relationship between fk(H)and t at different temperatures.

图7 不同温度下fD(H)-t关系Fig.7 Relationship between fD(H)and t at different temperatures.

表3 不同反应温度下PUA微胶囊界面K、DB及误差Table 3 Interfacial reaction rate constant K, diffusion coefficient DB and error at different temperatures
根据式(10),以lnK对1/T作图(图8),拟合直线斜率求出反应的活化能.从图8可见,lnK和1/T具有良好的线性关系,相关系数为0.96,活化能为78 kJ/mol.

图8 pH数值模拟法求得ln K和1/T的关系Fig.8 Relationship between ln K and 1/T pH given by numerical simulation method.
4.3 红外光谱法拟合曲线
25 ℃时PUA 红外特征峰随时间的变化如图9,由图9 可见,反应时间越长峰面积越小[11],表明TETA与TDI反应体系中的—NH2随反应时间反应延长而不断减少,按照2 级反应做1/(1 -Xt)和t关系图,拟合成直线,相关系数R2=0.96,表明合成聚脲反应为2级反应.以不同反应温度下的lnK对1/T作图,如图10 和图11 所示,拟合直线的相关系数为0.98,活化能为88 kJ/mol.
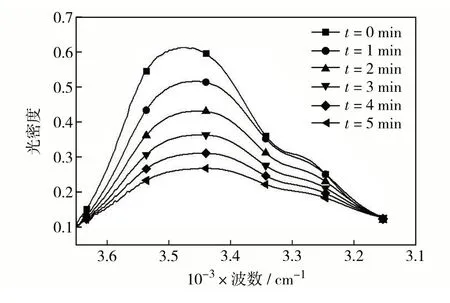
图9 不同反应时间下的PUA红外吸收光谱Fig.9 FTIR of PUA at different reaction time.

图10 聚脲合成2级反应的线性拟合Fig.10 Linear fitting of polyurea secondary synthesis reaction.

图11 红外光谱法求得ln K和1/T的关系Fig.11 Relationship between ln K and 1/T given by FTIR.
结 语
采用pH 数值模拟法和红外光谱法测定聚脲反应速率常数、扩散系数和活化能等动力学参数.结果发现,通过pH 值模拟法测得聚脲反应活化能为78 kJ/mol,通过FTIR 法测得聚脲反应活化能为88 kJ/mol,两种方法得到的活化能相近.其中,利用pH 值模拟法计算聚脲反应动力学参数操作简便,数据准确,为聚脲动力学研究探寻了一种具有可行性的新途径.

