新生儿及小婴儿复杂先天性心脏病手术后早期拔除气管插管的影响因素分析
曾敏 李胜利 段雷雷 李守军 闫军 花中东 王旭
1 中国医学科学院,北京协和医学院,国家心血管病中心,阜外医院小儿心脏中心儿童重症监护室,北京 100037;2 中国医学科学院,北京协和医学院,国家心血管病中心,阜外医院小儿心脏中心外科,北京 100037;3 中国医学科学院,北京协和医学院,国家心血管病中心,阜外医院小儿心脏中心内科,北京 100037
先天性心脏病(congenital heart disease,CHD)手术后早期拔除气管内插管(early extubation,EE)是快速康复的重要组成部分,其目的在于提高医疗资源的利用率、缩短住院时间和降低医疗费用[1]。EE 是术后康复的标志性事件,诸多文献将EE 和快速康复作为同义词对待。 简单CHD 患者EE 的经典含义是手术后3 h 或6 h 内拔除气管内插管。 在复杂CHD 领域,传统方案需要手术后3 ~5 d 以上的呼吸机治疗。 随着先心病治疗技术的提高,复杂CHD 的EE 得到逐步开展。 一般认为复杂CHD 术后24 h 内拔除气管插管属于EE 范畴[2]。 近5 年以来,EE 已经不单是衡量快速康复治疗、缩短呼吸机使用时间的指标,而是成为了衡量各个心脏医疗中心CHD 手术治疗质量的评价指标[3]。
目前在国外大部分心脏中心,简单CHD 和大年龄儿童CHD 手术后EE 是常规治疗。 然而低年龄、低体重以及CHD 复杂程度都是EE 的影响因素,各心脏中心对于小婴儿复杂CHD 的EE 存在争议,大多数文献将新生儿作为EE 的排除对象,其原因为:①新生儿或小婴儿需要矫治的都是复杂CHD,开展EE 难度大; ②低年龄婴儿(特别是新生儿)气道狭小,易拔管失败。 由于目前关于新生儿和小婴儿EE的文献较少,这部分高危群体EE 的影响因素需要进一步探索。 基于此,本研究以2017 年1 月1 日至2019 年12 月31 日由中国医学科学院阜外医院收治的新生儿和小婴儿CHD 患者为研究对象,分析EE 的可行性和优势,进而探讨小婴儿和新生儿EE的影响因素。
材料与方法
一、 研究对象
本院自2006 年起开始对大龄复杂CHD 患者实施术后EE。 2014 年开始对小婴儿复杂CHD 患者实行EE,2016 年开始对新生儿和小婴儿CHD 患者实施EE,并制定了EE 的围手术期管理方案。 2017年1 月1 日至2019 年12 月31 日在本院行复杂先天性心脏病手术共551 例,纳入标准:①年龄3 个月以下; ②CHD 复杂程度为2 ~5 级[4]。 排除标准:①主要诊断为动脉导管未闭、房间隔缺损或室间隔缺损等简单CHD; ②术前患肺炎和(或)需要呼吸机支持、延迟关胸,术前和术后需ECMO 辅助。 本研究共纳入391 例复杂CHD 患儿。 本研究获得中国科学院阜外医院伦理委员会批准,患儿监护人签署知情同意书。
二、EE 的定义与分组
本研究采取大多数文献中提到的复杂CHD 手术后EE 的标准,即患儿离开手术室到达儿童重症监护室(pediatric intensive care unit,PICU)后24 h内拔除气管插管者,也包括在手术室内拔管者。 根据患儿回PICU 后撤离呼吸机的时间,为EE 组(术后24 h 内拔除气管内插管)和非EE 组(术后拔除气管内插管时间超过24 h)。
EE 失败:术后24 h 内撤离呼吸机后,由于各种原因72 h 内需要二次气管插管者,定义为EE 失败。
三、临床观察指标
收集患儿年龄、体重、性别、临床诊断、手术方式等一般资料。 观察指标包括:体外循环(cardiopulmonary bypass,CPB)时间、主动脉阻断时间(aortic cross clamp,ACC)时间、先天性心脏病手术风险-1(risk adjustment in congenital heart surgery,RACHS-1)分级、重症监护病房(intensive care unit,ICU)住院时间、机械通气时间。 并发症包括死亡、二次气管插管以及感染。
四、EE 医疗常规和医护配置
实施EE 的患儿回ICU 后,按科室制定的EE 医疗常规管理。 ICU 医生具备独立气管插管能力以及敏捷的急救反应能力。 本院PICU 医生数∶床位数为22 ∶40( >1 ∶2),注册护士数∶床位数为160 ∶40(4 ∶1)。 每组医疗轮班保证1 ~2 名高年资ICU医师,保证高年资护师与新生儿一对一护理。
五、术中管理
按照EE 要求,采用静脉复合吸入麻醉,芬太尼术中总用量为10 ~20 μg/ kg,手术结束前1 h 内避免使用肌松剂。 右美托咪定负荷量1 μg/kg,30 min内泵入,维持量为0.3 ~1 μg·kg-1·min-1。 术中尽量减少输入液体量,避免术后肺负担加重。 体外循环管理采用常规超滤联合改良超滤和零平衡超滤,术后血红蛋白维持在10 g/dL 以上。
六、肺动脉高压的评估和处理
轻中度肺动脉高压患儿进入EE 程序。 术前重度肺动脉高压患儿需要评估术后肺动脉压下降情况,再考虑是否行EE。 评估标准:术中测量平均肺动脉压下降至正常或肺动脉收缩压下降至动脉血压的2/3 以下。 符合以上条件者进入下一步EE 程序。 口服西地那非、波生坦控制肺动脉高压。 有重度肺动脉高压者于术后早期泵入曲前列尼尔20 ~60 ng·kg-1·min-1,酌情加量。
七、EE 的流程
采用同步间歇指令通气(synchronized intermittent mandatory ventilation,SIMV)或双水平气道正压通气(bi-level positive airway pressure,BIPAP),呼吸机为美国PB 840 呼吸机或德国德尔格Savina 呼吸机。
所有患儿均视为EE 的潜在对象,由术者和(或)PICU 二线医师决定是否行EE 治疗。 EE 的评判标准: ①一般情况:患儿神志清醒,无神经系统并发症,胸腔引流量<1 mL·kg-1·h-1,尿量>1 ~2 mL·kg-1·h-1。 ②循环系统:血流动力学稳定,血管活性药物使用量不大,无严重心律失常。 ③无代谢性酸中毒,乳酸<2 mmol/L。 中心温度>35.5℃。④呼吸机吸气峰压(peak inspiratory pressure,PIP) <20 cmH2O(1 cmH2O =0.098 kPa),FIO2<0. 5 时,PO2>80 mmHg。 EE 步骤:逐步减少呼吸机辅助呼吸次数至5 次,血气分析pH >7. 35,PaCO2<45 mmHg(1 mmHg =0.133 kPa),PaO2>80 mmHg。如符合上述指标,则给予EE 治疗,若不能满足以上条件,即继续维持呼吸机通气。
八、术后疼痛管理
术后予右美托咪定0.3 ~1 μg·kg-1·h-1泵入。 如出现烦躁、易激惹则予盐酸吗啡10 ~20 μg·kg-1·h-1或芬太尼0.5 ~1 μg·kg-1·h-1持续泵入。 需额外镇静患儿,单次静脉推注安定0.3 ~0.5 mg/kg,或口服水合氯醛0.3 mL/kg。
九、统计学处理
采用SPSS 23.0 统计软件进行数据整理与分析。 对于年龄、体重、CPB、ACC 时间等服从正态分布的计量资料以±s 表示,EE 以及非EE 组比较采用独立样本t 检验。 计数资料以n(%)表示,两组间比较采用χ2检验。 采用Logistic 回归分析EE 的影响因素。 以P <0.05 为差异有统计学意义。
结 果
一、两组单因素分析
391 例患儿年龄1 ~89 d,体重1.8 ~6.8 kg,其中新生儿136 例(136/391,34. 9%)。 65% (254/391) 的 患 儿 实 现 了EE, 其 中80 例(80/136,58.8%)新生儿实施了EE,181 例(181/255,71%)日龄为31 ~89 d 的小婴儿实施了EE。 全组病死率2.30%(9/391),EE 组无死亡。 全组EE 病例中年龄最小者为7 d,体重最低者2.8 kg,体重<2.5 kg者中无EE 病例,2.5 ~3.0 kg 者实施EE 人数为2例。 EE 组和非EE 组体重差异有统计学意义(t =4.818,P <0.001)。 两组ACC 和CPB 时间,差异有统计学意义(P <0.05),详见表1。
表1 新生儿及小婴儿复杂CHD 患者手术后EE 的单因素分析( ±s)Table 1 Univariate analysis results of perioperative clinical parameters between two groups( ±s)

表1 新生儿及小婴儿复杂CHD 患者手术后EE 的单因素分析( ±s)Table 1 Univariate analysis results of perioperative clinical parameters between two groups( ±s)
注 CHD:先天性心脏病; EE:早期拔除气管插管; ACC:主动脉阻断时间; CPB:体外循环
分组 例数 年龄(d) 体重(kg) ACC 时间(min) CPB 时间(min)115.6 ±47.08非EE 组 137 43.96 ±27.822 3.87 ±0.880 82.97 ±31.48 128.72 ±48.19 t 值 - 3.435 4.818 -3.070 EE 组 254 54.39 ±28.58 4.33 ±1.02 71.93 ±33.49-2.525 P 值 - 0.001 <0.001 0.002 0.013
两组患儿4 种RACHS-1 风险分级的比例差异有统计学意义(χ2=8.493,P =0.030)。 此外,各种CHD 分级及其EE 情况见表2。 BT 分流术患儿EE比例低于根治术患儿,差异有统计学意义(χ2=9.875,P =0.003)。

表2 CHD EE 组患者先天性心脏病手术风险-1 风险分类分布情况Table 2 Patient distribution of RACHS-1 risk category in EE group
二、多因素Logistic 回归分析
单因素因素分析提示,EE 组与非EE 组在年龄、体重、RACHS-1 风险分级、ACC、CPB 时间、BT分流手术上比较,差异有统计学意义(P <0.05)。将上述分类变量的影响因素赋值如下:“非BT 分流术” =0 ;“BT 分流术” =1; “Risk category2” =2;“Risk category3” =3;“Risk category4” =4,“Risk category 5” =5。 多因素Logistic 回归分析发现,体重(OR =0.648,95%CI:0.471 ~0.893)和BT 分流术(OR =0.109,95%CI:0.013 ~0.934)是影响小婴儿和新生儿复杂CHD 术后EE 的独立影响因素(表3)。
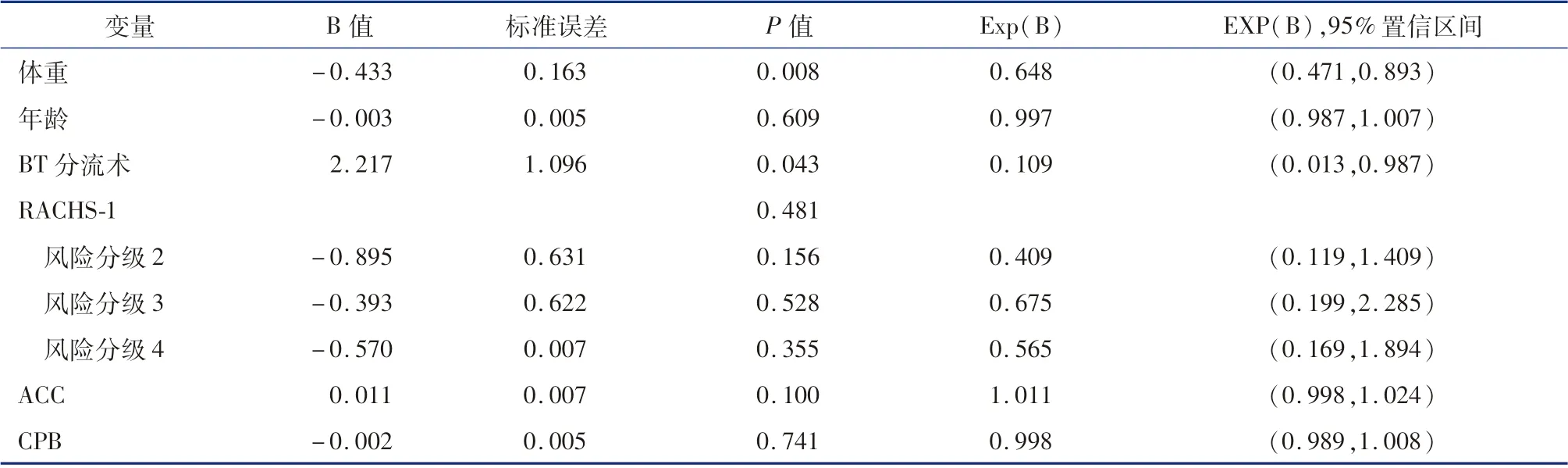
表3 新生儿及小婴儿复杂CHD 手术后EE 的多因素Logistic 回归分析Table 3 Multivariate Logistic regression analysis of risk factors for EE following complex CHD repair in neonate and young infants
三、患者结局性指标分析
EE 组ICU 住院时间、呼吸机辅助时间低于非EE 组(P <0.05),见表4。 术后并发症发生情况及原因分析:全组二次气管插管25 例(5.47%),其中EE 组8 例,非EE 组17 例,差异有统计学意义(χ2=16.576,P <0.001),见表5。 8 例新生儿需要二次气管插管,EE 组2 例(2. 50%),非EE 组6 例(7.50%)。 EE 组二次插管原因:2 例新生儿存在持续酸中毒,呼吸暂停;其余6 例导致二次气管插管的原因包括:胸腔引流量多需开胸探查、感染以及肺动脉高压。 术后总感染率4.8%(23/391),EE 组感染率低于非EE 组,差异有统计学意义(χ2=31.97,P <0.001),见表5。
表4 复杂CHD EE 组和非EE 组呼吸机通气及ICU 住院时间比较( ±s)Table 4 Comparison of MVT and ICU LOS between two groups( ±s)

表4 复杂CHD EE 组和非EE 组呼吸机通气及ICU 住院时间比较( ±s)Table 4 Comparison of MVT and ICU LOS between two groups( ±s)
注 CHD:先天性心脏病; EE:早期拔除气管插管;MVT:呼吸机通气时间; LOS:住院时间
指标 例数 呼吸机时间(h) ICU 住院时间(d)EE 组 254 4.17 ±2.56 18.24 ±7.23非EE 组 137 12.32 ±9.93 117.57 ±102.90 t 值 - -9.244-11.035 P 值 - <0.001 <0.001
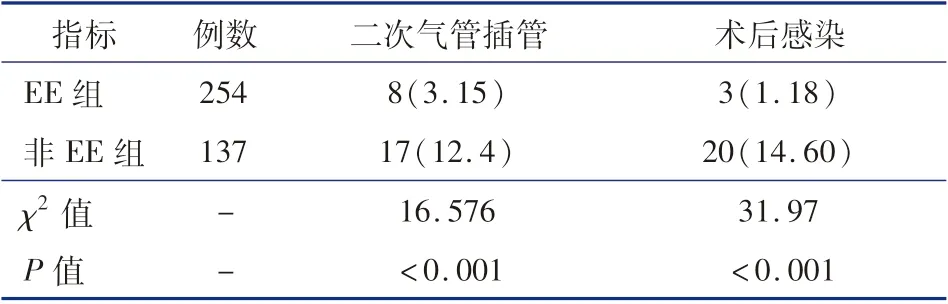
表5 复杂CHD EE 组和非EE 组二次气管插管和术后感染比较[例(%)]Table 5 Comparison of re-intubation rate and post-operative infection between two groups[n(%)]
讨 论
目前关于新生儿和小婴儿EE 的研究不多。 新生儿容易出现术后渗漏、水肿以及肺部并发症等,最终导致EE 失败,因此诸多研究把新生儿作为EE的排除对象[5-6]。国外有限的新生儿EE研究中,很少有患者死亡或发生严重并发症,但EE 失败的比例大多在10%以上[7-8]。 Harris 等[7]认为EE 失败比例在10%以内属于可以接受的范围。 本研究中新生儿EE 的二次气管插管率为2.5%,属于较低水平。 此外,新生儿以及小婴儿EE 比例的高低受很多主观和客观因素影响,如各心脏中心对EE 的态度,是否有EE 临床指南指导等可对新生儿EE 比例的高低产生较大影响[9]。 在EE 意愿比较积极的心脏中心新生儿复杂CHD 中EE 的比例高达60%以上,而意愿较低的心脏中心中EE 比例仅为18%。另外在一些比较积极的心脏中心,有近20%的患者血气分析pH <7.3 时即可拔除气管插管,但是本院实施EE 要求血气分析pH >7.3,该策略相对保守,这可能是本研究中新生儿EE 失败率低于大多数研究的原因[10]。
目前各个研究对于EE 的定义不一致,EE 的范围可以是术后0 ~24 h。 各研究对象的复杂程度不尽相同,导致EE 患者比例和影响因素也相差较大。Mittnacht 等[6]在一项包含224 例1 个 月 至16 岁CHD 患者的EE 研究中发现,低年龄是EE 失败的影响因素。 Alam 等认为年龄<6 个月、CPB 时间长是EE 的影响因素[11]。 本研究中患儿年龄相近,研究结果提示,年龄不是EE 的影响因素,而低体重是小婴儿和新生儿复杂CHD 手术后EE 的独立影响因素。 这与临床实际是一致的,即年龄相似患者,体重越低术后恢复越难,EE 失败风险越大。
大多数研究认为,CHD 复杂程度对EE 有影响。然而,尽管本研究中两组患儿CPB、ACC、RACHS-1风险分级存在统计学差异,但是进一步的多因素分析发现,这些因素并非EE 的独立影响因素。 Benneyworth 等回顾性研究北美14 家心脏中心新生儿心脏手术后拔管失败的影响因素,发现新生儿EE达到60%,CPB、ACC、RACHS-1 风险分级不是EE的影响因素[8]。 该研究结果与本研究类似,病种选择可能是研究结果不一致的原因,如本研究只包含RACHS-1 分级2 ~5 类的患者,而其他研究则包含所有简单心脏畸形患者。
此外,BT 分流术RACHS-1 风险为3 级,然而只有14%的患儿能够实施EE 治疗,远低于其他高风险患者。 Dirks 等[12]在一项BT 分流术的研究中发现,BT 分流术后患儿病死率高达9%,术后呼吸机通气时间中位数为2 d。 16%BT 分流手术患儿面临管道过大问题,出现心源性休克、肺水肿等情况,需要二次手术调整管道大小;8.4%的患儿分流管道小,易发生管道堵塞;该研究认为BT 分流术外科操作来看似简单,但术后恢复难度比双心室矫治更大,术后难以行EE 治疗。 从术后患儿血流动力学变化来看,BT 分流手术患儿术后发生显著肺血流变化,其心脏和肺的负担与术前相比有不同程度增加,容易出现肺水肿、肺出血以及分流管道堵塞等严重情况,导致BT 分流手术患儿需要延长呼吸机治疗时间或拔管失败。
研究表明,在CHD 患儿中实施EE 既能够减少呼吸机使用时间,又能缩短ICU 住院时间和降低医疗费用等[13-14]。 本研究结果提示,65%的新生儿和小婴儿复杂CHD 患者实施EE 是可行的,可以减少ICU 住院时间、呼吸机治疗时间以及降低医疗费用。本研究中EE 组无死亡,二次气管插管率与其他研究基本一致[7-8]。 EE 除了可以缩短住院时间,降低医疗费用外,还具有一些其他方面优势,如EE 可以减少术后并发症、降低感染率以及缩短胸腔引流管留置时间等[7,14-15];可以尽可能地减少气道暴露时间和降低肺呼吸机伤的可能性。
近年美国先天性心脏病网络协作组把EE 写入临床指南,并作为衡量不同心脏中心成绩和质量的评价指标[3,16]。 研究表明ICU 医护力量的强弱与EE 的比例呈正相关,本院ICU 医护力量充足是新生儿EE 顺利实施的保障。 该研究提示EE 开展意愿积极的医疗单位,EE 失败比例和二次气管插管比例并没有升高,反而呈下降趋势。 强化术后呼吸道管理和EE 临床指南实践,有助于提升EE 比例以及减少二次气管插管比例[9]。 因此如何通过加强团队协作和完善医疗管理,从而提高EE 的比例和成功率,值得进一步深入研究。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 文献检索为曾敏、李胜利,论文调查设计为曾敏、段雷雷,数据收集分析为曾敏、李胜利,论文结果撰写为曾敏、段雷雷,论文讨论分析为曾敏、李守军、闫军、花中东、王旭

