医用钛及钛合金表面涂层研究进展
白雪寒,范 林,赵铭钰,史兴岭,马 力,孙明先
(1.中国船舶重工集团公司第七二五研究所 海洋腐蚀与防护重点实验室, 山东 青岛 266237)(2.江苏科技大学 材料科学与工程学院, 江苏 镇江 212003)
近年来,随着生物医学技术的快速发展,在疾病的诊断治疗、创伤修复和诱导再生过程中,医用植入物的应用越来越广泛。与不锈钢、CoCrMo合金等医用金属材料相比,钛及钛合金具有密度低、比强度高、生物相容性好等优点,且钛元素对人体基本无害,更适合用来制作医用植入物。然而,目前钛及钛合金植入物表现出的性能还不能够完全满足临床要求,存在耐磨性较低、抗菌性较差以及在复杂人体环境中耐蚀性弱等缺点,需通过表面处理进行改善。在钛及钛合金表面制备涂层能够极大丰富其应用场景,对钛及钛合金在医学领域的推广应用有着极其重要的意义。
通过各种表面改性技术提高钛及钛合金的耐磨性、耐蚀性、生物相容性和生物活性已经成为近年来医用钛合金领域的研究热点。本文阐述了钛及钛合金在医学领域的发展历程、常用的表面处理技术,着重介绍了医用钛及钛合金表面功能涂层的最新研究进展,并对医用钛及钛合金表面涂层未来的研究方向进行了展望,以期推动医用钛及钛合金的发展,使其更广泛地应用于临床医学中。
1 钛及钛合金在医学领域的发展历程
钛及钛合金植入物在临床中应用,不仅要有足够的强度,还需要具备良好的生物相容性、耐磨性和耐腐蚀性[1]。医用钛及钛合金的研究与应用主要分为3个阶段[2]。第一阶段的代表性材料为纯钛和Ti6Al4V合金。20世纪40年代,有学者将纯钛植入鼠的股骨后并未引起不良反应,证明了纯钛具有较好的生物相容性。之后,越来越多的学者开始将纯钛应用在临床医学领域,首先是将纯钛制成牙种植体应用在口腔中,之后逐渐将其制成接骨板、关节假体等应用于临床。但在应用过程中,逐渐发现纯钛的硬度低、耐磨损性较差,无法满足膝关节、髋关节等受力部位的应用要求。Ti6Al4V是一种α+β型合金,最初应用在航空航天领域。与纯钛相比,Ti6Al4V合金的硬度更高,耐磨损性能更好,并且具有较好的加工性能。20世纪70年代,Ti6Al4V合金开始被制成人工关节、接骨板、螺钉等植入物应用于医学领域[3]。但Ti6Al4V合金中的Al和V属于对人体有害的金属元素,植入人体后存在释放有害离子的风险。研究人员不仅在Ti6Al4V合金植入物周围组织中检测到金属离子,甚至在血清、尿液和偏远组织中同样检测到浓度高于正常值的金属离子[4,5]。钒离子可能对成纤维细胞具有细胞毒性,对人体造成潜在危险[6]。铝离子可能导致骨软化症等疾病,影响人体健康[4]。这使得人们对Ti6Al4V合金长期植入体内的安全性提出了质疑,促进了对不含V、Al元素的医用钛合金的研发。
第二阶段始于20世纪80年代末,以改良的α+β型双相合金Ti6Al7Nb和Ti5Al2.5Fe为代表性材料。这2种钛合金的机械性能与Ti6Al4V合金相当,但使用Nb、Fe元素代替了Ti6Al4V合金中对人体有害的V元素,相对更安全,耐蚀性、延展性、生物相容性均得到了改善[7,8]。但这2种合金依然存在硬度不足、耐磨性较差的问题,不能保证植入物植入人体后的长期稳定性。人体的生物环境复杂多变,不仅pH值可能会时刻变化,还存在Cl-、F-等腐蚀性离子,植入物在关节等受力部位不仅会发生摩擦磨损,还可能发生腐蚀,使合金中的Al元素在人体内扩散,导致出现过敏或炎症等症状。由于第二代合金的弹性模量与人体骨组织差距较大,还容易产生“应力屏蔽”而使植入物松动,最终导致手术失败。作为临床医疗器械,第二代合金的性能还有待提升,亟需开发弹性模量更低、耐磨性和生物相容性更好的新型医用钛及钛合金。
第三阶段的代表性材料为不含Al、V元素的Ti13Nb13Zr、Ti12Mo6Zr2Fe、Ti15Mo等β型或近β型合金[9]。这类新型合金大多都能够保留合金中亚稳定β相或马氏体等不稳定相至室温,从而获得较好的加工塑性和韧性,并通过后期的加工和热处理调整合金的显微组织等,使其硬度、弹性模量、韧性、耐磨性、耐蚀性等得到提升,能够更好地与人骨及软组织相匹配[10]。与第二阶段改良的钛合金相比,第三阶段研制的钛合金不含对人体有害的Al元素,生物相容性也更好,正在逐渐取代Ti6Al7Nb等第二代医用钛合金。
钛及钛合金已经作为牙种植体、骨钉、人工髋关节等医用植入物大量应用于临床,如图1所示[1]。目前临床应用最多的医用钛及钛合金仍然是纯钛和Ti6Al4V合金。植入物植入人体内后,骨骼会在植入物周围生长,其生长过程主要分为4个阶段,分别是止血阶段、炎症阶段、增生阶段和重塑阶段[11]。其中,重塑阶段时间最长,因患者的体质、伤口类型、炎症持续时间的不同会持续2年或者更久[12]。
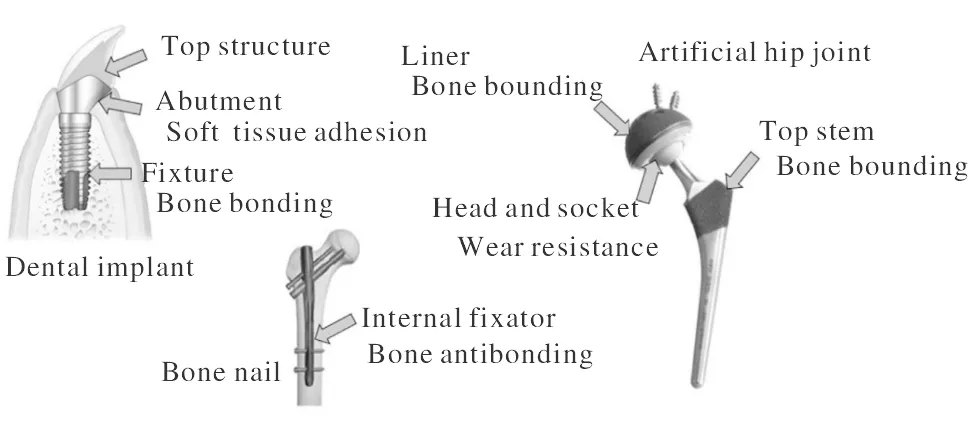
图1 钛及钛合金植入物的临床应用实例[1]Fig.1 Clinical application of titanium and its alloy implants
2 医用钛及钛合金表面处理技术
钛及钛合金作为植入物还存在一些明显的缺点,一定程度上限制了其在医学领域的应用,例如钛及钛合金的硬度和耐磨性不足,不适合用作铰接植入物。目前,应用于髋关节置换的假体金属头通常还是由硬度很高且含有明显细胞毒性的CoCrMo合金制成[13,14]。在此类应用场合中,由于钛植入物和活性骨组织之间,以及人工髋关节中的构件CoCrMo金属头与钛颈等部件之间的界面处会发生摩擦腐蚀,可能出现严重的离子释放现象[15,16]。大量研究表明,通过对植入物材料进行表面处理可以改变其表面形貌、粗糙度、硬度等,从而改善植入物的耐蚀性和耐磨性,以及表面的细胞增殖、黏附等,能够一定程度上缩短愈合时间,加速骨组织形成和骨结合,提高临床治疗成功率[17,18]。
对钛及钛合金进行表面处理能够在不改变基体材料优异性能的前提下使其获得新的医用功能。与设计一种新的医用金属相比,表面处理需要的能耗和成本更低。常见的植入物表面处理方法主要分为3种,分别是物理方法、化学方法和机械方法,如图2所示[19]。
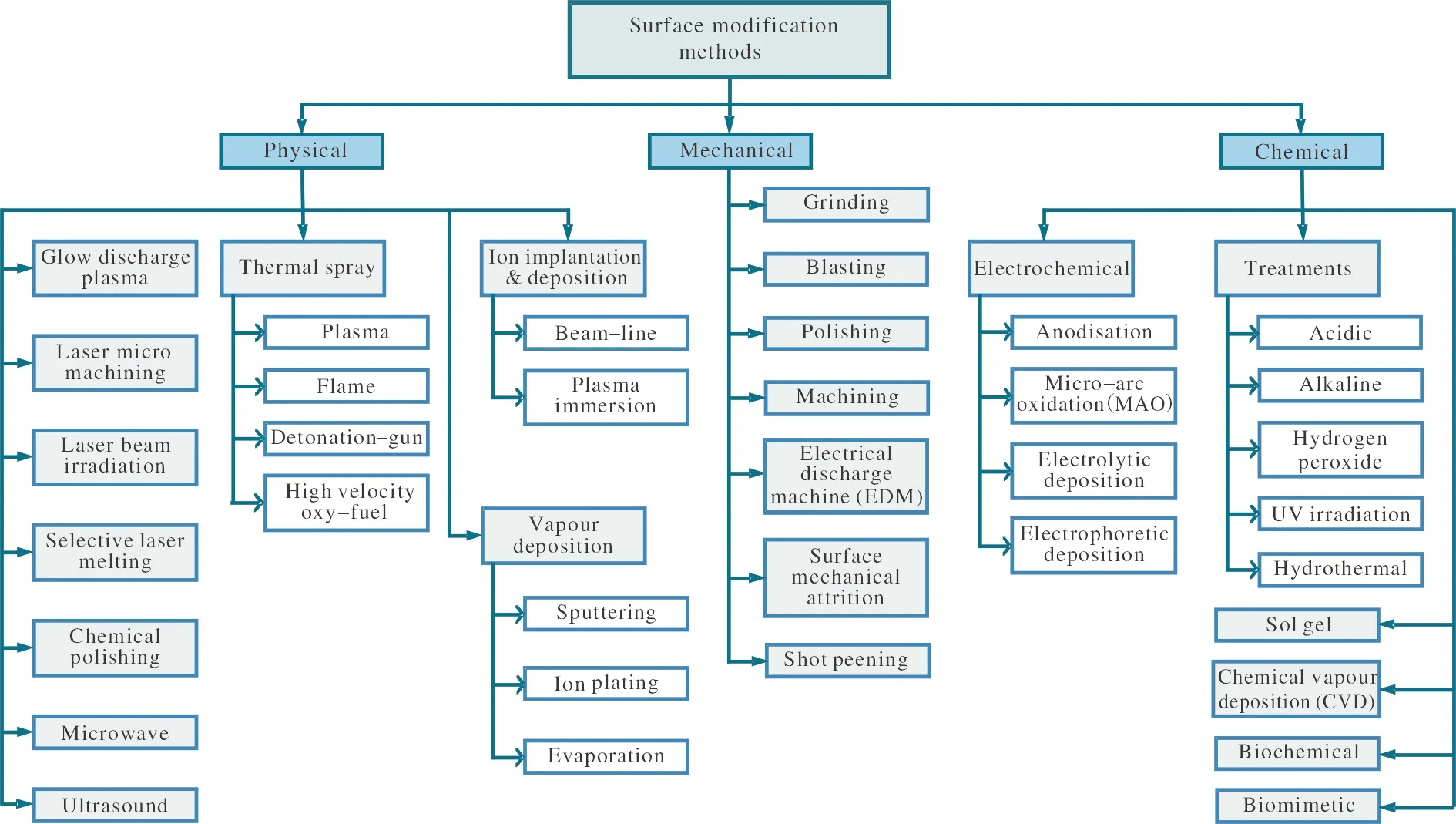
图2 钛及钛合金常用的表面改性技术[19]Fig.2 Common surface modification technologies for titanium and its alloys
物理方法包括利用热能、电能或动能制备涂层的热喷涂、辉光离子镀,基于现代激光技术的微加工、电子束辐照、选择性激光熔化,以及化学抛光、微波辐照和超声波处理等[19]。Pires等[20]对Ti-15Mo合金进行了激光辐照处理,研究了激光辐照处理对其体外细胞增殖试验中成骨细胞的增殖、形态和扩散的影响。结果表明,Ti-15Mo合金经过辐照处理后具有较高的生物相容性,能诱导细胞分化,在细胞增殖和生长方面具有优势。
常见的化学方法有酸处理、碱处理、电化学处理以及溶胶凝胶法、化学气相沉积法、生物化学法、仿生法等[21]。Salou等[22]通过阳极氧化处理,在钛及钛合金牙种植体表面制备出二氧化钛纳米管薄膜。该种植体植入兔股骨4周后,表面附着了大量骨组织,表现出良好的生物活性。
机械方法主要有研磨、抛光、喷砂、放电加工、喷丸等,通过这些方法能够改变植入物的表面形貌和粗糙度,有效消除表面污染,提高植入物与骨骼的结合强度。Wennerberg等[23]将经过Al2O3和TiO2喷砂处理的钛钉植入兔胫骨中,12周后测试了取出螺钉所需的扭矩。结果表明,喷砂钛钉取出时需要更高的扭矩,说明对骨的固定作用更好。
3 医用钛及钛合金表面涂层
3.1 耐蚀耐磨涂层
人体细胞外液中不仅含有较高浓度的氯离子,还存在能够加速腐蚀的氨基酸和蛋白质,会对植入物产生腐蚀作用。而人工关节在运动时会与人体自身的骨骼相互摩擦,产生数十亿的细微颗粒[24]。人工关节、牙种植体等部件会同时面临腐蚀和磨损的双重作用,导致腐蚀磨损的发生。在钛及钛合金基体表面制备耐蚀耐磨涂层能够为基体提供更充足的保护,提高植入物的耐蚀性和耐磨性。目前,常用于制备钛及钛合金表面耐蚀耐磨涂层的材料有TiN、TiAlN、TiO2、类金刚石(DLC)等。
TiN涂层硬度高,耐磨性也较好。Pappas等[25]对表面涂覆TiN涂层的人工髋关节进行了体外摩擦磨损试验。结果表明,表面涂覆有TiN涂层的人工髋关节磨损量小于2 μm,且没有出现穿孔、剥落等现象,验证了其良好的耐磨性。TiN涂层还具有较好的稳定性,能够改善基体的耐蚀性。Hendry等[26]在TC4钛合金表面制备了TiN涂层,并在Hank’s溶液中进行了耐蚀性的对比测试。结果表明,没有涂层的TC4钛合金在腐蚀介质中发生了较严重的腐蚀,而表面制备TiN涂层后耐蚀性明显增强。Raaif[27]通过射频等离子体磁控溅射工艺在纯钛表面制备了TiN涂层,该涂层能够紧密附着在基体上,显著提高基体的硬度,具有优异的摩擦学性能和耐蚀性。Cui等[28]通过磁控溅射法在TC4钛合金表面制备了纳米Ti/TiN复合涂层,这种复合涂层有利于基体与涂层之间生长应力和热应力的释放,提高结合强度,并且该涂层结构致密,能够提高钝化速度,化学稳定性高,耐蚀性好。在Hank’s溶液中的腐蚀磨损试验结果表明,较高的抗塑性变形能力和耐腐蚀性能使Ti/TiN涂层试样的开路电位(OCP)和摩擦系数几乎保持恒定,耐腐蚀磨损性能与基体相比提高了100倍。Zhao等[29]采用多弧离子镀膜技术在TC4钛合金表面制备了TiN涂层和Ti/TiN复合涂层,二者硬度相差不大,都远高于基体。相比TiN涂层,Ti/TiN复合涂层中的Ti层能有够效抑制TiN柱状结构的生长,缺陷少,孔隙率低,在模拟体液中表现出更优异的耐摩擦腐蚀性能。
由于TiN涂层的耐磨性不足,耐摩擦磨损性能更好的TiAlN、TiO2等涂层材料受到了越来越多的关注。Çomak[31]通过阴极电弧物理气相沉积工艺在Ti45Nb合金表面分别沉积了单层TiN、TiAlN涂层以及TiAlN/TiN复合涂层。与单层TiN、TiAlN涂层相比,TiAlN/TiN复合涂层在模拟体液(SBF)中的磨损率和摩擦系数更低。TiAlN/TiN复合涂层的晶粒尺寸小,晶界密度高,具有比单层涂层更高的承载能力,并且复合涂层的界面会阻碍位错运动,减少塑性变形的发生,硬度更高,因而具有更优异的耐蚀性和耐磨性。
TiO2涂层能够改善医用钛及钛合金的表面性能,如提高耐磨性[32]、耐摩擦腐蚀性能及生物相容性。Pantaroto等[33]通过磁控溅射法在纯钛表面制备了锐钛矿型、金红石型和混合型的TiO2涂层。与纯钛基体相比,涂层试样具有更好的电化学稳定性,而金红石型和锐钛矿型的双相TiO2涂层在具备较好耐蚀性的同时还具有更高的生物活性,能够吸附更多的白蛋白。Radi等[34]通过原子层沉积法(ALD)在TC4钛合金表面制备了TiO2涂层。该涂层的附着力高,摩擦系数低。林格氏液中的摩擦磨损试验表明,TiO2涂层在磨损后表面迅速形成新的钝化膜,摩擦系数远小于基体,且未出现磨损痕迹,显著改善了TC4钛合金基体的耐摩擦腐蚀性能和摩擦学性能。Bai等[35]首先通过多弧离子镀膜技术在纯钛基体表面制备了高硬度、高耐蚀性的TiN涂层,然后通过水热处理法在TiN涂层上制备了适当厚度的TiO2涂层。研究表明,TiO2涂层能够在不影响TiN涂层高硬度的前提下改善其润湿性,并进一步提高基体的耐蚀性和生物相容性。
DLC涂层具有硬度高、摩擦系数低、耐磨性好等特点,已在骨科和心血管领域展现出良好的生物相容性[36]。Allen等[37]对DLC涂层进行了细胞体外培养及大鼠肌肉和绵羊皮质部位的体内培养试验。结果表明,DLC涂层具有良好的生物相容性,但其硬度较高,摩擦过程中可能会将载荷转移到硬度相对较低的钛基体上,导致基体变形,使基体与涂层界面出现分层。Lukina等[38]通过物理气相沉积技术在TC4钛合金表面分别制备了TiN涂层和DLC涂层,并进行了往复式滑动摩擦磨损试验。结果表明,TiN涂层和DLC涂层都能够显著改善基体的耐磨性,但由于DLC涂层和基体的物理化学性质差异较大,附着力相对较低,其应用范围会受到限制。
在基体与DLC涂层之间制备过渡层能够提高涂层与基体的结合强度,改善涂层的附着力。Grabarczyk等[39]通过等离子体氧化法在TC4钛合金表面制备氧化层后叠加了TixCy中间层,最后通过射频等离子体辅助化学气相沉积法(RF-PACVD)制备了DLC涂层。在PBS溶液中进行摩擦磨损试验后,DLC涂层几乎无划痕,没有出现涂层脱落的现象,摩擦系数低,耐摩擦腐蚀性能好。Hatem等[40]在TC4钛合金表面制备SiC过渡层后,通过等离子全方位离子镀膜技术(PIID)沉积了DLC涂层。该涂层结构致密,边界不明显,硬度明显高于基体,耐磨性好,与基体结合强度较高。DLC涂层的电化学性能稳定,在PBS溶液中摩擦时电位变化幅度很小,与基体相比摩擦系数低,磨损痕迹浅,具有良好的耐摩擦腐蚀性能。
3.2 生物活性涂层
在钛及钛合金表面制备生物活性涂层能够提高钛及钛合金的血液相容性,使钛及钛合金在体内不易发生排斥反应,提高植入的成功率。目前研究最多、应用最广泛的生物活性涂层是羟基磷灰石(HA)及其复合涂层。
羟基磷灰石(Ca10(PO4)6(OH)2)是人体硬组织的主要无机组成成分之一,当其作为植入物涂层使用时,其中富含的钙离子和磷酸根离子会游离出涂层表面而被人体组织吸收,促进成骨细胞的黏附和聚集[41],诱导新骨组织在周围骨组织和HA涂层上的双向生长。涂层表面特殊的孔洞结构还能促进植入物与骨组织间的键合。Nuswantoro等[42]通过电泳沉积法在Ti29Nb13Ta4.6Zr(TNTZ)合金植入物表面制备了HA涂层,并将其植入大鼠胫骨进行生物学性能评价。结果表明,带有HA涂层的TNTZ植入物具有更好的骨整合能力,能够减少炎症反应;植入2周后,在涂层表面能够观察到形成的软骨细胞,且成骨细胞数量较多,而无涂层的TNTZ植入物表面以肉芽组织为主,说明出现了炎症。
在医用钛及钛合金表面沉积HA涂层能够减轻植入后的体内炎症,加速骨组织形成,但由于HA涂层与基体结合强度较差,在特定的生理环境或外力作用下可能出现脱落,导致植入物提前失效[43]。Kim等[44]采用磁控溅射法在Ti29Nb5Zr合金表面先制备了与基体结合力较强的TiN涂层作为缓冲层,再在TiN涂层表面制备具有优异生物活性的HA涂层。与单层TiN、HA涂层相比,复合涂层与基体的结合强度更高,耐蚀性更好。Kazemi等[45]在TC4钛合金表面通过等离子化学气相沉积技术和溶胶-凝胶法制备了HA/TiN复合涂层。该复合涂层微观结构精细,与基体的结合强度高,且表面更为粗糙,能够加速成骨细胞的生长。Rafieerad等[46]采用电泳沉积法在Ti6Al7Nb合金表面制备了羟基磷灰石-氧化锆(HA-ZrO2)复合涂层。该涂层表现出超亲水性,5 d内即可在SBF溶液中产生磷灰石,能够显著提高细胞的相容性。Bansal等[47]通过等离子喷涂法在Ti13Nb13Zr合金表面制备了厚度均匀的HA-ZnO涂层,改善了Ti13Nb13Zr合金的润湿性、硬度和耐蚀性。通过制备复合涂层能够在保留HA涂层良好生物活性的同时提高其与基体的结合强度,解决涂层易脱落的问题。
3.3 表面抗菌涂层
医用钛及钛合金植入人体后由于局部免疫系统受到植入手术的干扰,并且植入区域的血管较少,导致植入物/人体组织界面的防御能力下降,容易出现细菌或微生物黏附的现象,导致组织感染。细菌黏附会形成成熟的细菌生物膜,即使使用抗生素也很难完全清除,还有可能导致耐药菌株的出现[48]。而在植入物表面制备抗菌涂层则是减少感染发生的一种简单有效的方法。
医用钛及钛合金的表面抗菌涂层分为惰性抑菌涂层和活性杀菌涂层2类[49]。惰性抑菌涂层不会主动释放抗菌成分,主要通过表面形成抑制细菌黏附的结构或抗菌化合物达到抗菌效果,但这类抑菌涂层在外力作用下的黏附效果未知[48],还需要大量的实验验证。活性杀菌涂层通过释放杀菌成分来实现抗菌,为了避免耐药菌株的出现以及其他风险,目前添加银 (Ag)、铜 (Cu) 、锌 (Zn)等抗菌金属元素的非抗生素涂层受到了越来越多的关注。
Ag具有较强的广谱抗菌特性,不易产生耐药性。在钛表面通过磁控溅射制备Ag镀层可有效杀灭大肠杆菌及金黄色葡萄球菌。钛基体表面附着少量的Ag离子即可保证较好的抗菌效果[50]。Xu等[51]首先采用等离子喷涂法在纯钛表面制备HA涂层,然后在AgNO3溶液中进行水热处理,制备了含有磷酸银化合物的HA涂层。该方法在保证HA涂层生物相容性的同时使其具备了优异的抗菌性能,具有广阔的应用前景。Jin等[52]通过电镀和紫外线还原法在钛基体表面制备了石墨烯-Ag涂层,该涂层对变形链球菌和牙龈卟啉单胞菌的抑制作用非常突出,有望在生物医学领域得到应用。
然而,有学者认为当涂层中的Ag离子浓度达到一定值后会出现细胞毒性[54]。为了避免Ag离子对人体产生毒性影响,He等[55]采用磁控溅射与微弧氧化相结合的方法在钛片上制备了含Sr和Ag的TiO2涂层。添加Sr有望减轻过量Ag导致的潜在细胞毒性,二者和TiO2涂层的协同作用使涂层具有长久的抗菌性和良好的细胞相容性,促进了成骨细胞的扩散和分化。
Cu能够与蛋白质中的硫原子配位,使细菌中的酶失去活性,阻断细菌的生物合成,因而Cu对多种细菌都具有良好的抗菌性能[56]。He等[57]采用磁控溅射和退火处理相结合的方法在钛表面制备了TiO2/CuO涂层。研究表明,该涂层无明显毒性,能刺激成骨细胞的扩散和增殖,还具有优良的耐蚀性及对金黄色葡萄球菌的抗菌能力。
Zn作为人体骨骼中重要的微量元素,也具备一定的抗菌能力[58]。Zhang等[59]通过在电解质中添加乙酸锌,然后采用MAO法在纯钛表面制备了掺杂Zn的TiO2涂层。该涂层在具有出色抗菌性能、良好耐蚀性的同时,还具备良好的生物相容性,适合用作生物医学涂层。
4 结 语
通过制备耐蚀耐磨涂层、生物活性涂层和表面抗菌涂层能够有效拓宽医用钛及钛合金的应用领域。但由于人体生理环境复杂,目前的涂层制备工艺还不能完全满足钛及钛合金作为临床医学植入物使用的要求。存在的问题主要有涂层与基体结合力较弱、单一制备工艺不能够满足多种医学性能要求等。为了解决上述问题,已研发出多种复合涂层制备工艺,多组元、多层复合涂层已经成为医用钛及钛合金表面涂层研究的新方向。进一步探究植入物表面与人体细胞之间的相互作用,研究开发新的制备工艺,或是在钛及钛合金表面设计合理的多功能复合涂层将成为钛及钛合金表面涂层的主要研究方向,相信通过这些途径能够在现有研究的基础上实现新的跨越,获得生物性能更好的医用钛及钛合金。

