6种番茄叶表皮制片方法比较
宋艳波 杨云浩 段鹏军 王嘉浩 魏丝晴 张亚龙
摘要:结合番茄叶片结构特点,采用6种表皮制片技术对番茄叶片下表皮进行装片,并对不同方法的制片过程和观察效果进行比较研究。结果表明,番茄叶片薄,表皮为单层细胞,其上着生有丰富表皮毛,下表皮与疏松的海绵组织相邻;表皮撕取法和透明胶带粘取法可以真实地观测气孔大小、密度等静态性状指标和气孔开度等动态行为;因番茄叶柔软,刮片法对操作要求极高,而解离法不但用时长且效果不佳,都不适宜番茄叶下表皮制片;可撕拉型指甲油印迹法能获得气孔指数和气孔开度的印痕,但对叶片有一定损坏,而硅胶-指甲油双阶段印迹法对叶片没有损伤,可以多次印迹同一叶片相同部位,连续观测气孔运动及发育等动态行为。研究结果可为不同研究选择适合的番茄叶表皮制片方法提供依据。
关键词:番茄;表皮制片;气孔;显微观察;方法比较与改良
中图分类号:Q94-3文献标志码:A论文编号:cjas2021-0093
Comparison Study of 6 Kinds of Tomato Leaf Epidermis Slice Techniques SONG Yanbo, YANG Yunhao1, DUAN Pengjun2, WANG Jiahao1, WEI Siqing1, ZHANG Yalong1
(1College of Life Sciences, Shanxi Agricultural University, Taigu 030801, Shanxi, China;
2College of Information Science and Engineering, Shanxi Agricultural University, Taigu 030801, Shanxi, China)
Abstract: This paper adopted six kinds of leaf epidermis slice techniques to treat lower epidermis of tomato leaves considering their structural characteristics, and compared the preparation process and observation effect of different techniques. The results show that tomato leaves are thin, the epidermis is single-layer cell with abundant epidermal hairs, and the lower epidermis is adjacent to the loose spongy tissue. Static characteristics, such as dynamic behavior of stomatal size, density and stomatal aperture, could be observed by skin peeling method and cellophane tape sticking method. Due to the softness of tomato leaves, the scraping method is extremely demanding to operate, and dissociation method is time-consuming and has poor effect, both the techniques are not suitable for the slice production of tomato leaf epidermis. Tearable nail oil blotting method could obtain the imprint of stomatal index and stomatal aperture, while the leaves would be damaged certainly. Silica gel-nail polish two-stage blotting method has no damage to the leaves, the same part of the same leaf could be imprinted continuously without scathe, and in this way, the dynamic behavior like stomatal movement and stomatal development could be observed continuously. The results could provide a basis for selecting suitable tomato leaf epidermis preparation methods for different research purposes.
Keywords: Tomato; Leaf Epidermis Slice Techniques; Stoma; Microscopic Observation; Method Comparison and Improvement
0引言
番茄(Solanum lycopersicum)在世界各地廣泛种植[1-2],全球年总产量位居蔬菜之首[3]。番茄果肉多汁,香气独特,色泽艳丽,营养丰富,为人体提供Vc、K和叶酸[4]等必需营养,以及占人体需要量达80%以上的番茄红素[5]。番茄红素是一种强大的天然抗氧化剂,具有免疫调节、抗炎、抗肿瘤等作用[6-8]。番茄是世界食品加工业的重要原料,2018年用于番茄浓缩物、番茄浆和番茄泥等加工的番茄就达1.8亿t[6],近年来,还被用于药品和化妆品等的生产[2,9]。鲜食和加工市场的增长使番茄成为世界上最重要的作物之一[10-11],培育优质的番茄果实是科研和生产的重要任务。
气孔是由一对保卫细胞环绕的微孔,通常存在于植物的地上部分,多出现于叶片下表皮上[12-13]。虽然气孔总面积可能只占植物叶表面的不到3%,却承担着植物约98%的CO2吸收和水分散失的功能[15],同时在应对生物[16-17]和非生物胁迫[8,17-18]方面也发挥着重要的作用,因此,气孔被视作植物生产力的关键[19]。对气孔密度、大小、形状和开度等气孔特性进行观察,研究其与植物光合、蒸腾等生理代谢及各种生长环境的相关关系,可为调控植物在不同环境下的生长、提高产量和品质奠定基础。
目前,研究气孔特性的主要手段还是植物叶表皮显微制片法,这种方法不但具有操作简单和成本低廉等优势,而且在长期实践中经过不断发展和改良形成了多种不同的操作技术。例如,王等[20]使用印迹法获得超表达胡萝卜DcABF3基因的拟南芥叶表皮细胞制片,经观察和统计发现转基因植株叶片气孔密度和气孔指数增加,导致其耐旱性下降;Haworth等[21]采用硅胶-指甲油双阶段印迹法对包括蕨类、裸子植物和被子植物在内的31种不同植物叶表皮进行制片观察,统计气孔指数和气孔密度,结合从光稳态到黑暗过程中气孔导度变化的速度(PP-Systems测定),探究气孔在植物进化过程中所起的重要作用;Tao等[22]根据双子叶植物不同叶片组织特点采用了不同叶表皮制片技术,对表皮毛少而脆的烟草等双子叶植物使用琼脂糖印迹法,而对表皮毛多的大豆等双子叶植物使用透明胶带粘取法,获得这些植物气孔等表皮细胞清晰影像,满足了对表皮细胞进行精确统计分析的需求。而在番茄研究中可见多种不同叶表皮制片技术的应用,Nazir等[18]采用解离方法获得番茄叶片表皮细胞制片,观察重金属对气孔保卫细胞的破坏;Li等[23]通过直接撕取叶表皮方式进行制片,观察了番茄叶片气孔长和宽,并计算气孔导度(气孔长与宽之比);Bian等[24]采用指甲油印迹获得番茄叶表皮制片,通过测定气孔宽度和长度获得气孔开度,发现绿光处理的番茄叶片气孔导度下降,使其在短期干旱下提高植株的内在水分利用效率,保持了较高光合效率。Farber等[25]利用印迹技术分别观察测定了过表达细胞分裂素(CK)降解酶的转基因番茄植株、CK处理番茄植株与野生型番茄植株的叶片气孔孔径和密度,发现CK含量高时可以增加番茄叶片气孔密度并间接促进蒸腾作用;而低水平CK通过降低气孔密度、抑制叶片生长和促进叶片衰老来抑制蒸腾,从而提高了对长期干旱的适应性。
番茄叶具有表皮薄且表皮毛多等特点,导致不同表皮制片技术效果差异较大,目前缺少对番茄叶片制片技术的相关改进与探讨研究。笔者在番茄叶片解剖基础上,对6种制片技术方法进行改进,并对不同制片技术所用时间、制片难易度、取样定位性、装片清晰度和气孔真实性等进行记录和比较,以期为番茄气孔等表皮细胞形态特征和动态行为等不同研究目的匹配最适合的表皮制片技术。
1材料与方法
1.1试验材料
1.1.1试验材料的培养以上海市长征良种实验场培育的‘合作909’番茄为试验材料。
将番茄种子放入水中浸泡1~2 h,接着用55℃温水搅拌5~10 min,再次放入水中3~4 h;最后用70%甲基托布津1000倍液处理5~10 min,无菌水冲洗3~5次。
于高7.5 cm、半径8.5 cm的圆柱形营养钵(体积约0.43 dm3)中放入营养土,浇透水,在表面打3个2~3 cm深的孔,每个孔中放入2粒番茄种子,覆土。每12盆放入1个塑料托盘中,托盘内水位保持约1 cm,覆膜并置于培养箱中催芽和培养。催芽条件为28℃和40%湿度,时间5~8 h;培养条件为27℃(11 h光照)/17℃(13 h黑暗),40%湿度,1700μmol/(m2·s)光照强度,待苗出齐1周后揭膜,长至2~3片真叶时分苗为1株/盆,继续培养2个月,在植株开花前进行取样观察。
1.1.2仪器与试剂试验所用的仪器主要有正置荧光显微镜(DM6B,Leica,维玆拉,德国),人工气候箱(RXZ-250,宁波,中国),硅胶(弹性体印模材料0型,美佳印?,山东,中国),载玻片,盖玻片,透明胶带(宽4.20 cm),30%过氧化氢-醋酸1:1液,无色透明指甲油(可撕拉型与不可撕拉型各1种)。
1.2试验方法
以番茄顶端向下第一片成熟叶片的下表皮为制片部位,据不同制片方法使叶片离体或不离体,蒸馏水冲洗叶片,滤纸吸干水分,按下述方法进行制片,每个方法做5个装片。
1.2.1表皮撕取法表皮撕取法参照Li等[23]的方法加以改动。将叶片背面朝上绕左手食指贴合(叶柄朝向自己),用拇指和中指压住叶片的基部和尖部。选取叶片中部2个平行侧叶脉为起始端和终端,用刀片在平行脉间与叶脉垂直轻轻划2道,深度以划开表皮为宜,这2条线和2个平行叶脉组成需要样本表皮大小,右手拿镊子于起始端侧脉平行并轻轻提起表皮,缓缓向终端侧脉提拉,剪去撕下的表皮边缘沾有叶脉及叶肉细胞的部分,使制片平整。放于滴有2~3滴蒸馏水的载玻片上,待表皮展开后,用滤纸吸去多余水分仅保留1层水膜避免产生气泡,于显微镜下观察。
1.2.2透明胶带粘取法透明胶带粘取法在参照陈等[26]和Tao等[22]方法的基础上,根据番茄特点适当加以改良。剪下长约10 cm的胶带,胶面朝上平铺在实验台上;将叶片正面沿叶尖至叶基贴在胶面上,铺平叶片并剪去叶柄;将胶带从叶尖部向上对折,使叶片背面按尖端到基部的顺序紧贴胶带的胶面;并用镊子尾端隔着胶带顺着叶脉在叶脉间朝同一方向反复刮过,直至叶片背面由淡绿变为深绿色,目的是使胶带紧贴表皮;然后,缓慢分开胶带,叶片下表皮随之分离并粘在胶带上。用剪刀剪取所需部位,放在滴有蒸馏水的载玻片上,吸去胶片边缘多余的水并带出气泡,然后盖上盖玻片压平观察。
1.2.3指甲油印迹法指甲油印迹法参照王萍等[20]的方法,贴合番茄叶片特征進行。将叶片背面朝上放于实验台上,也可直接在植株上操作。用涂指甲油的小刷子或棉签在叶片背面顺着叶脉在脉间均匀刷一层薄薄的指甲油,静置30 min,待指甲油自然晾干后,用镊子直接撕下油膜,仅留下印有表皮细胞形状的油膜,用蒸馏水洗去组织残留物并剪裁所需观察部位,放在滴有蒸馏水的载玻片上,吸水盖片,压平观察。
1.2.4硅胶-指甲油双阶段印迹法硅胶-指甲油双阶段印迹法参照Haworth等[21]的方法,使用适宜番茄叶片的最佳时长进行。
据产品说明书将2种硅胶印模材料混合后,均匀地涂在叶片下表皮上,静置25 min,取下硅胶,在接触叶面的一侧硅胶上可见清晰的叶脉和气孔印迹;待硅胶晾干,在留有印迹的硅胶面上再刷上一层指甲油, 15 min后取下晾干的指甲油膜,根据需要裁下所需观察的对应部位,放于滴有蒸馏水的载玻片上,吸水盖片,压平观察。
1.2.5解离法参照Nazir等[18]的方法,选出最适解离时长进行。将叶片切成边长0.5 cm的小正方形后放入盛有30%过氧化氢-醋酸溶液的烧杯中,并于60℃恒温水浴解离30 min,之后将叶片轻轻取出置于装着蒸馏水的培养皿中,用镊子去除解离下的破碎组织和细胞,再将叶片下表皮置于滴有蒸馏水的载玻片上,吸水盖片观察。
1.2.6刮片法以温寿星等[27]的方法为基础,改动以缩短时长、降低叶片破损概率。将叶片正面朝上放于实验台上,用双面刀片沿叶脉间从一侧向另一侧轻轻地反复刮擦,以去除上表皮和叶肉组织,只留下透明的下表皮,裁剪所需观察区域并放在滴有蒸馏水的载玻片上,吸去多余的水后直接观察。
1.2.7番茄叶片的石蜡制片石蜡制片参照宋杰等[28]的方法进行。选择发育正常、健康、有代表性的叶片,用刀片从植株上割下后用FAA固定,经脱水、透明、透蜡、包埋后切片、脱蜡、染色后封藏观察。
1.2.8叶表皮样本观察与记录制好的番茄叶表皮样本或载有表皮印痕的油膜样本放在正置荧光显微镜下观察,用Leica Application Suite X(LAS X)软件人工操作并拍摄。可先在高亮度、低TL-视场下定位,再进入明场界面调节光强度和焦距,并将物镜逐级调至40×。同一装片选取10个不同视野拍摄图片(图片大小为3840像素×2400像素)并存储。
2结果与分析
2.1番茄叶组织结构特点
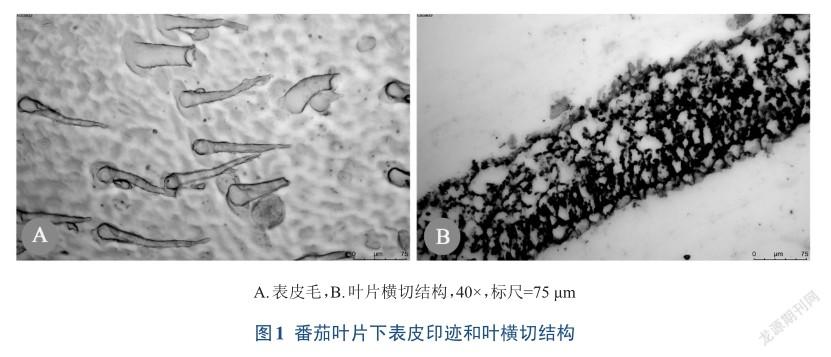
通过石蜡制片获得番茄叶片横切结构(图1B),叶片厚度为(154.3±5.1)μm,表皮为单层细胞,表皮细胞壁薄;有明显的栅栏组织和海绵组织的分化,叶背面的下表皮与疏松海绵组织相邻;同时从下表皮制片可见(图1A),其表皮上附有大量的表皮毛。这些结构特点决定了不同下表皮制片技术的难易程度和制片效果的优劣。
2.2撕取表皮和胶带粘取法对番茄叶表皮制片效果
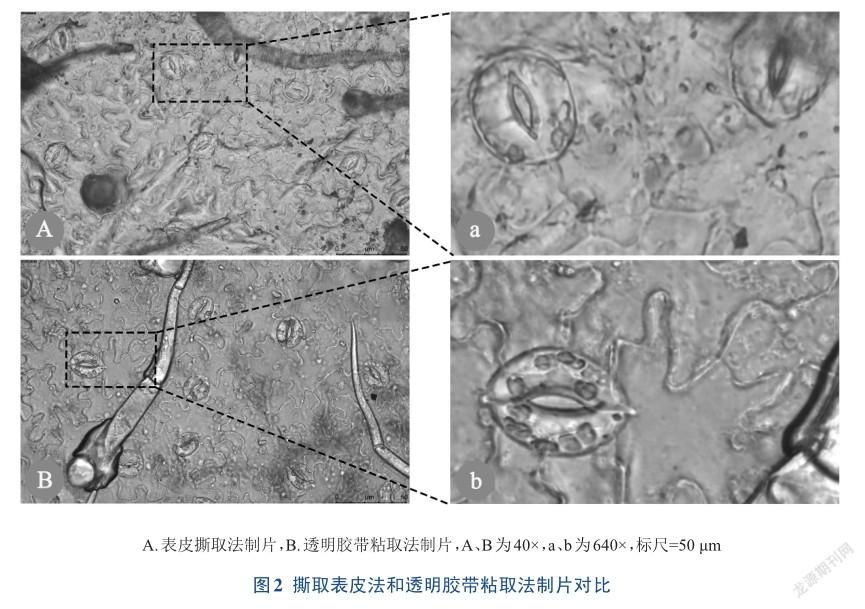
采用撕取表皮的方式是最简单而直接的植物叶表皮制片法,尤其适合表皮与叶肉细胞间组织疏松的植物,如菠菜、油菜和紫鸭跖草等,容易撕取下表皮。而撕取玉米和小麦等表皮与叶肉组织结合紧密的植物下表皮,常因带下叶肉细胞影响观察[20]。撕取番茄表皮装片观察结果如图2A,气孔和表皮细胞轮廓清晰,色泽自然,偶尔会有少量叶肉组织残留但不影响观察效果,图片上黑色的圆点是垂直于表皮生长的表皮毛。虽然番茄与叶肉组织结合不是很紧密,但是因番茄叶片柔软,在撕取表皮时要利用巧劲,要准确快速,尤其初始提拉表皮时若提拉次数过多,就会损坏样本,只能换取样部位或叶片;若从制片到观察时间过长,表皮细胞易失水皱缩变形。
用胶带粘取表皮也是植物叶表皮制片法的首选,经济快速,并可以固定气孔等表皮细胞形状,避免因细胞失水而导致变形,真实地反映气孔开度变化,并适于大量样品的观察。用胶带粘取不同植物叶下表皮的难易程度,主要取决于叶幼嫩程度和叶表面的洁净程度[26],此外,也与叶组织特点有关,如姜成东等[29]研究指出,由于杧果叶片质地坚硬,上下表皮、叶肉及叶脉之间结合紧密,即使使用多种透明胶带也无法粘取到杧果叶片下表皮。用胶带粘取番茄叶表皮前要保证叶片的洁净,当胶带平整的粘在表皮上后,要以合适的力度压胶带,使胶带与表皮贴合,压的力量过小则表皮粘不下来,力量过大会把叶肉细胞一起粘下来。其装片观察结果如图2B,气孔和表皮细胞清晰可见,叶肉残留不多,不影响清晰度,定位性好,很好地呈现表皮毛形态和气孔开度变化,装片可在30 min内多次观察,不会发生失水变形的现象。
2.3刮片法和解离法对番茄叶表皮制片效果
刮取表皮是指用刀片等工具除去上表皮和叶肉组织,只留下下表皮,其最大优点是可以较好地保持叶表皮的原始状态,但对刮制时力度和角度等操作技术要求较高[30],过轻会残留叶肉细胞,过重会刮破叶片[31-32],在刮取番茄叶表片制片中也存在同样的问题,尤其番茄叶片薄而软,很难获得理想的效果,如图3A,番茄叶肉组织残留较多,气孔等表皮细胞结构不清晰。
解离法是利用化学试剂破坏叶片的叶肉再剥离表皮的方法,其目的是减少叶肉细胞干扰,得到较清晰的装片,适合于叶片表面有蜡质层等发达的保护组织及表皮细胞较厚的木本植物等,不适用于海绵组织较疏松、表皮细胞较薄的草本植物[33]。对于番茄叶片而言,解离法制片用时过长,且解离时间掌控困难,时间稍短会解离不完全,残留叶肉;稍长会腐蚀表皮细胞,使表皮破碎,难以取得需要的制片部位,这与封涛和师长海等[31,34]研究的结果一致。用该法获得的番茄叶表皮装片如图3B,虽没有明显叶肉残留,可以看出气孔等表皮细胞轮廓和气孔分布,但不适合气孔开度观察。
2.4印迹法对番茄叶表皮制片效果
印迹法是将指甲油和火棉胶等胶性材料涂在葉片表面,取风干后的胶膜为材料进行观察的制片方法[31],此方法操作简单快速,定位性好、取样面积大,且可以重复印迹相同叶片。分为单阶段印迹法和双阶段印迹法。

b
单阶段印迹法是只用一种胶性材料通过一次印迹获得气孔等表皮细胞的印痕。最常用的是指甲油,操作简单,薄膜易撕取,图像不受叶绿体干扰。采用该法获得番茄叶表皮印痕并进行观察,如图4A、B分别为可撕拉型和不可撕拉型指甲油印迹,可见前者清晰度明显高于后者,满足表皮和气孔轮廓及气孔开度观察;但是由于番茄表皮毛过多,制得的薄膜欠平整,需要调整焦面才能对整个视野进行观察,这类问题也常出现于牛皮胶印迹法[35]和火棉胶印迹法[36]中;制作过程发现涂布指甲油,尤其是不可撕拉型指甲油后会出现叶片皱缩损坏现象,这与番茄叶片过软有关。楼柏丹等[33]在生菜上也观察到同样的现象,于是认为指甲油印迹法更适用于表皮毛少的硅质化和栓质化叶片。
硅胶-指甲油属于双阶段印迹法。先用对叶片无害的硅胶材料获得叶表皮细胞印痕,再用指甲油对硅胶上的印痕二次复印,这种方法可以多次印迹相同叶片,获得气孔密度和分布等数据,并可以粗略获得气孔开度等信息。采用该法获得番茄表皮印痕(图5),表皮细胞轮廓分明,气孔形状清晰,开度可辨,其明显的优势是对叶片没有损坏,并且可多次印迹,是跟踪气孔发育和气孔运动行为的最佳方式,这与Wu等[37]在拟南芥上研究的结果一致。
2.5 6种表皮制片方法对番茄叶表皮制片效果比较
由表1可知,撕取法和透明胶带法都可以得到清晰度与真实性俱佳的表皮装片,其中撕取法用时短但取样面积小,适用于快速小面积的观察;透明胶带法用时长但取样面积大,适用于对定位性有要求的大面积表皮观察。指甲油印迹法和硅胶-指甲油印迹法都有较大的取样面积和足够的清晰度且操作简单、无叶肉干扰,尤其硅胶-指甲油印迹法可以多次印迹同一叶片,适宜观察气孔的开度和发育等动态变化。解离法和刮片法都会对番茄葉片造成极大的损伤,解离法将叶肉解离下来,可以获得较清晰的图片,但定位性不好,用时过长;相对而言,刮片法的定位性和真实性更好,但有大量叶肉残留,致使其清晰度不佳。
3结论与讨论

气孔是提供气体交换和调节蒸腾及应对逆境与非逆境胁迫的重要组织器官。对于成熟的叶片,气孔的物理和外形特征(如气孔密度、气孔大小和形状)是相对稳定的,这些特征限制了气体交换速率[38]和光合性能,如气孔少而大的植物光合速率往往低于气孔多而小的植物[39],相对于气孔的开闭运动,这些气孔性状属于静态的行为指标。气孔因2个保卫细胞水势的变化而张开或关闭,这种动态气孔行为控制着植物与大气间的水分和CO2的交换,对水分的亏缺和代谢的变化做出快速反应[40],如在短期干旱胁迫下,植物可以通过减少气孔开度调节蒸腾速率的途径来提高水分利用效率(WUE),从而最大限度地减少水分亏缺下的潜在产量损失[41];在短期盐胁迫下,植物通过优化气孔孔径来控制CO2同化和水分流失之间的平衡[42]。而在长时间的胁迫下,植物需要改变气孔的大小和密度等[43]实现高度的适应。然而,在一些作物品种中,较低的产量通常与严重或长期干旱胁迫导致的气孔关闭使光合作用下降有关[44]。Lawson等[45]研究认为光合作用与气孔导度呈正相关。Kinoshita等[20]在保卫细胞中过表达质子ATP酶,使气孔开度增加,使生物量增加到63%。总之,气孔的静态性状体现了气孔的基本性能,而动态性状是气孔功能的直接执行者。
在气孔的显微制片观察中,对气孔的动态行为和静态性状要区别对待,因为气孔的动态行为不仅要求气孔的轮廓清晰,还要保证气孔开度和导度的真实性,而气孔保卫细胞水势很容易发生变化,进而改变了气孔的开度;另外,气孔开度观察也有时效需求。基于此,笔者首次比较了6种常用表皮制片技术对番茄叶表皮装片效果,其中撕片法、胶带粘取法和刮片法都可以满足气孔静态性状和动态行为观察,但由于番茄叶片和表皮都薄,刮片法很难掌握力度和角度,叶肉残留影响制片效果;在取样面积和样本量不大时,撕片法可以观察气孔的真实行为和天然色泽;但若取样面积大和样本较多时,胶带粘取法可以保证不同样本间取样时间的一致性,因其可以对气孔等表皮细胞进行固定,为观察争取了时间。
相对于印迹法,胶带粘取和撕片法都对叶片有破坏,若想连续观察气孔的运动或气孔的发育,每个取样时间需要换取叶片,而叶片间差异是很大的,为了减小误差就需要增加取样量,而印迹法可以对同一叶片同一取样部位进行多次印迹,可以连续观察气孔运动行为和发育过程。曾斌等[46]用指甲油印迹法观察番茄同一叶片上不同时间表皮制片,取得了很好的效果。本研究发现,可撕拉指甲油印迹效果好于不可撕拉的指甲油;而双阶段印迹法更适合于番茄叶表皮制片的气孔静态指标及动态行为观察,尤其是对气孔发育动态研究方面是其他方法无法替代的,同时所用的硅胶对番茄叶片没有伤害,不会出现指甲油直接涂布时叶片皱缩等问题。
气孔是植物与外界联系的窗口,对气孔性状的观察和研究是了解气孔功能和调控植物生长发育的重要手段。笔者系统讨论了6种番茄功能叶表皮制片技术,为气孔静态性状、动态行为和发育等不同研究目的匹配适宜的方法提供了有力参考。但如何缩短双阶段印迹法制片时间,提升其观察效果仍然是未来值得关注的方向;另外适合水分含量高、叶片薄的幼叶和含水量少、叶片脆的老叶表皮装片技术也应该列入随后研究的重要内容,为植物叶片的功能研究和植物对环境的适应机理分析提供全面的信息。
参考文献
[1]SHUSEI Sato, SATOSHI Tabata, HIDEKI Hirakawa, et al. The tomato genome sequence provides insights into fleshy fruit evolution[J]. Nature: International Weekly Journal of Science,2012, 485:635-641.
[2]RamóNMaldonado-Torres,MORALES-CamachoJI, FERNANDO López-Valdez, et al. Assessment of techno-functional and nutraceutical potential of tomato (Solanum lycopersicum) seed meal[J]. Molecules,2020,25(18):4235-4235.
[3]李君明,项朝阳,王孝宣,等.“十三五”我国番茄产业现状及展望[J].中国蔬菜,2021(2):13-20.
[4]REIMERS Kristin J, KEAST Debra R. Tomato consumption in the United States and its relationship to the US department of agriculture food pattern: results from what we eat in America 2005-2010[J]. Nutrition today,2016,1(1):1-8.
[5]ROMANO R, LUCA L D, MANZO N, et al. A new type of tomato puree with high content of bioactive compounds from 100% whole fruit[J]. Journal of food science,2020,85(10):3264-3272.
[6]Perveen R, Suleria H, Anjum F M, et al. Tomato (Solanum lycopersicum) carotenoids and lycopenes chemistry; metabolism, absorption, nutrition, and Allied Health Claims- A comprehensive Review[J]. Critical reviews in food science and nutrition,2015,55(7):919-929.
[7]CHOKSI P M, JOSHI V Y. A Review on lycopene- extraction, purification, stability and applications[J]. International journal of food properties,2007,10(2):289-298.
[8]LI N, WU X, ZHUANG W, et al. Tomato and lycopene and multiple health outcomes: Umbrella review[J]. Food chemistry, 2020,343(3):1-40.
[9]GóMezprieto M S, CAJA M M, HERRAIZ M, et al. Supercritical fluid extraction of all- trans- lycopene from tomato[J]. Journal of agricultural & food chemistry,2003,51(1):3-7.
[10]CELMA A R, CUADROS F, F López-Rodríguez. Characterisation of industrial tomato by- products from infrared drying process[J]. Food & bioproducts processing,2009,87(4):282-291.
[11]BERGOUGNOUX V. The history of tomato: From domestication to biopharming[J]. Biotechnology advances,2014,32(1):170-189.
[12]ACHUO E A, PRINSEN E, H?FTE M. Influence of drought, salt stress and abscisic acid on the resistance of tomato to Botrytis cinerea and Oidium neolycopersici[J]. Plant pathology,2006,55(2): 178-186.
[13]普曉妍,王鹏程,李苏.亚热带森林附生植物叶片气孔特征及其可塑性对光照变化的响应[J].广西植物,2020,1(1):1-12.
[14]LAWSON Tracy, BLATT Michael R. Stomatal size, speed, and responsiveness impact on photosynthesis and water use efficiency[J]. Plant physiology,2014,164(4):1556-1570.
[15]DU M, ZHAI Q, LEI D, et al. Closely related NAC transcription factors of tomato differentially regulate stomatal closure and reopening during pathogenAttack[J]. The plant cell,2014(7):7.
[16]WIPHAWEE L, VU A L, AH- Fong A, et al. How does phytophthora infestans evade control efforts? Modern insight into the late blight disease[J]. Phytopathology,2018,108(1):1-9.
[17]BIAN Z, ZHANG X, WANG Y, et al. Improving drought tolerance by altering the photosynthetic rate and stomatal aperture via green light in tomato (Solanum lycopersicum L.) seedlings under drought conditions[J]. Environmental and experimental botany,2019,167:1-30.
[18]NAZIR F, FARIDUDDIN Q, HUSSAIN A, et al. Brassinosteroid and hydrogen peroxide improve photosynthetic machinery, stomatal movement, root morphology and cell viability and reduce Cutriggeredoxidativeburstintomato[J].Ecotoxicologyand environmental safety,2020,207:1-14.
[19]KINOSHITA Toshinori, TOH Shigeo, TORII Keiko U. Chemical control of stomatal function and development[J]. Current opinion in plant biology,2021,60(1):102010.
[20]王萍,邱念伟,侯文雨,等.“光和K+对气孔开度的影响”实验设计再优化[J].植物生理学报,2020,386(4):194-203.
[21]HAWORTH M, SCUTT C P, DOUTHE C, et al. Allocation of the epidermis to stomata relates to stomatal physiological control: stomatal factors involved in the evolutionary diversification of the angiosperms and development of amphistomaty[J]. Environmental& experimental botany,2018,151(1):55-63.
[22]TAO J J, CHEN S Y, ZHANG J S. Simple methods for screening and statistical analysis of leaf epidermal cells in dicotyledonous plants[J]. Bio-protocol,2016,6:1916.
[23]LI F, CHEN X, ZHOU S, et al. Overexpression of SlMBP22 in TomatoAffects Plant Growth[J]. Plant science,2020,301(1):1-12.
[24]BIAN Z, ZHANG X, WANG Y, et al. Improving drought tolerance by altering the photosynthetic rate and stomatal aperture via green light in tomato (Solanum lycopersicum L.) seedlings under drought conditions[J]. Environmental and experimental botany,2019,167:1-30.
[25]FARBER M, ATTIA Z, WEISS D. Cytokinin activity increases stomatal density and transpiration rate in tomato[J]. Journal of experimental botany,2016,67(2):6351-6362.
[26]陳佰鸿,李新生,曹孜义,等.一种用透明胶带粘取叶片表皮观察气孔的方法[J].植物生理学通讯,2004,40(2):215-218.
[27]温寿星,郭祥桃,黄镜浩,等.观察柑橘叶片表皮细胞与气孔结构的简易制片方法[J].东南园艺,2016,4(6):21-23.
[28]宋杰,李树发,李世峰,等.遮阴对高山杜鹃叶片解剖和光合特性的影响[J].广西植物,2019,39(6):94-103.
[29]姜成东,蔡胜忠,卢业凌.杧果叶片气孔观察方法研究[J].热带农业科学,2008(3):23-24.
[30]王培,陈玉蓉,方仁,等.用保卫细胞鉴定花粉植株倍性方法的研究[J].中国农业大学学报,1989,6(2):141-146.
[31]师长海,李玉欣,董宝娣,等.禾本科植物叶片表皮气孔观察的样品制备方法改良[J].植物生理学通讯,2010,46(4):395-398.
[32]陈娜,王婧.白及叶片气孔观察方法的研究[J].安徽农业科学, 2015,43(25):80-82.
[33]楼柏丹,姚岚.几种观察植物表皮气孔方法的比较[J].生物学教学, 2015,40(9):42-43.
[34]封涛,胡东.单子叶植物叶片气孔观察方法改良的研究[J].植物研究,2008(1):82-84.
[35]黄新敏,何生根,李红梅,等.月季’卡罗拉’切花的气孔观察及特征[J].仲恺农业工程学院学报,2013,26(4):8-12.
[36]苏云松,郭华春,杨雪兰.马铃薯叶片气孔观察方法的比较研究[J].中国马铃薯,2009,23(1):37-39.
[37]WU S, ZHAO B. Using clear nail polish to make arabidopsis epidermal impressions for measuring the change of stomatal aperture size in immune response[M]. Methods Mol Biol,2017: 1578-1578.
[38]ZWIENIECKI Maciej A, HAANING Katrine S, BOYCE C Kevin, et al. Stomatal design principles in synthetic and real leaves[J]. Journal of the royal society interface,2016,13:1-7.
[39]DRAKE P L, FROEND R H, FRANKS P J. Smaller, faster stomata: Scaling of stomatal size, rate of response, and stomatal conductance[J]. Journal of experimental botany,2012,64(2):495-505.
[40]魏爱丽,董惠文,李雨春,等.小麦抗病性与气孔特性关系初探[J].作物杂志,2010,36(3):23-25.
[41]MARTIN-Stpaul, DELZON S, COCHARD H. Plant resistance to drought depends on timely stomatal closure[J]. Ecology letters,2017, 20(11):1437-1447.
[42]TAHIR A, RASOULI F, CHEN Z H, et al. A comparative analysis of stomatal traits and photosynthetic responses in closely related halophytic and glycophytic species under saline conditions[J]. Environmental and experimental botany,2020,181(1):104300.
[43]ALI Kiani-Pouya, UTE Roessner, NIRUPAMA S, et al. Epidermal bladder cells confer salinity stress tolerance in the halophyte quinoa and Atriplex species[J]. Plant, cell & environment,2017,40(9):1900-1915.
[44]MAFAKHERI A, SIOSEMARDEH A, BAHRAMNEJAD, et al. Effect of drought stress on yield, proline and chlorophyll contents in three chickpea cultivars[J].Aust J crop Ssci,2010,4(8):580-585.
[45]LAWSON T, TERASHIMA I, FUJITA T, et al. A Platform for PerformingPhotosynthesis[A].//CoordinationBetween Photosynthesis and Stomatal Behavior[M]. Springer international publishingAG,2018:141-161.
[46]曾斌,王慶亚,唐灿明.三个转Bt基因抗虫杂交棉杂种优势的解剖学分析[J].作物学报,2008(3):496-505.

