痛风病人周围血中性粒细胞外诱捕网的测定及其意义
谭 悦,刘 童,陆继娣,余家静,王亚辉,李兴锐
痛风性关节炎是由单钠尿酸盐(monosodium urate,MSU)晶体沉积引发的关节炎症性疾病,该过程由先天免疫系统吸引、激活巨噬细胞和中性粒细胞所介导。中性粒细胞外诱捕网(neutrophil extracellular traps,NETs)是指包含细胞外DNA骨架、组蛋白和中性粒细胞髓过氧化物酶、中性粒细胞弹性蛋白酶或钙颗粒蛋白等的细胞外网状纤维结构,其形成是中性粒细胞经感染或其他刺激后,刺激物作用于中性粒细胞使其细胞内DNA与细胞质、颗粒内容物等一起被挤压、排出细胞外,以捕获和消除细胞外病原体,对机体早期抗感染免疫具有重要作用,但过度的中性粒细胞激活与各种情况下的机体炎症反应及自身免疫性疾病有关,包括类风湿关节炎(RA)、系统性红斑狼疮(SLE)和痛风[1-2]。尽管在体外和动物模型体内[3]均证实局部NETs形成在痛风发病中起关键作用,但NETs在痛风病人周围血中的表达水平及其与痛风疾病活动度的关系尚未得到深入研究。因此,本研究通过检测痛风急性期病人和健康人周围血血清中NETs的表达水平,来进一步研究痛风病人中性粒细胞激活的证据及中性粒细胞来源的生物标志物NETs在痛风病人疾病活动度方面的临床意义。
1 资料与方法
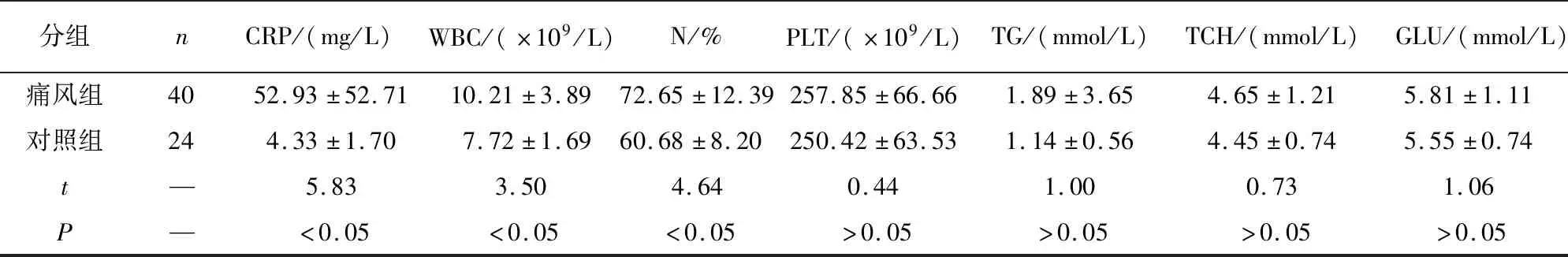
1.1 一般资料 痛风组:收集我院2019年10月至2021年4月风湿科病房及门诊痛风急性发作病人40例,均为男性,其中使用秋水仙碱组19例,未使用秋水仙碱组21例。纳入标准:根据2015年ACR-EULAR痛风分类诊断标准[4],总分≥8分诊断为痛风。排除标准:入组病人需除外其他风湿免疫性疾病、骨关节病、血栓相关疾病及近期感染性疾病病史。健康对照组:收集我院上述同期健康体检者24名,均为男性,无风湿病及家族史,无肿瘤及其他基础疾病史,近期无感染病史。2组间血尿酸、肌酐、红细胞沉降率(ESR)、C反应蛋白(CRP)、白细胞(WBC)、中粒细胞百分比(N%)差异有统计学意义(P<0.05),2组间年龄、24 h尿尿酸、尿pH等差异均无统计学意义(P>0.05)(见表1)。本研究通过安徽医科大学附属六安医院医学伦理委员会批准,所有受试者均签署知情同意书。
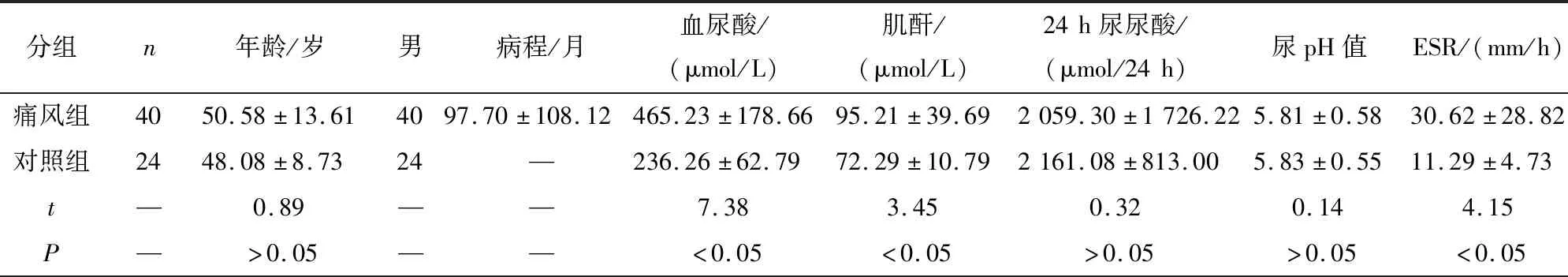
表1 入组研究对象的临床特征
分组nCRP/(mg/L) WBC/(×109/L)N/%PLT/(×109/L)TG/(mmol/L)TCH/(mmol/L) GLU/(mmol/L)痛风组4052.93±52.7110.21±3.8972.65±12.39257.85±66.661.89±3.654.65±1.215.81±1.11对照组244.33±1.707.72±1.6960.68±8.20250.42±63.531.14±0.564.45±0.745.55±0.74t—5.833.504.640.441.000.731.06P—<0.05<0.05<0.05>0.05>0.05>0.05>0.05
1.2 方法
1.2.1 血清NETs浓度的检测 使用人NETSELISA试剂盒(上海纪宁):(1)采集2组受试者静脉血5 mL于EDTA抗凝管中,离心后血浆放于-40 ℃冰箱保存待测,避免反复冻融;(2)确定测试所需样品所需的微孔条数,每个样品、标准和空白应一式两份;(3)添加样品:分别设置空白孔(不添加样品和ELISA试剂,其他步骤操作相同),将标准或样品的50 μL添加到抗体预涂微滴板的适当孔中,并轻轻混合,在37 ℃孵育45 min;(4)配置液:用蒸馏水稀释30倍的洗涤液备用;(5)洗涤:取出液体,用摆动干燥,在每个孔中加入洗涤缓冲液,静置30 s后取出,重复4次;(6)加入生物素化抗IgG:在所有孔中加入稀释的生物素化抗IgG 50 μL,在37 ℃孵育30 min;(7)洗涤:同(5)的操作;(8)添加链霉亲和素-HRP:在所有孔中加入链霉亲和素-HRP 50 μL,在37 ℃轻轻混合孵育15 min;(9)清洗:同(5)的操作;(10)染色:先加入显色液A 50 μL,然后在每口井中加入显色液B 50 μL,在37 ℃孵育15 min;(11)停止反应:在每口井中加入Solution 50 μL,停止反应(蓝色立即变为黄色);(12)测定:取空白和零,加入停止溶液后在450 nm处测量光学密度(OD),15 min内测量;(13)计算结果:平均每个标准、控制和样品的重复读数,并减去平均零标准光密度。通过绘制y轴上每个标准的平均吸光度与y轴上的浓度的关系,构建一条标准曲线,通过图上的点绘制一个最佳拟合曲线。这一程序将产生足够但不太精确的数据拟合。如果样品已被稀释,从标准曲线读取的浓度必须乘以稀释因子。
1.2.2 其他指标检测 均由我院检验科相关仪器测得,血尿酸、肌酐、CRP、三酰甘油(TG)、总胆固醇(TC)、血糖(GLU),由贝克曼AU5800生化仪测得;24 h尿尿酸,由VITR4600生化仪测得;尿pH值由优利特US2000尿常规自动分析仪测得;ESR由Caretium-xc-A30魏氏法测得;WBC、N%、血小板(PLT)由希森美康XN9000自动血常规分析仪测得。
1.3 统计学方法 采用t检验和Pearson相关分析。
2 结果
2.1 2组周围血血清中NETs水平的比较 痛风组NETs的浓度(2 119.62±1 843.36)pg/mL高于健康对照组(1 894.66±113.52)pg/mL,差异有统计学意义(t=3.64,P<0.01)。
2.2 痛风组周围血血清中NETs水平与临床指标相关性分析 痛风组血清NETs水平与ESR值呈正相关(P<0.05),与CRP值呈正相关(P<0.01),与病程、血尿酸、肌酐、24 h尿尿酸、尿pH、WBC、N%、PLT、TG、TCH、GLU均无相关性(P>0.05)(见表2)。
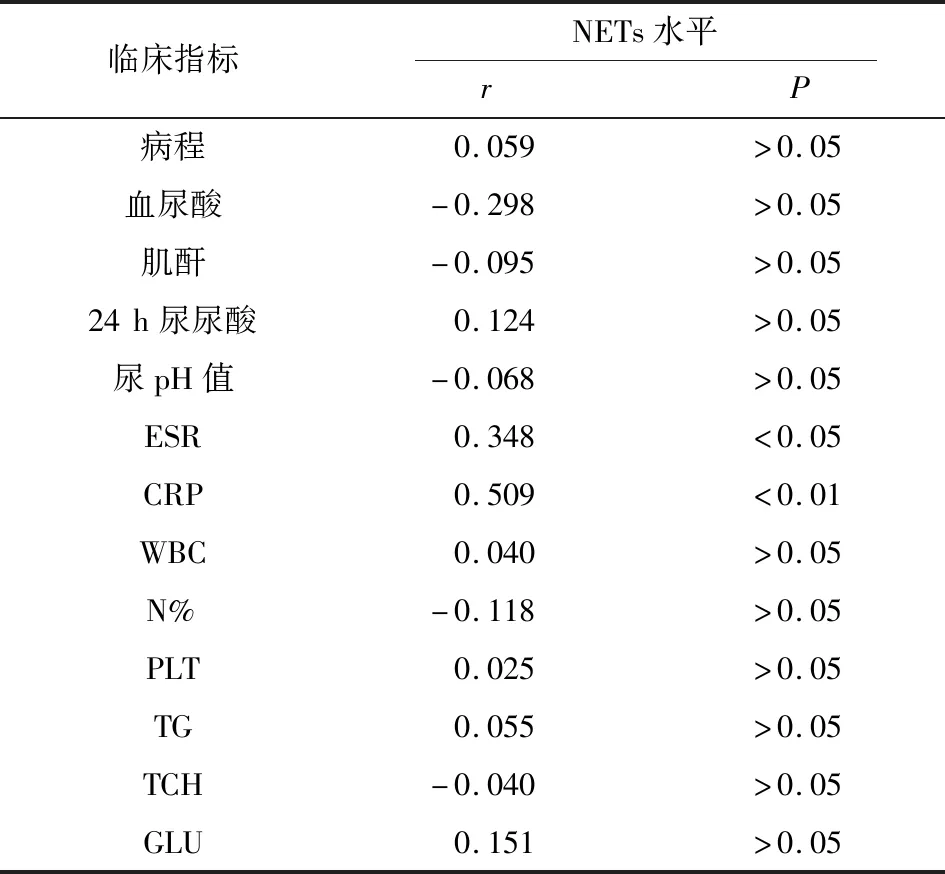
表2 痛风急性期病人周围血NETs水平与临床指标的相关性分析
2.3 痛风病人中未服用秋水仙碱组和服用秋水仙碱组周围血血清NETs水平的比较 未服用秋水仙碱组血清NETs浓度(2 138.24±173.60)pg/mL,高于服用秋水仙碱组(2 099.05±196.23)pg/mL,但差异无统计学意义(t=0.67,P>0.05)。
3 讨论
痛风病人周围血中NETs的形成过程是十分复杂的,且受多种机制调控。从痛风病人周围血中分离出的中性粒细胞能自发性地释放NETs,且痛风病人的血清能够诱导健康捐赠者NETs的形成[5]。既往研究仅在痛风石及尿酸盐微结晶中发现NETs[3],本研究在周围血中测得NETs,且痛风急性期病人周围血中NETs水平显著升高,与VEDDER等[6]对75例痛风急性期病人周围血NTEs水平检测的结果相一致。这一结果目前有两种可能的解释,一种是痛风病人周围血循环中存在的微小MSU晶体激活中性粒细胞对其吞噬,进而释放NTEs[3];另一种是痛风病人局部炎症诱发产生全身炎症反应环境,中性粒细胞在没有刺激物直接作用的炎症环境下被激活,进而产生NTEs。
既往研究[7-8]发现在幼年型皮肌炎及RA病人中,NETs水平与疾病活动度相关。近期满达夫等[9]的研究发现痛风急性期病人周围血中NETs水平与病情活动度、炎症状态(ESR、CRP)呈正相关性;同样,在本研究中发现痛风病人周围血NETs水平与临床中常用的非特异性炎症评价指标CRP、ESR呈正相关,可能提示在痛风病人中NETs水平与机体炎症状态或疾病活动度亦相关;但这一结果与PIETERSE等[3]的研究结果相反,可能是由于该研究中痛风急性期病人疾病严重程度及检测NETs水平的方法与我们的研究不同所致。同样,MOORE等研究[10]亦表明SLE病人周围血NETs水平与其疾病活动度无相关性。综上分析,我们目前所定义的NETs只是一个广义的致病DNA复合物,可能由于在不同疾病中诱发产生的机制不同,所以其构成成分不同(如某些NETs线粒体DNA含量高[11],而另一些NETs颗粒酶含量高[12]),进而出现上述不同的研究结果。这也提示进一步对痛风病人周围血NETs成分的分析及对各个成分与疾病活动度相关性的研究显得尤为必要。
秋水仙碱作为目前一种临床上广为应用的治疗急性期痛风药物,其作用机制仍不十分明确。SIL等[13]研究发现致炎因子IL-1β提高了MSU诱导多形核中性粒细胞释放NETs的能力。而SAYARLIOGLU等[14]发现应用秋水仙碱后病人血中TGF-β1含量增加,并且可能导致了促炎介质IL-1β浓度的下降。DALBETH等[15]发现秋水仙碱可通过阻断MUS诱导的NLRP3炎性体活化,进而抑制IL-1β的释放,亦可通过阻止多形核中性粒细胞表面L选择素与内皮细胞表面E选择素的表达,来抑制多形核中性粒细胞在炎症部位的大量聚集,进而抑制痛风急性期NETs的形成。本研究显示秋水仙碱组周围血NETs水平低于非秋水仙碱组,验证了上述研究结果,但2组NETs水平差异无统计学意义,可能与本研究的样本量较小,亦可能与秋水仙碱的治疗时间长短有关,需扩大样本量进行更为严谨的多中心病例对照研究加以验证。
目前关于NETs在痛风发生过程中作用的研究较少,更是缺乏对痛风不同阶段NETs表达情况及痛风病人周围血NETs成分的研究,关于这些方面更为深入的研究将有助于揭示NETs在痛风发病中所起的作用,从而为评估痛风病情、预后及探索其治疗新途径提供理论依据。

