中子背散射谱仪在蛋白质动力学研究中的应用
顾旭东 郭宏宇 储祥蔷
(1.中国工程物理研究院研究生院 100193;2.中国科学院高能物理研究所 100049;3.散裂中子源科学中心 523803)
蛋白质是美妙生命世界的基础,承担了生物体内绝大多数的工作,其表现出的多样性与专一性彰显了大自然的深奥与智慧。然而,要真正理解生命的奥秘,就要揭开蛋白质这一复杂生物大分子的神秘面纱。蛋白质研究领域虽然存在重大的机遇,但也面临巨大的挑战①。蛋白质是由约20种氨基酸组成的肽链经过折叠、组装构成的具有多级结构的生物大分子。空间结构对蛋白质的功能具有决定性作用,但是仅依靠蛋白质的静态结构并不能完全理解蛋白质的工作机理。这是因为包括整体柔性、结构域运动、局部受限运动在内的蛋白质的动力学行为也会对蛋白质的功能起到重大的影响。因此,从静态结构-动力学行为-生物学功能相互关联的角度去研究蛋白质,可以加深对蛋白质分子机理的认识,并已成为研究者之间的共识②③。在蛋白质动力学的研究中,中子散射凭借许多独特的优势占据了不可替代的地位。
中子在蛋白质研究中最大的优势在于中子对氢元素的高度敏感性。氢原子是蛋白质中数目最多的原子,参与形成的氢键深刻地影响着蛋白质的空间结构和运动方式。然而氢原子只有一个电子,很难被X 光、电子等实验手段检测到。不同的是,中子直接被原子核散射,对氢原子有非常好的响应。氢原子对中子的非相干散射截面比生物体系中常见的其他原子高一个数量级④。非相干散射信号本质上反映了原子的自相关性,因而非常适合动力学的研究。此外,中子具有分辨同位素的能力且对氢和氘的散射截面差异巨大。用氘原子取代蛋白质或溶剂中的氢原子给实验设计提供了一个新的自由度,并且蛋白质的部分氘代技术已使得研究特定位点的运动成为可能。中子因其高穿透力、电中性、低能量的特点,相较于X光和冷冻电镜,更易在不破坏蛋白质结构的前提下完成对其结构及动力学的原位探测。
蛋白质在不同时间空间尺度上的变化过程可用不同的中子散射技术进行研究,如图1 所示。发生在纳秒到微秒时间尺度和原子到分子空间尺度的结构域动力学过程,可以通过中子自旋回波技术研究;发生在皮秒到纳秒时间尺度上的分子内部的弛豫运动,可以用准弹性中子散射技术研究;发生在飞秒到皮秒时间尺度的原子振动带来的声子激发,可以用非弹性中子散射技术观测。这些不同空间尺度上的动态过程共同实施促成了蛋白质的功能,可根据实验目标选择合适的实验技术来研究不同时间尺度的动态过程。

图1 用以研究蛋白质不同时间空间尺度结构和运动信息的中子散射技术⑤
准弹性中子散射技术广泛使用背散射谱仪研究蛋白质体系的动力学问题。中子背散射谱仪(NBS)具有高能量分辨率以及与蛋白质局部弛豫运动相当的观测时间窗口(ps-ns)。蛋白质在这一时间尺度上的弛豫运动被认为与分子活性高度相关⑥。国际上已有的中子背散射谱仪包括:澳大利亚核科学和技术组织(ANSTO)的EMU(图2),法国劳厄-朗之万研究所(ILL)的IN13 和IN16B,德国尤利希中子科学中心(JCNS)的SPHERES,美国国家标准局中子研究中心(NCNR)的高通量背散射谱仪(HFBS),美国橡树岭国家实验室(ORNL)的BASIS,英国散裂中子源(ISIS)的IRIS,日本加速器研究中心(J-PARC)的DNA 等。背散射谱仪的数量在全球范围内仍显得稀少,这使得其实验机时成为一种宝贵的研究资源。幸运的是位于东莞的中国散裂中子源(CSNS)正在筹建中国第一台中子背散射谱仪,这将大幅推动国内中子科学和相关领域的发展。

图2 EMU谱仪现场照片⑦
一、背散射谱仪的原理
中子准弹性散射通过记录中子被样品散射前后的波矢变化(图3)和能量转移来获得样品的空间和运动信息。一般通过不同位置的3He探测器记录散射前后中子出射方向相对入射方向的变化来获得波矢转移Q,而能量转移通过记录入射和出射的中子波长来获得。
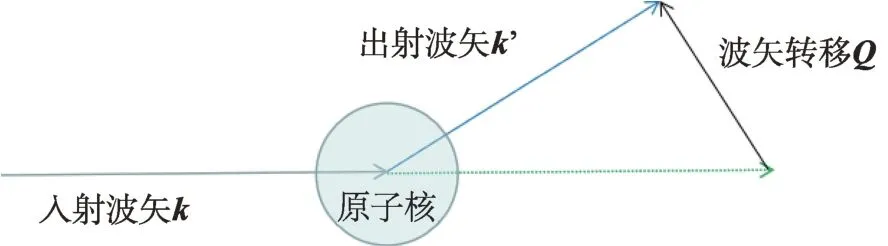
图3 波矢转移示意图
在脉冲中子源上大多使用飞行时间技术确定中子波长,在反应堆源上大多使用布拉格衍射(如下式)确定中子波长

背散射谱仪高分辨率的实现利用了布拉格衍射束的波长扩散Δλ随散射角2θ增大至180°而减小的事实,正如下式的布拉格定律的误差传递公式所显示的那样⑧。
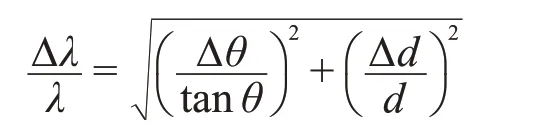
公式中d表示晶面间距。在背散射情况下,θ接近90°,散射角带来的误差接近于0,因而能量分辨率最高。包括HFBS,Emu 在内的大多数背散射谱仪使用了曲面Si(111)晶体作为入射中子的单色器和出射中子的能量分析器,这样可以实现小于1μeV的能量分辨率⑨。如果使用平面Si(111)晶体,可进一步提高分辨率,但会牺牲通量并且导致分辨率谱线偏离高斯分布。在ILL的IN16B上也提供了GaAs作为进一步提高分辨率的选项⑩。
图4以NCNR的HFBS谱仪为例展示了背散射谱仪的原理。经过多普勒单色器的能量为E=E0+ΔE的入射中子被样品散射后,垂直入射到分布于球形空间的单晶分析阵列,根据布拉格定律只有能量为的中子被分析晶体反射,其余能量的中子穿过分析器被后方的吸收材料吸收。被分析器反射后的中子被样品附近的探测器收集到。由此可以测得中子能量转移为ΔE,散射矢量Q可以由入射波长和散射角度算出。由背散射谱仪的工作原理可知,背散射谱仪在一个时间点只能探测一个能量转移的信号。为了得到能量转移谱,需要随时间改变入射中子的能量,在反应堆源上这项工作由多普勒单色器完成。多普勒单色器使用与分析器相同的单晶,在静止条件下,分析器反射的中子能量为E0,此时得到的是弹性散射信号。通过改变晶体温度以改变晶面间距d或是将多普勒单色器沿束流方向做周期性机械运动,可以调制反射中子的能量为E=E0+ΔE。背散射谱仪探测能量覆盖的范围±ΔEmax取决于多普勒单色器可以提供的移动速度或温度范围⑦。

图4 背散射谱仪HFBS原理示意图⑪
在散裂中子源上,由于束流本身带有能量展宽的脉冲信号,可用长导管分离不同速度的中子并通过飞行时间计算出能量。由于调制入射中子能量方式的差异,通常飞行时间中子背散射谱仪(TOF-NBS)会有更大的测量能量范围⑫。图5 展示了英国散裂中子源上的TOF-NBS谱仪IRIS的布局示意图。

图5 英国散裂中子源上的TOF-NBS谱仪IRIS的布局示意图⑬
二、数据分析原理
(1)能域分析:
中子背散射谱仪得到的信号是中子计数关于能量转移ΔE和散射矢量Q的函数,通过空样品皿矫正、探测器效率矫正、对Q和ΔE按需求重新分组(rebin)、归一化等步骤,可以获得动态结构因子S(Q,ω),其中ω与能量转移ΔE的关系为ΔE=ħω。动态结构因子包含了样品的空间约束和动力学在内的信息⑭。背散射谱仪的能量分辨率在μeV 量级,能量转移的范围可从μeV到meV,对应的时间尺度为皮秒到纳秒,这个尺度主要观测的是蛋白质的局部弛豫运动,例如蛋白质主链和侧链的扩散和旋转,这些运动信息是蛋白质的固有特征,与蛋白质功能的实现息息相关。
为了深入分析动态结构因子中的信息,通常的处理方法是将S(Q,ω)拆分成两部分的贡献:

其中A(Q)被称为弹性非相干结构因子(EISF),提供了实验观测的时间窗口内原子所受空间约束的信息。这些原子不与中子发生能量交换或其运动不在时间观测窗口内,因此反映在动态结构因子中的贡献是一个代表弹性散射的δ函数。由于背散射能谱观测到的主要是氢的非相干信号,因此描述EISF 的模型通常考虑了一个原子在特定约束条件下的运动,比如在无法穿透的球壳中的自由扩散,抛物线势,在圆上的特定位点的跳跃等。L(Γ,ω)包含了时间窗口内所有运动原子的信息,通常可以用一个或多个洛伦兹函数来描述。洛伦兹函数的半高半宽(HWHM)Γ(Q)称为有效弛豫常数。在原子做最简单的菲克扩散的情况下,有Γ∝Q2。当蛋白质中的原子处在一个复杂的能量景观下,Γ的形式也会发生显著的变化,为此有许多模型被提出,包括跳跃扩散模型⑮,在高斯势阱中的扩散模型⑯,拉伸指数衰减模型KWW函数⑰等。
(2)时域分析:
将动态结构因子S(Q,ω)作ω →t的傅里叶变换到时域(图6),可以获得中间散射函数(Intermediate scattering function,ISF)F(Q,t),ISF 是一种密度-密度关联函数,它的物理含义表示了氢原子在t时刻的位置与它自身在0时刻的位置的关联性。这一函数为研究者揭示蛋白质分子弛豫动力学提供了重要工具。值得一提的是,中间散射函数可以通过分子动力学模拟直接获得,这使得背散射谱仪的实验数据可以方便地与模拟结果联系起来。

图6 飞行时间中子背散射(TOF-NBS)谱仪BASIS上测得的能域数据(a)动态结构因子S(Q,ω)可以通过傅里叶变换转换成时域中的中间散射函数ISF(b)⑲
在时域分析中也有一系列模型被提出。由于蛋白质和玻璃形成液体在许多方面有着共同的动力学行为,因此可以借用描述液体的模态耦合理论⑱(Mode-Coupling Theory,MCT)来描述蛋白质的动力学行为,这种方法已经在多项研究中被证明有效⑲-㉒。按照MCT理论,ISF可以用以下渐进式拟合:

其中τβ和τα分别是β和α弛豫的特征时间,分别对应了蛋白质动态过程中的局域运动和结构域运动,中子背散射谱仪的时间观测尺度(ps-ns)通常比α弛豫的时间尺度(μs-ms)短得多,因此α弛豫项近似为1。从MCT 模型中得到的弛豫时间是描述蛋白质动力学的重要参数,可以帮助我们理解蛋白质的作用机理。
(3)均方位移(MSD):
在不依赖模型的分析方法中,利用背散射谱仪的弹性扫描模式对全体原子均方位移(MSD)进行测量也可以提供关于内部结构所受空间约束的信息。均方位移记录了蛋白质中原子在一段时间的运动后偏离初始位置的程度,由于中子准弹性散射观测蛋白质主要得到的是氢的非相干信号,因此实验所得的MSD代表了所有氢原子运动距离平方的平均。MSD 可以从德拜沃伦因子(Debye-Waller factor)计算得出,德拜沃伦因子的表达式为

实验中德拜沃伦因子可以通过计算弹性散射强度Iel(Q,T,ω=0)和它在低温极限下的值Iel(Q,T=0,ω=0)的比获得。
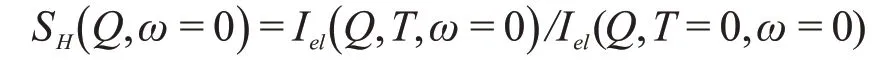
作ln(SH(Q,ω=0))vs.Q2图,对小Q部分线性拟合所得的斜率即MSD,只取小Q部分拟合是因为德拜沃伦因子的推导中含有高斯近似,高斯近似只在小Q范围内成立㉓。
MSD在生物学中又称为B因子,可以表征蛋白质的不同部分的相对振动㉔。尽管MSD 得到的信息是平均的,无法得到底层的动力学信息,但可以借此表征蛋白质整体的“柔软程度”㉕。MSD提供了一种模型无关的监测变化的手段,允许我们实时,快速地测量升温和降温过程中的动力学信息。这一点弥补了准弹性散射达到统计质量的数据所需的时间过长的缺陷,为我们提供了一种有力的研究手段。
三、应用举例
随着中子背散射谱仪在蛋白质研究中的强大功能被越来越多的研究者认识到,近年来依托背散射谱仪的研究工作在该领域产生了一大批有价值的研究成果。以下对几个具有前景和参考价值的工作做些简要介绍。
储祥蔷研究组研究了一种来自深海嗜热菌的寡聚蛋白㉑。在NCNR的高通量背散射谱仪(HFBS)和飞行时间谱仪(DCS)上,他们利用准弹性中子散射技术研究了目标蛋白在100 ps~2 ns时间尺度上的弛豫动力学。结果揭示:该嗜热蛋白相比于作为对照物的嗜温蛋白溶菌酶在高压条件下具有更好的结构灵活性和快得多的弛豫运动。这一结果归因于嗜热蛋白的高度对称和封闭的寡聚结构,导致高压条件下嗜热蛋白的能量景观的扭曲效应与嗜温蛋白显著不同(图7)。这项工作为蛋白质结构的稳定性提供了实验依据,相关研究发表在2015年的PNAS上。

图7 嗜热蛋白(IPPase)和嗜温蛋白(HEWL)变性相图及能量景观示意图㉑
法国的Giorgio Schiro 研究小组利用中子准弹性散射研究了结合水的平移扩散与本质无序蛋白功能实现的关联性㉖。结合水和蛋白质运动的关联性已经多次被发现,理解表面结合水的生物效应对深入刻画蛋白质动力学过程具有重大意义④。这项工作利用中子散射实验的优势,研究蛋白质和结合水联系中的重要因素氢键,实验是在德国JSNC 的背散射谱仪SPHERES上完成的。研究发现结合水的平动成分在240K附近的蛋白质动力学转变温度处明显增加,提出了蛋白质表面结合水的扩散运动可以促进蛋白质实现功能所需的大振幅运动的观点。
2019 年日本的Fujiwara 等在日本加速器研究中心(J-PARC)的材料与生命科学实验设施(MLF)的飞行时间背散射谱仪DNA 上㉗结合准弹性中子散射和小角X 光散射(SAXS)研究了一种可以合成淀粉状纤维的无定型蛋白αSyn。αSyn 合成的淀粉状纤维被认为与帕金森病和其他细胞核病有关,因此对αSyn 机制的研究对于阐明这些疾病的发病机制有重大的意义。实验结果表明,αSyn纤维的形成不仅需要局域运动,而且还需要N、C 端的链运动,使中心NAC结构域暴露。这一研究给开发治疗帕金森病的新型药物带来了灵感,不同于此前以NAC区域为靶点的思路,可以选择蛋白质N端和C端作为药物靶点,通过抑制链端运动来阻止淀粉状纤维的合成。
四、总结与展望
近年来,中子背散射谱仪的设计、配套软件以及分析理论都得到进一步的发展,使得准弹性中子散射实验技术可以惠及更多科研工作者。中子背散射对氢原子敏感、其观测尺度与蛋白质局部弛豫相匹配、又具有无损原位观测的能力,这些特点使得中子背散射技术在蛋白质研究上具有其他实验手段不具备的突出优势。中国的第一台中子背散射谱仪作为散裂中子源二期工程的一部分已列入国家十四五规划,有望在2025 年建成。可以预见CSNS的中子背散射谱仪将驱动我国相关领域的研究进入快车道。利用中子背散射谱仪进行蛋白质动力学相关的研究,预期在以下几个方向将取得重要进展:(1)中子准弹性散射技术和氘代技术结合研究蛋白质特定位点的动力学过程,例如药物分子的定向投放酶㉘,与底物的特异性结合等;(2)蛋白质表面结合水动态过程与功能的关联性研究;(3)中子背散射谱仪与自旋回波、飞行时间谱仪结合研究蛋白质全时间尺度的动态过程,有助于阐述蛋白质的工作机理。

