活性氧及抗病信号分子介导的向日葵抗黄萎病机制初探
张 键,曹 雄,杨剑锋,贾 硕,刘 麟,阿德拉·曼德拉-俄罗摩,冯伊彤,赵 君
(1.内蒙古农业大学 园艺与植物保护学院,内蒙古 呼和浩特 010018;2.巴彦淖尔市农牧业信息中心,内蒙古 临河 015000)
向日葵是继大豆、油菜和花生之后的世界第四大油料作物,也是仅次于玉米的第二大杂交作物[1]。我国向日葵主要种植在东北三省、华北和西北地区,其种植面积仅次于大豆和油菜,年种植面积约为86.67万hm2。内蒙古是我国向日葵的主产区,其种植面积和产量分别占全国的50%和52%,位居榜首[2]。然而,由于向日葵种植效益较好,向日葵播种面积不断扩大,从而带来了轮作倒茬的困难。向日葵的连年种植导致了向日葵病害发生严重。目前,向日葵黄萎病已经成为我国向日葵种植区继菌核病之后的又一主要病害,成为制约向日葵产业发展的主要因素[3]。
引起向日葵黄萎病的病原菌是大丽轮枝菌(Verticilliumdahliae),其属于半知菌亚门轮枝孢属。该病原菌寄主范围极广,能够侵染包括向日葵在内的600余种植物[4]。向日葵被大丽轮枝孢菌侵染后最初症状表现为底层叶片中心或边缘组织出现褪绿斑,随后这些褪绿斑逐渐扩大并连接在一起,最终导致叶肉组织的坏死[5]。同时,病原菌能够在维管束中借助植物的蒸腾作用向上扩展和蔓延,从而导致向日葵的上层叶片褪绿变色,最终导致植物整株枯死。生长后期发病严重植株的茎基部会出现纵向的黑色条斑,切开病茎后可见维管束组织变褐的现象。
在自然界中,植物总是受到各种病原物的侵袭。为了生存,植物在长期进化过程中,逐渐建立了一系列复杂的防御机制来抵御病原菌的入侵[6]。植物的防御机制通常在病原物侵染后在不同水平上发挥作用,如组织学机制、生理生化机制以及分子机制,其中组织学机制主要体现在结构抗性方面,而生理生化机制主要体现在植保素和抗菌物质的产生和积累、植物防御酶活性提高等方面,分子机制则主要表现在抗性相关基因转录水平提高以及抗病信号传导等方面。
活性氧(ROS)的积累是植物受到生物和非生物的胁迫时寄主细胞内的快速反应,然而过多的活性氧也会对植物细胞造成一定的伤害[7]。超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)共同组成植物的ROS清除系统,植物通过这些ROS清除系统可以使细胞内活性氧的浓度处于一个相对平衡的状态[8],从而降低ROS对细胞的伤害,增强植物对病害的抵抗能力。此外,在植物抵御病原物入侵过程中,水杨酸(SA)、茉莉酸(JA)以及乙烯(ET)等一些信号分子发挥着非常重要的调控作用。SA一般介导活体营养型病原菌诱发植物抗性,而JA和ET介导死体营养型病原菌诱发植物抗性,上述信号分子往往通过拮抗方式调控寄主对活体和死体营养型病原菌的抗性水平[9]。
内蒙古农业大学分子植物病理实验室前期通过抗性鉴定筛选出高抗黄萎病品种SC89和感黄萎病品种LD5009,本研究以这2个品种为材料,测定其接种黄萎病菌粗毒素后H2O2含量以及SOD、CAT、PAL、POD活性的变化,同时还在分子水平上检测了JA路径关键基因Pr5、SA路径上游PAL合成关键基因Pal和ROS信号路径的相关基因Sco、Sod及Cat等表达水平的变化,旨在为初步揭示向日葵黄萎病抗性机制提供参考依据。
1 材料和方法
1.1 试验材料
供试向日葵品种为抗黄萎病品种SC89和感黄萎病品种LD5009。
供试菌株为黄萎病菌株V89采集自内蒙古五原县,经单孢分离和分子鉴定确定是大丽轮枝菌。
供试培养基为马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g、葡萄糖20 g、琼脂粉15 g、水1 000 mL;查氏培养基(Cazpek):NaNO32 g、K2HPO41 g、KCl 0.5 g、MgSO4·7H2O 0.5 g、FeSO40.01 g、蔗糖30 g、水1 000 mL。
试剂及其配方为100 μmol/L H2O2:取30%分析纯H2O257 μL,溶于100 mL丙酮,再稀释100倍;5%(m/V)硫酸钛:5 g硫酸钛,溶于100 mL 2 mol/L硫酸。
1.2 试验方法
1.2.1 接种处理 参照任杰等[10]有关向日葵黄萎病的接种方法,利用20 mL 黄萎病菌粗毒素提取液(浓度为200 μg/mL)对向日葵幼苗进行处理。将处理后的向日葵苗置于25 ℃条件下光照培养箱中培养,分别于接种后0,6,12,24,36,48,72 h进行取样(取样部位为第2,3片真叶),按照每份样品0.1 g进行称量,液氮速冻后置于-80 ℃冰箱保存备用。每个品种处理10株,共设置3次重复,并设清水处理作为对照。
1.2.2 H2O2和酶液的提取与测定 H2O2提取与定量参照卜浩宇[11]的方法进行。SOD、CAT、PAL液提取及测定参照李合生[12]的方法进行,POD液提取及测定参照郝再彬[13]的愈创木酚法。每个试验3次重复。
1.2.3 植物总RNA的提取 按照BioFlux公司的RNA提取试剂盒(RNAiso Reagent)的说明书提取毒素处理0,6,12,24,36,48,72 h后的向日葵叶片RNA。并采用博日科技公司BioRT cNDA第一链合成试剂盒将提取的RNA合成cDNA。
1.2.4 抗性相关基因转录水平的测定 采用RT-PCR技术对Pal、Pr5、Sod、Sco和Cat等6个抗性相关基因的转录水平进行测定,基因的引物信息见表1。RT-PCR反应体系为25 μL,包括引物F/R各1.0 μL、10×TaqBuffer 2.5 μL、10 mmol/L到dNTP 0.5 μL、TaqDNA Polymerase 0.5 μL、cDNA 1.0 μL、ddH2O 18.5 μL。RT-PCR反应条件为:94 ℃预变性3 min;94 ℃变性1 min,退火温度(参照表1引物各自退火温度)1 min,72 ℃延伸2 min,32个循环;最后72 ℃ 延伸10 min。PCR产物用1%的琼脂糖凝胶电泳检测,电压90 V,持续30 min。利用Image Pro软件对结果进行量化比较,计算各基因的相对表达量。

表1 PCR所用引物Tab.1 Sequences of the primers used in PCR
1.3 数据统计与分析
试验数据采用SPSS 18.0软件进行统计分析,应用Duncan氏新复极差法进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 抗、感向日葵品种接种后H2O2含量变化
由图1可知,抗病品种SC89在接种毒素后12,36 h出现2个峰值,分别为0.55,0.60 μmol/g,变化趋势总体为先增加后降低,感病品种LD5009在接种种毒素后12 h出现峰值,达到0.17 μmol/g,随后降低。虽然,在感病品种LD5009中H2O2的含量在接种后也出现了过量表达的峰值,但是在各个接种时间点H2O2的含量始终低于抗病品种SC89。由此可见,利用大丽轮枝菌的毒素进行接种处理能够诱导向日葵叶片中H2O2的积累,且抗病品种中积累的速度和积累的量均快于和高于感病品种。

不同小写字母表示在P<0.05水平差异显著。Different lowercase letters indicate significant difference at P<0.05 level .
2.2 抗、感向日葵品种接种后植物防御酶活性的变化
由表2可知,接种前(0 h),抗、感品种SOD活性没有显著差异。接种后,抗、感品种向日葵叶片中SOD活性均呈现先升高后逐渐降低的趋势,但是抗病品种中出现2个峰值,而感病品种仅出现一个峰值,且峰值出现时间滞后于抗病品种。相比感病品种,抗病品种在接种后SOD活性增加更显著,如接种12 h后,抗病品种SC89的SOD活性达到高峰56.96 U/(g·min),随后降低到接种24 h的47.91 U/(g·min),接着在接种48 h后又达到另一个高峰60.93 U/(g·min),相比接种前(0 h)SOD活性28.39 U/(g·min)升高了32.13 U/(g·min),增加113.17%;而感病品种LD5009在接种36 h后才达到高峰49.13 U/(g·min),随后开始下降,相比接种前(0 h) 28.80 U/(g·min),接种36 h后SOD活性增加了20.33 U/(g·min),增加比例为70.59%。
由表2可知,在接种前(0 h),SC89中的CAT活性略高于LD5009;但在接种后其他时间点,SC89叶片的CAT活性一直高于LD5009。接种后,SC89的CAT活性均呈现上升趋势,并在接种24 h出现一个峰值,但是在随后的时间点,CAT活性略有下降后一直维持一个较高水平;而LD5009在接种24 h和48 h后酶活性达到2个小的峰值,随后降低到接种起始点水平。SC89在接种24 h后,CAT活性达到峰值0.11 U/(g·min),相比接种起始点,酶活性增加83.33%;而LD5009同样在接种24 h后,达到最高峰0.07 U/(g·min),酶活性增加75%。
由表2可知,接种前(0 h),抗病品种叶片的 POD 活性高于感病品种。接种后,抗病品种的 POD 活性呈现上升—下降—略上升—下降—略上升的趋势,并在接种12 h出现一个高峰值,随后在36,72 h又出现2个小峰值;而感病品种在12 h达到一个峰值,随后在36 h出现一个小峰值。相比不同时间点酶活性水平,SC89接种后水平一直显著高于LD5009(P<0.05)。接种12 h后SC89 POD活性达到峰值3.46 U/(g·min),相比接种前(0 h)升高1.86 U/(g·min),酶活性增加116.25%;而接种后相同时间点,LD5009 中POD活性为1.78 U/(g·min),相比接种前升高0.53 U/(g·min),酶活性增加42.4%;在接种24 h后,SC89中 POD活性略有下降并保持较高活性;LD5009的 POD 活性与SC89的变化趋势一致,但活性较低。
由表2可知,接种前(0 h),抗感病品种中PAL活性基本一致。接种后,抗、感品种PAL的活性均呈现先升后降的趋势,且抗病品种升高的幅度略高于感病品种;在接种24 h后,抗、感品种中的PAL活性同时达到最高峰17.87,13.80 U/(g·min),相比接种前,SC89中PAL活性升高 10.14 U/(g·min),增加131.18%,而LD5009中PAL活性仅升高了6.36 U/(g·min),增加85.48%。
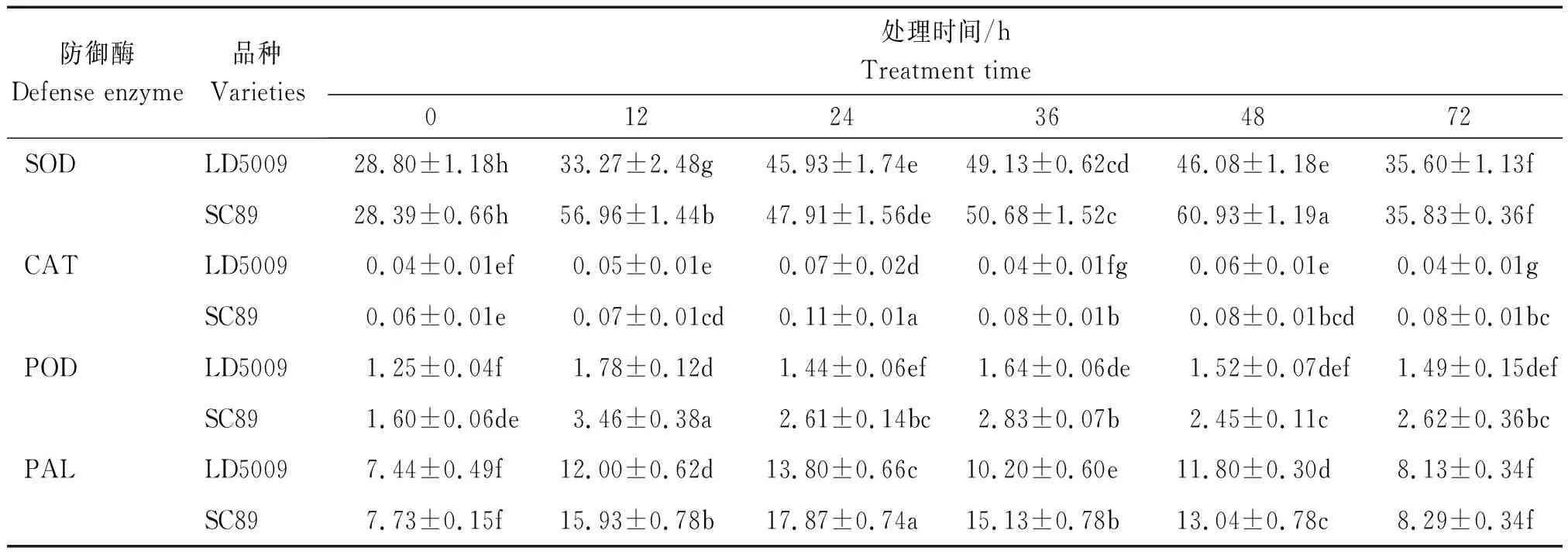
表2 抗、感向日葵品种接种毒素后植物防御酶活性变化Tab.2 Changes of defense enzyme activity in sunflower varieties with V.dahliae toxin U/(g·min)
2.3 抗性相关基因转录水平变化
由图2可知,抗病品种中JA路径中关键基因Pr5本底水平高于感病品种;并且接种后,抗病品种中Pr5基因诱导表达迅速,并在接种后36 h达到最高值,随后在接种后72 h降低至本底水平(图2-A)。而感病品种接种后虽然Pr5也能够被诱导,但诱导的程度明显低于抗病品种。Pal基因作为SA合成路径中的关键基因,在接种处理后能迅速被上调,但是在抗病品种中诱导的水平明显高于感病品种(图2-B)。Sod、Sco和Cat基因是H2O2代谢途径中的关键基因,接种后,尽管抗病品种SC89中Sod的本底水平显著高于感病品种LD5009(P<0.05),但是接种后,抗病品种Sod基因转录水平在接种后48 h出现一个明显的峰值,而感病品种在同一时间点却没有升高的趋势(图2-C)。Sco基因接种后在抗、感品种均可以被诱导,但是抗病品种诱导的水平略高于感病品种,且高水平表达的时间也比感病品种要长(图2-D)。Cat基因编码过氧化氢酶(CAT),能够将H2O2降解成为H2O及O2。接种处理后,抗、感品种中Cat基因的表达均被诱导,且在接种36 h后达到最高点,抗性品种中该基因诱导的水平显著高于感病品种(图2-E)。上述结果预示,H2O2、JA和SA信号路径参与向日葵对黄萎病抗性的建立过程。

A.Pr5基因相对表达量;B.Pal基因相对表达量;C.Sod基因相对表达量;D.Sco基因相对表达量;E.Cat基因相对表达量。A.Relative expression of Pr5 gene;B.Relative expression of Pal gene;C.Relative expression of Sod gene;D.Relative expression of Sco gene;E.Relative expression of Cat gene.
3 结论与讨论
植物的防卫反应是复杂的细胞生理活动的结果,其生理反应是通过一系列的酶催化过程来实现的。自Fridovich[14]提出生物超氧离子自由基学说以来,细胞防御酶系统与植物抗病性的关系引起了人们的普遍关注。宋培玲等[15]将油菜黑胫病菌接种至不同抗性水平的油菜中发现,抗感品种中POD、PPO、CAT、PAL和SOD等5种防御酶活性显著升高,且抗病品种中防御酶活性远远高于感病品种。汪红等[16]研究发现,不同抗性品种的棉花在接种黄萎病菌后,POD、PPO、PAL等防御酶活性被诱导升高,且抗病品种反应速度和强度都要高于感病品种。本实验室前期通过对向日葵不同品种接种黄萎病菌毒素,发现在接种72 h感病品种已经呈现非常明显的发病症状。因此,推测防御酶系的变化应该在出现症状之前发生。本研究中,抗、感向日葵黄萎病品种中的4种防御酶活性在本底水平(0 h)并无太大差异,但在接种之后其活性却表现出很大差异,说明病原菌毒素处理后会诱导植物体内防御酶活性的升高。本试验中,抗病品种SC89在接种12 h后,SOD活性达到第一个高峰,同时POD活性也升至最高,且抗病品种中这2种酶活性均明显高于感病品种。SOD、POD通过酶促反应能将植物体内超氧阴离子等氧自由基转变为H2O2,H2O2能够诱发植物细胞的程序性死亡。CAT是植物体内重要的活性氧清除酶类,能够维持体内的活性氧代谢平衡,保护膜结构,从而使植物能在一定程度上忍耐、减缓或抵抗逆境胁迫[17]。本研究中,接种病原菌毒素之后,抗、感向日葵品种中的CAT活性均呈先上升后逐步降低的趋势。抗病品种在接种24 h后,CAT活性达到高峰,在时间点上略晚于SOD及POD活性变化速度,这可能是由于超氧阴离子等氧自由基等首先需要通过SOD、POD等酶转化成H2O2,之后才能够通过CAT等活性氧清除酶类将H2O2降解成为H2O及O2的原因。
PAL是催化苯丙烷类代谢第一步反应的酶,也是联系初级代谢和次级代谢的限速酶和关键酶[18],苯丙烷类代谢的中间产物酚类物质和终产物黄酮、异类黄酮、木质素等物质参与植物的抗病原菌侵入过程,从而防御病原生物的侵染[19-20]。本研究中,抗、感向日葵品种接种后,PAL的活性均呈现先升高后降低的趋势,并且抗病品种PAL的活性明显高于感病品种。这一结果与马铃薯感染晚疫病、小麦感染白粉病和秆锈病后,PAL活性变化结果相一致[21-22]。
在植物的抗病反应建立过程中,植物内源信号分子如SA、JA以及ET等信号分子发挥着非常重要的信号转导作用。JA一方面能够通过诱导植物次生代谢物质的积累提高植物的抗性,另一方面JA还能激活许多抗逆基因如PDF1.2和Thi2.1[23-24]。本试验中,检测了一些抗黄萎病相关的基因的表达,特别是接种前后SA和JA信号路径中关键基因转录水平的变化。如JA路径的关键基因Pr5,在毒素处理后,抗、感品种均有诱导表达,且在抗病品种中诱导表达的水平显著高于感病品种,表明JA路径参与了向日葵抗性建立过程。SA作为植物产生局部抗病反应与系统获得抗性反应(Systemic acquired resistance,SAR)的重要信号分子在植物抗性建立过程中发挥着重要的作用[25]。本研究中,Pal作为SA合成路径中的关键元件,在接种后抗感品种中该基因均能被诱导上调表达,且抗病品种中Pal基因的上调更为显著,表明SA的合成路径参与了向日葵抗性建立。
H2O2作为信号分子参与植物体内各种代谢过程,同时也是寄主植物受到病原物侵染后植物抗性建立的显著标志。研究表明,在病原菌侵染早期,寄主植物的侵染点部位会产生大量的活性氧即“氧爆发”,形成大量的氧自由基和H2O2。本研究通过检测接种前后抗、感品种中H2O2含量以及H2O2形成有关的基因如Sod、Sco以及Cat转录水平的变化,发现抗病品种中H2O2形成能够显著被病原菌所诱导,且诱导的水平明显高于感病品种。这一结果表明,在向日葵与黄萎病菌互作的过程中,H2O2的积累和向日葵抗性建立密切相关。同时,抗病品种中ROS清除酶如超氧化物歧化酶(SOD)和过氧化物酶(POD)等酶活性的变化与H2O2的积累具有高度一致性。因此认为,在向日葵抗性建立过程中活性氧作为一个非常重要的信号分子发挥着重要的作用。
本研究结果表明,POD、SOD、CAT及PAL等4种防御酶活性变化与向日葵的品种抗性有关,且接种黄萎病菌毒素后,SA、JA以及H2O2等信号分子在向日葵抗性建立过程中均发挥着重要的作用,特别是SA和JA信号路径在向日葵抗性建立过程中呈现协同作用。然而,SA和JA是如何协同作用增强向日葵抗性,SA 和JA信号路径和H2O2信号分子是如何应答等问题还需在未来的研究中进行进一步探究。

