术前血浆纤维蛋白原与非肌层浸润性膀胱癌预后的相关因素分析
束坤鹏 丁德刚 徐豪 石红林 郝建伟
河南省人民医院(郑州大学人民医院,河南大学人民医院)泌尿外科 郑州 450003
膀胱癌是男性泌尿生殖系常见的恶性肿瘤之一,居全身恶性肿瘤的第13位[1]。初诊患者约有70%为非肌层浸润性膀胱癌(non-muscular invasive bladder cancer,NMIBC)[2]。经尿道膀胱肿瘤电切术 (transurethral resection of bladder tumor,TURBT)是NMIBC的主要治疗手段,但术后仍可出现疾病的进展和转移,复发率较高[3-4]。纤维蛋白原(fibrinogen, Fib)作为反映患者术前凝血状态和系统性炎症反应的标志物[5-6],和多种实体肿瘤的预后有关[7-14]。通过本研究,我们拟探讨术前Fib与行TURBT治疗的NMIBC患者预后的相关因素,为更好辅助进行术后危险度分层提供参考依据。
1 资料与方法
1.1一般资料回顾性搜集2017-09—2018-08我院泌尿外科收治的膀胱癌患者的临床和病理资料。纳入标准:(1)首次病理确诊为NMIBC[15]。(2)接受TURBT。(3)术前1周有完整的血常规和血生化报告。(4)术后均行正规膀胱灌注治疗,并定期进行术后随访。排除标准:(1)病理确诊为膀胱原位癌(Tis)。(2)尿路上皮癌合并变异亚型(包含肉瘤样癌、未分化癌等)[15]。(3)同时罹患其他肿瘤,或其他系统的重大疾病。(4)手术前后合并感染性疾病。本课题为回顾性非干预性研究,已获我院医学伦理委员会批准(No.2019-074)。
1.2方法入组患者均于手术前1周内抽取外周静脉血,检测血常规、Fib。采血时患者无任何临床感染征象。术后定期随访,行膀胱镜检,1次/3个月;行胸部+泌尿系CT平扫,1次/6个月。并通过门诊或电话随访,详细记录患者术后治疗和疾病进展情况。结局指标为术后无复发生存时间(RFS)和无进展生存时间(PFS)。RFS指从第1次TURBT到膀胱镜检发现局部肿瘤的复发(且病理级别较第1次电切时未增高),PFS指从第1次TURBT到膀胱镜检发现局部肿瘤的复发(且病理级别较第1次电切时增高)或远处转移。随访截止于2021-01-21。中位随访时间为16.2个月(P25~P75:10.0~31.87个月)。
1.3统计学方法采用受试者工作特征曲线(ROC曲线)测算出Fib的最佳截断值(Youden指数最大)。计数资料采用秩和检验(等级资料分析)和卡方检验。K-M生存分析描述生存曲线,Log-rank法比较生存曲线之间的差异,多因素Cox风险比例模型确定影响预后的因素。
2 结果
2.1以Fib预测是否复发的ROC曲线分析本研究共纳入NMIBC患者73例。其中女14例,男59例;>60岁46例,≤60岁27例。有吸烟史41例(56.2%),有饮酒史31例(42.5%)。术中发现肿瘤为1处者55例,多于1处者18例;肿瘤直径>3 cm有19例,肿瘤直径≤3 cm有54例;Ta期64例(87.7%)、T1期9例(12.3%);低度恶性潜能乳头状尿路上皮肿瘤、低级别乳头状尿路上皮癌、高级别乳头状尿路上皮癌分别有12例(16.4%)、29例(39.7%)、32例(43.8%)。患者Fib区间为:1.73~4.55。中位Fib值为2.92(P25~P75:2.39~3.30)。ROC曲线(图1)中,Fib预测术后是否复发的曲线下面积(AUC)为0.635(P=0.074)。最佳诊断点为Fib=3.14,此时,敏感度为55.56%,特异度为70.91%。将入组患者分为Fib低值组(Fib≤3.14g/L,n=47)和Fib高值组(Fib>3.14g/L,n=26)。2组患者的临床及病理资料差异均无统计学意义(P>0.05)。见表1。
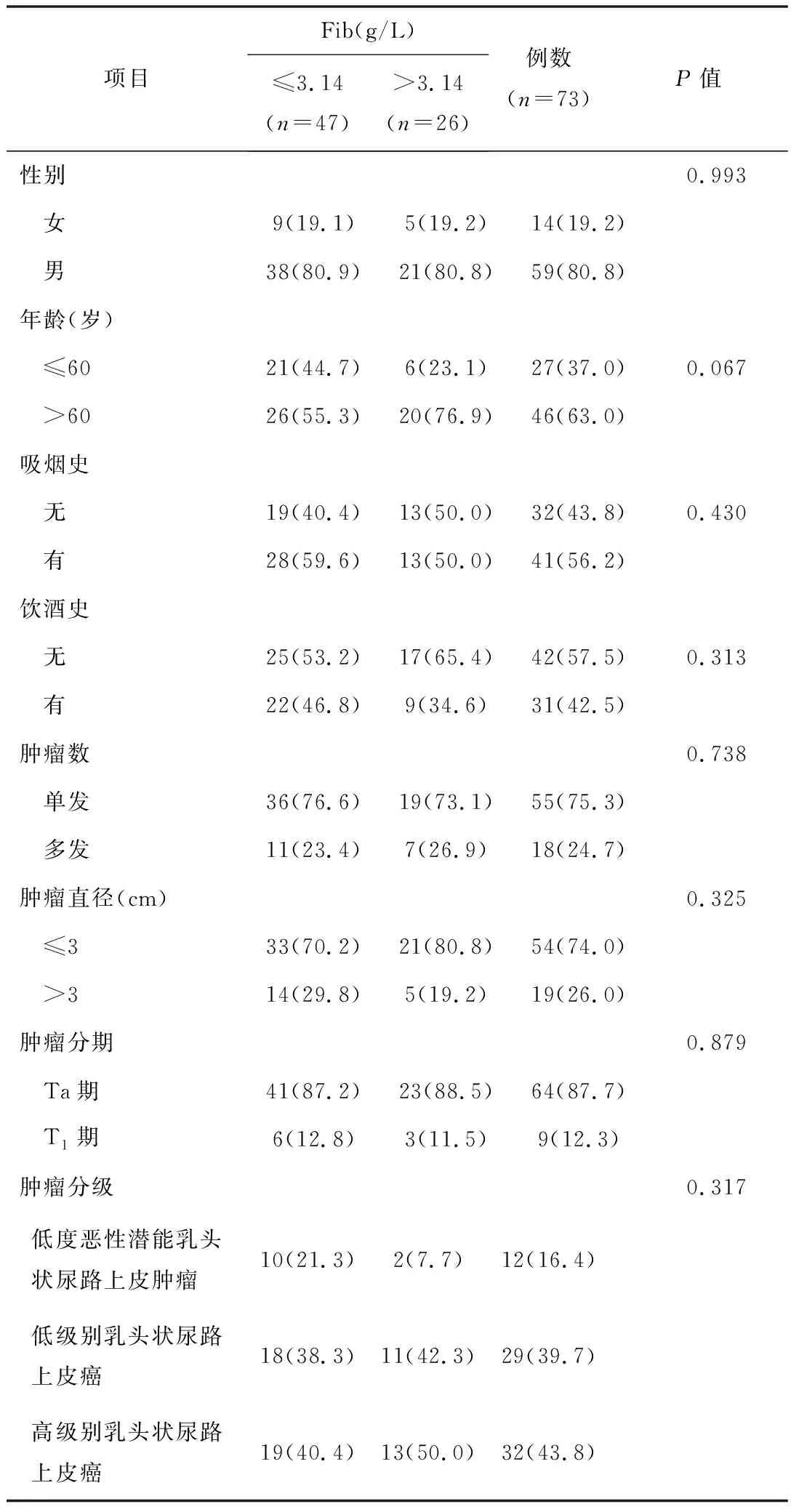
表1 术前Fib分组与临床病理特征[ n(%)]
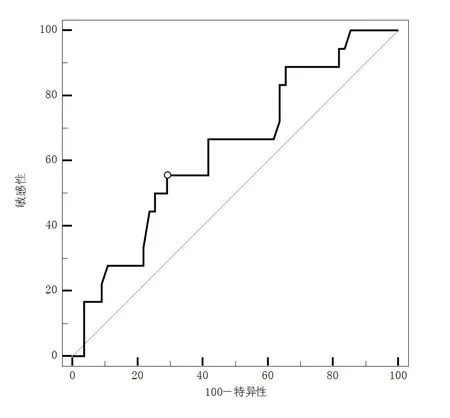
图1 Fib预测NMIBC术后复发的ROC曲线
2.2生存分析采用K-M生存分析法绘制对于Fib低值组和Fib高值组的无复发生存期和无进展生存期的生存曲线(图2)。结果显示,对于无复发生存期,Fib高值组的预后更差,术后复发风险更高[风险比(HR):3.10,95%可信区间(CI):1.19~8.10;P=0.021];对于无进展生存期,虽然2组进展风险差异无统计学意义 (HR:2.36,95%CI:0.70~8.00;P=0.167),但Fib高值组10个月、20个月、30个月、40个月的无进展生存率均较Fib低值组低,显示出Fib高值组整体预后更差的倾向。见表2。
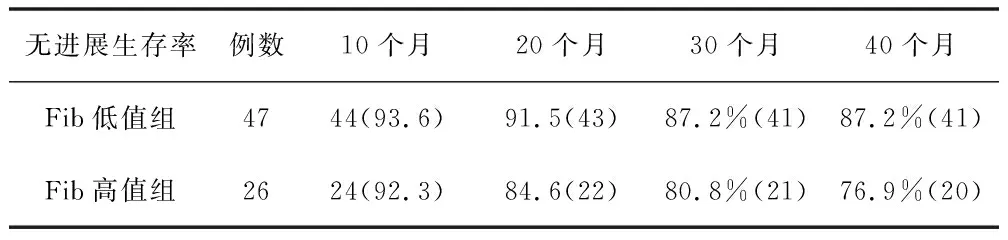
表2 Fib分层下的无进展生存率比较[ n(%)]
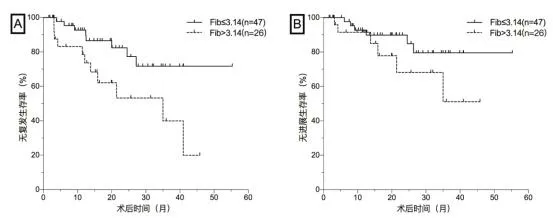
图2 在Fib分层下NMIBC患者术后是否复发(图A)、是否进展(图B)
2.3多因素分析对纳入患者进行Cox风险回归分析,Fib高值不是影响TURBT术后复发的独立危险因素(HR:2.06,95%CI:0.71~6.01;P=0.186)。见表3。
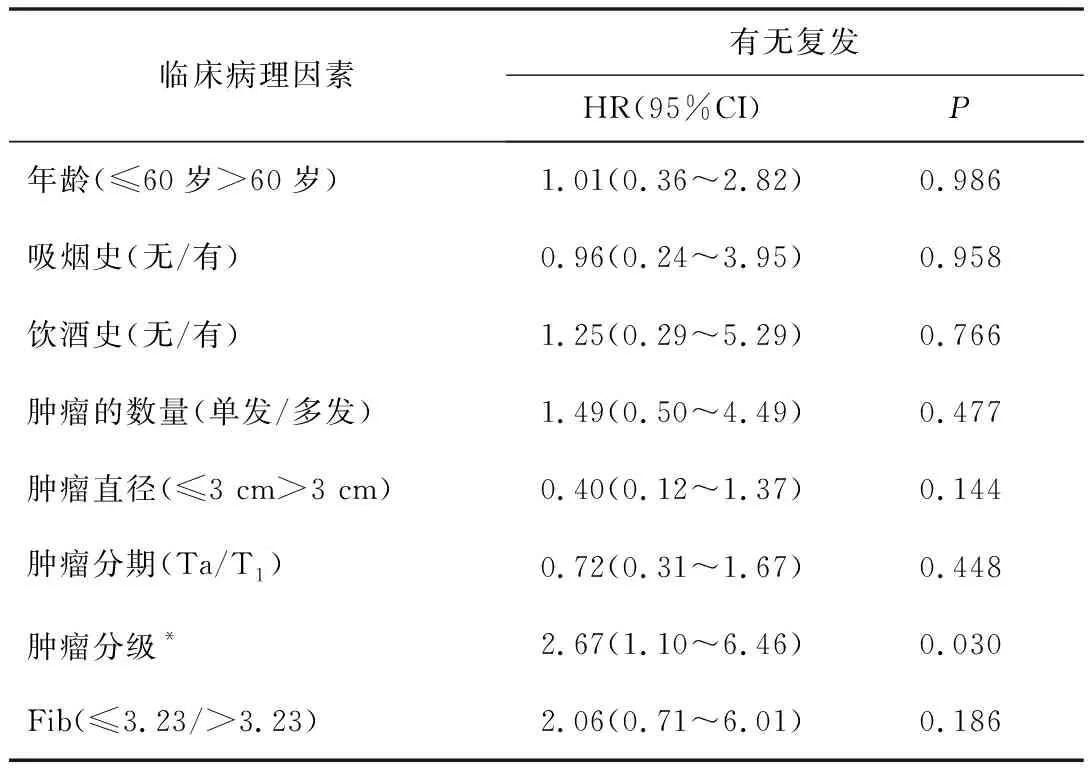
表3 TURBT的NMIBC患者的多因素分析
3 讨论
Fib是一种340kD的血浆糖蛋白,主要由肝细胞合成,被活化的凝血酶转化为纤维蛋白(止血过程的终产物),在凝血和溶血过程中起关键作用,同时其水平变化也受系统性炎症反应的影响[5-6]。Fib在肿瘤间质中广泛存在,包绕肿瘤细胞,影响肿瘤细胞的持续黏附和存活。局部纤维蛋白沉积和溶解是血管生成、肿瘤增殖、扩散转移的关键因素[16-17]。高水平的Fib可通过影响血管内皮生长因子、纤维生长因子等增加肿瘤栓子在靶器官内的附着,促进肿瘤转移[16]。同时,肿瘤能把Fib活化为纤维蛋白,影响纤溶系统和凝血系统,促进肿瘤的增殖、侵袭[18]。
术前Fib和多种实体肿瘤的预后有关[7-14]。但Hong等[18]报道前列腺癌患者的术前纤维蛋白原与正常人差异并无统计学意义。对于行膀胱癌根治术的患者,术前较高的Fib提示预后较差[19-20]。张宏伟等[21]、杜晓益等[22]、Li Xing等[23]报道,TURBT术前较高的Fib与较高的NMIBC分期、分级有关,术后复发、进展概率高[21-23]。但是Fib在膀胱肿瘤发生、转移、进展的机制仍然不清楚。本研究对Fib在行TURBT的NMIBC患者中是否是可靠的预测指标进行探讨。
本研究通过ROC曲线确定行TURBT的NMIBC患者术前Fib的最佳截断值为3.14,与有关报道的3.34、2.87、3.56相近[21-23]。提示以2.4~3.6作为Fib的截断值对行TURBT患者的NMIBC具有稳定的预测能力。本研究通过K-M生存分析,再次证实术前Fib高值是NMIBC术后复发的危险因素,Fib高患者复发风险更高。但对纳入患者进行Cox风险回归分析显示,Fib高值不是影响TURBT术后复发的独立危险因素。对于无进展生存期,虽然2组进展风险差异无统计学意义,但Fib高值组10个月、20个月、30个月、40个月无进展生存率均较Fib低值组更低,显示Fib高值组整体预后更差的倾向。Fib预测术后是否复发的ROC曲线的AUC为0.635,Fib对术后复发的单独诊断价值有限,需联合其他临床病理参数预测患者的术后复发情况。
本研究为回顾性研究,故存在一定局限性:(1)纳入的样本量有限,入组患者男女比例差别较大。(2)随访时间短,未采用总生存期等作为结局指标。(3)ROC曲线分析时,ROC曲线的AUC值不太大,最佳诊断点对应的敏感度和特异度均不太高。最佳诊断点虽能将入组患者恰当地分为各个临床及病理因素的分布比较均衡的两个组,且有关2组复发风险的K-M生存分析差异有统计学意义,但Fib预测术后是否复发的曲线下面积差异无统计学意义,可能与样本量不足有关。(4)对于无进展生存期,Fib高值组的预后更差,但2组进展风险差异无统计学意义,可能与随访时间不足有关。(5)未探讨与凝血、炎症相关的其他指标。
综上所述,对于行TURBT治疗的NMIBC患者,准确的术前风险评估能精准判断术后复发进展风险,进而指导术后治疗。术前Fib是NMIBC患者TURBT术后复发的危险因素之一。但结论尚需进行更高质量的临床研究予以证实。

