共沉淀中热力学耦合对正极材料电化学性能的影响
赵 赫, 高宣雯, 李建中, 丁学勇
(1. 东北大学 多金属共生矿生态化冶金教育部重点实验室, 辽宁 沈阳 110819; 2. 东北大学 冶金学院, 辽宁 沈阳 110819)
随着锂离子动力电池新能源汽车的高速发展,锂元素较低的储量和较高的成本引发了人们对锂离子电池发展问题的担忧[1-5].O3-NaNi0.4Mn0.4Fe0.2O2由于较高的实际容量(2.0~4.0 V充电时,充电比容量大于120 mAh·g-1)以及较低的成本,被认为是最有潜力替代锂离子二次电池的储钠正极材料[5].钠离子电池正极材料与锂离子电池正极材料制备的共沉淀工艺相似,通过改变不同的参数,如pH、反应温度和时间,以及初始溶液和材料的浓度,可以准确地优化和实现所需的最终产品[6].在Mn2+,Ni2+和Fe2+离子共存的环境中,共沉淀过程的理论基于水溶液热力学的类型,并与物质在水溶液中的稳定性密切相关.这种稳定性决定了液相中的结晶反应与溶液中的物质组成、pH 、浓度、温度和压力密切相关[7-11].此外,粒径、形态可能进一步受多种因素的影响,包括液相中的离子与沉积的结晶材料之间的沉淀结晶反应、吸附反应以及多个反应之间的热力学耦合.随着晶粒的逐渐长大和新的晶核不断出现,共存现象导致结晶反应和吸附反应之间的竞争[12-13].随着水溶液中离子浓度的变化形成饱和溶液,从而形成晶体,该过程可视为吉布斯自由能变(ΔG)减少的过程.热力学耦合会伴随并发生在多种离子共存的环境中,如果一个或多个分量的吉布斯自由能变(ΔG)非常优于其他分量,则吉布斯自由能变(ΔG)的组成会受到影响,例如加速某个分量的沉淀[14-15].因此,本文基于热力学耦合、多离子共存和过饱和,探索了吉布斯自由能变(ΔG)和耦合系数.采用铝离子掺杂来控制共沉淀过程并平衡沉淀驱动力以同时实现多个离子结晶反应.为共沉淀工艺生产和优化钠离子电池正极材料NaNi0.4Mn0.4Fe0.2O2提供理论支撑.
1 实 验
1.1 前驱体和正极材料的合成
通过共沉淀过程合成了各种前驱体.将化学计量比(Ni+Mn+Fe∶Al=1-x∶x)的Ni(CH3COO)2·4H2O(>99%),Mn(CH3COO)2·
4H2O(>99%),Fe(NO)3·9H2O(>99%)和Al(NO)3·9H2O(>99%)均匀混合并溶解在去离子水中.然后将该混合金属溶液泵入连续搅拌的罐式反应器中.同时,将作为沉淀剂的Na2CO3溶液和作为pH控制剂的NH4OH溶液在空气气氛中分别加入反应器中.在整个共沉淀过程中严格控制混合溶液的温度、pH 值和搅拌速度.然后,将所得粉末过滤、洗涤并在120 ℃下干燥获得前驱体.最后,将获得的前驱体与所需的Na2CO3充分混合,并在900 ℃下空气气氛中煅烧10 h.其中,Na2CO3的计量比过量5%用于补偿煅烧过程中Na的损失.
通过控制Al(NO)3·9H2O的用量合成不同掺杂量的样品,标记为Na[Ni0.4Mn0.4Fe0.2]1-xAlxO2(x=0, 0.002 5, 0.005, 0.01).
1.2 材料表征
使用具有非单色化Cu Ka靶材作为X射线源的布鲁克D8-advance衍射仪进行XRD测量以研究晶体结构.测试过程中管电压为40 kV,管电流为200 mA.使用日立JSM-7500场发射扫描电子显微镜检查样品的形态.使用BT-9300ST型激光粒度分布仪进行前驱体的粒度分布研究.
1.3 电化学性能测试
电化学性能通过使用组装在充满氩气的手套箱中的CR2025型纽扣电池进行测试.在N-甲基-2-吡咯烷酮中混合活性材料、乙炔黑和聚偏二氟乙烯PVDF(质量比为8∶1∶1)形成浆料,并将浆料涂覆在铝箔上来制备正极极片.正极极片在110 ℃下真空干燥12 h.正极极片活性物质的质量负载在1.2~1.5 mg·cm-2范围内.电解质是1 mol NaClO4溶解在体积比为1∶1的碳酸亚乙酯(EC)/碳酸二甲酯(DMC)中.半电池的负极为金属钠,隔膜为Whatman GF-D玻璃纤维素滤纸.恒电流充放电测试使用武汉蓝电LAND CT2001A型多通道电池测试系统.循环伏安测试(CV)和交流阻抗测试(EIS)采用普林斯顿2273A电化学工作站.
2 结果与讨论
2.1 Mn2+,Ni2+和Fe3+共沉淀过程中的热力学耦合效应
在恒温恒压条件下的析出过程中,Mn2+,Ni2+,Fe3+的结晶过程可视为吉布斯自由能变(ΔG)减少的过程.当使用Na2CO3同时沉淀 Mn2+,Ni2+和Fe2+时,可发生以下反应:
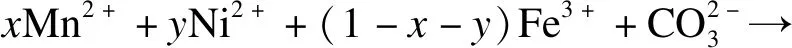
(1)
整个析出过程可以分为以下反应:
(2)
(3)
(4)
水溶液中碳酸铁是不存在的,因为一旦碳酸铁在水中形成复分解反应,碳酸盐与铁离子会发生双重水解,大量氢离子与羟基铁生成氢氧化铁、碳酸根离子和水.在水溶液中,Fe3+倾向于生成氢氧化铁,其溶度积常数为1.1×10-36,并发生以下反应:
Fe3++3OH-=Fe(OH)3.
(5)
相应的热力学行为可以使用吉布斯自由能变(ΔG)和反应温度(T)来描述.以MnCO3作为单独的沉淀过程为例,在沉淀反应的早期阶段,热力学参数可根据式(6)~(8)计算:
(6)
(7)
(8)
碳酸锰的过饱和度可表示为
(9)
同样,对于NiCO3和Fe2(CO3)3的相应过程,过饱和度和ΔG可以表示为
(10)
(11)
(12)
(13)
相应的沉淀参数可以根据表1中汇总的数据,根据式(6)~(13)计算和确认.对应的值分别为S1=3.68×104,S2=141.8,S3=2.6×1013.ΔG1=-26 060.1 J·mol-1,ΔG2=-12 281.4 J·mol-1,ΔG3=-76 572.9 J·mol-1.
在式(14)中,x=0.4,y=0.4:
ΔG0=xΔG1+yΔG2+(1-x-y)ΔG3=
-30 651.2 J·mol-1.
(14)
ΔG0<0表明结晶反应可以自发进行.可以得出结论,当多种离子共存时,FeCO3沉淀反应的驱动力远强于MnCO3,其次NiCO3.
2.2 Al3+添加引起的热力耦合效应
在恒温恒压共沉淀反应体系中,由Na2CO3,Mn(CH3COO)2,Ni(CH3COO)2,Fe(NO3)3和Al(NO3)3结晶生成的前驱体为xMnCO3·yNiCO3·z/2Fe2(CO3)3·(1-x-y-z)/2Al2(CO3)3,以生成1 mol前驱体为例,反应为
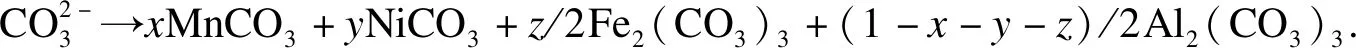
(15)
式(15)可分为以下单独的沉淀反应:
(16)
(17)
(18)
(19)
与Fe2(CO3)3相似,Al2(CO3)3不能存在于水中,并会像式(20)中那样产生Al(OH)3,其溶度积常数为3×10-34.
(1-x-y-z)Al3++3OH-=Al(OH)3.
(20)
理论上单独的碳酸盐或氢氧化物的沉淀过程热力学行为可以使用吉布斯自由能变(ΔG)和反应温度(T)来描述.以MnCO3沉淀过程为例,在沉淀反应的早期阶段,热力学参数可以根据式(21)~(24)计算:
(21)
(22)
(23)
碳酸锰的过饱和度可表示为
(24)
类似地,对于NiCO3,Fe(OH)3和Al(OH)3的相应过程,过饱和度和吉布斯自由能变可以表示为
(25)
(26)
(27)
(28)
(29)
(30)
经过化学分析和计算,Al添加量从x=0增加到x=0.002 5,0.005和0.01时共沉淀反应完全后上清液中各种元素的浓度汇总在表1中.反应过程中相应的离子过饱和度(S)和ΔG值可以分别表示为S0,Sa,Sb,Sc和ΔG0,ΔGa,ΔGb,ΔGc.所有数据均根据上述式计算得出,分别汇总在表2和表3中.
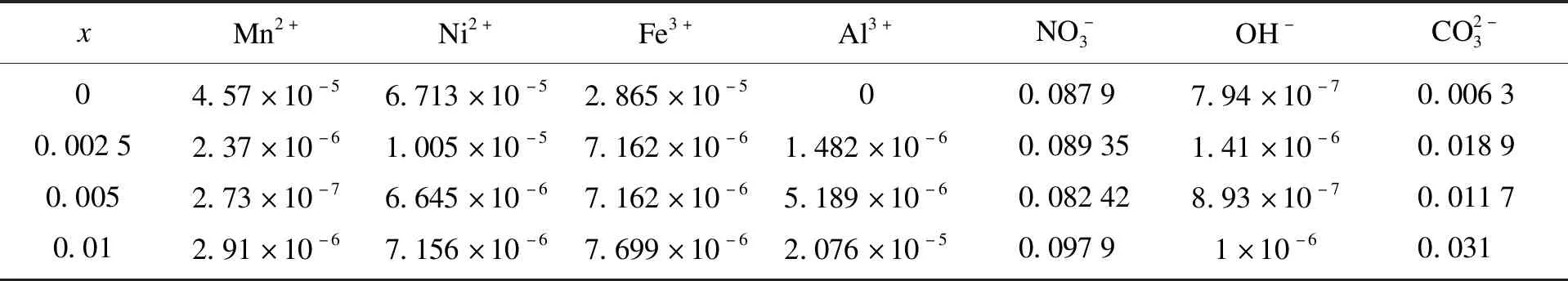
表1 不同样品上清液离子浓度Table 1 Ion concentrations of differentliquid supernatant mol·L-1

表2 溶液中离子的过饱和度Table 2 The degree of supersaturation of ion in the solution

表3 共沉淀过程中的吉布斯自由能变(ΔG)Table 3 The Gibbs free energy(ΔG)change in the co-precipitation J·mol-1
离子过饱和度(S)和ΔG值的变化趋势如图1所描述.从图1a和1b可以看出,Al3+的过饱和度随着Al3+添加量的增加呈现出先增大后减小的趋势,而当Al3+从x=0.002 5到x=0.01时,Al3+的ΔG表现出相反的趋势.同时,即使添加少量的Al3+,Mn2+和Ni2+的过饱和度(S)和ΔG值也会发生剧烈变化.如图1c沉淀过程示意图所示,由于热力学耦合效应,Al3+更高的过饱和度和更负的ΔG代表了加速Ni2+和Mn2+沉淀的驱动力.同时,由于Al(OH)3晶种的优先形成和在溶液中良好的吸附能力,溶液中的Ni2+和Mn2+可以被吸附并在Al(OH)3表面生长而完全沉淀.另一方面,Fe3+的沉淀行为与Ni2+和Mn2+的沉淀行为相反.当Al3+添加量为0.005时,各元素的热力学行为达到相对一致的程度,从而同时共沉淀.因此,可以得出结论,即使少量的 Al3+掺杂也会显著影响Ni2+,Mn2+和Fe2+的沉淀.通过添加Al3+产生的热力学耦合效应,可以通过加速或抑制来平衡和实现不同元素的析出一致性.

图1 添加Al3+前后离子过饱和度和ΔG值的变化趋势及对应的共沉淀过程示意图Fig.1 Schematic diagram of the change trend of ion supersaturation, ΔG and the corresponding co-precipitation process(a)—添加Al3+后的过饱和度趋势; (b)—添加Al3+后的Gibbs自由能变(ΔG)趋势; (c)—添加Al3+前后的共沉淀过程示意图.
生成1 mol前驱体反应的ΔG为
ΔG=xΔG5+yΔG6+z/2ΔG7+
(1-x-y-z)/2ΔG8.
(31)
当未添加Al3+时,对应的结果为
ΔG0=-30 651.2 J·mol-1;
当Al3+添加量为x=0.002 5时,则有
ΔGa=-24 941.5 J·mol-1;
当Al3+添加量为x=0.005时,则有
ΔGb=-19 271.9 J·mol-1;
当Al3+添加量为x=0.01时,则有
ΔGc=-24 338.3 J·mol-1.
由于ΔG0<ΔGa<ΔGc<ΔGb< 0,可以认为Al3+对整个共沉淀反应有一定的促进作用,当Al3+添加量为x=0.005时,促进作用最大.然而,随着Al含量的增加,Mn2+和Ni2+的析出会略有增加,并且在x达到0.005之前,Fe3+的析出也有所增加.
前驱体的粒度分布可以通过在激光粒度分布仪的辅助下进行研究,如图2所示.
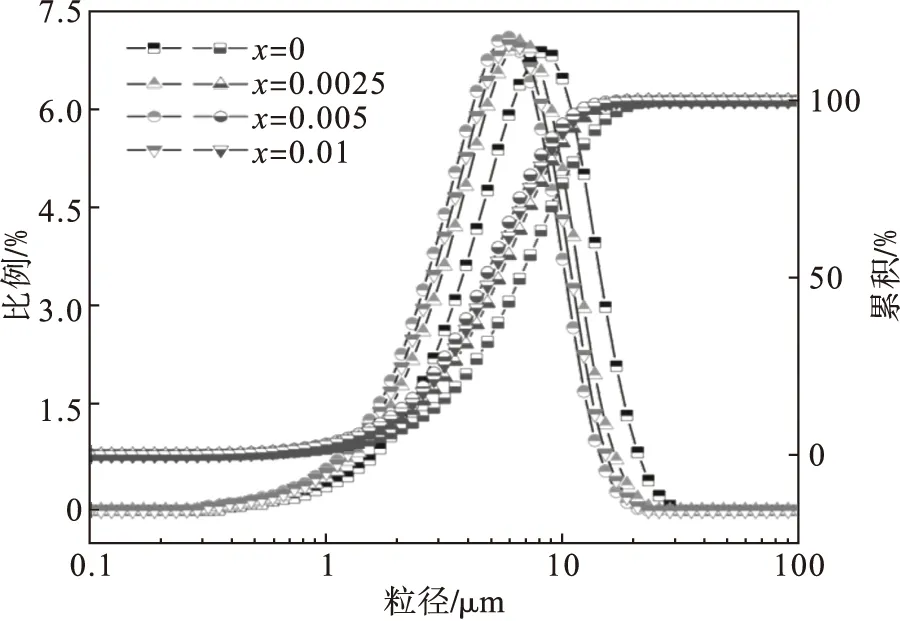
图2 前驱体的粒度分布Fig.2 Particle size distribution of precursor
与热力学计算的结果一样,Al3+的添加可以显著影响前驱体中粒度的分布.通过优化Al3+的添加量,粒度分布的均匀度也会发生变化.当Al3+添加量x从0增加到0.005时,不同粒度的分布呈正趋势,而当Al3+添加量x高达0.01时则呈负向分布.
2.3 正极材料相结构与形貌分析
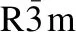

图3 正极材料的XRD图谱Fig.3 XRD patterns of cathode materials
除了α-NaFeO2相结构的衍射峰以外,所有样品在42°左右的位置观察到NiO杂质相的衍射峰.此外随着Al掺杂量不断增加,制备的正极材料的衍射峰位置基本没有变化,表明Al掺杂对材料的相结构与组成成分没有明显影响.同时,当Al掺杂量x=0.005时,制备的正极材料的衍射峰强度最强,这是由于形成的前驱体具有更小的粒径,从而所获的正极材料具有较小的粒径.
图4为Al掺杂的Na[Ni0.4Mn0.4Fe0.2]1-xAlxO2(x=0, 0.002 5, 0.005, 0.01)样品的SEM图像.从图4a中可以看出,未掺杂样品表现出不规则的形貌,粒径分布不均一且出现较严重的团聚,其粒径范围在0.3~1 μm之间.在掺杂后样品中,材料的形貌趋近于八面体特征,如图4b~4d所示.其中,Al掺杂量x=0.005时,样品的SEM照片显示出相对较为均匀的粒径分布,其平均颗粒尺寸为0.2 μm,初级晶体的表面光滑且完整,并具有更完整的层状正极材料单晶体的八面体特征.对于钠离子电池的正极材料,这种结构有助于电解液的渗透和加速反应动力学[17].

图4 Na[Ni0.4Mn0.4Fe0.2]1-xAlxO2的SEM图Fig.4 SEM of Na[Ni0.4Mn0.4Fe0.2]1-xAlxO2(a)—x=0; (b)—x=0.002 5; (c)—x=0.005; (d)—x=0.01.
2.4 正极材料电化学性能分析
图5是Na[Ni0.4Mn0.4Fe0.2]1-xAlxO2(x=0,0.002 5,0.005和0.01)样品的充放电测试.图5a~图5d显示了不同Al掺杂量样品在2.0~4.0 V电压范围内不同倍率下的初始充放电曲线.其中,Na[Ni0.4Mn0.4Fe0.2]0.995Al0.005O2在3.5 V左右具有典型的电压平台,这可归因于它的两相反应.该材料在0.1C,0.2C,0.5C,1.0C,2.0C和5.0C下的放电容量分别为135.1,122.9,108.8,99.5,91.5和79.8 mAh·g-1.图5e显示了不同Al掺杂量正极材料的倍率性能.结果表明,Al3+掺杂对Na[Ni0.4Mn0.4Fe0.2]1-xAlxO2样品在不同充放电速率下的放电比容量具有显著影响.这是因为Al元素的引入使得Na[Ni0.4Mn0.4Fe0.2]0.995Al0.005O2样品的性质发生变化,例如具有均匀的粒径分布,杂质相减少和较大的表面积,导致更多的反应位点和在氧化还原中的反应过程更短的钠离子快速扩散距离.图5f为各个样品在0.5C倍率下的循环性能.与纯样品相比,Al掺杂材料表现出明显更稳定的循环性能.
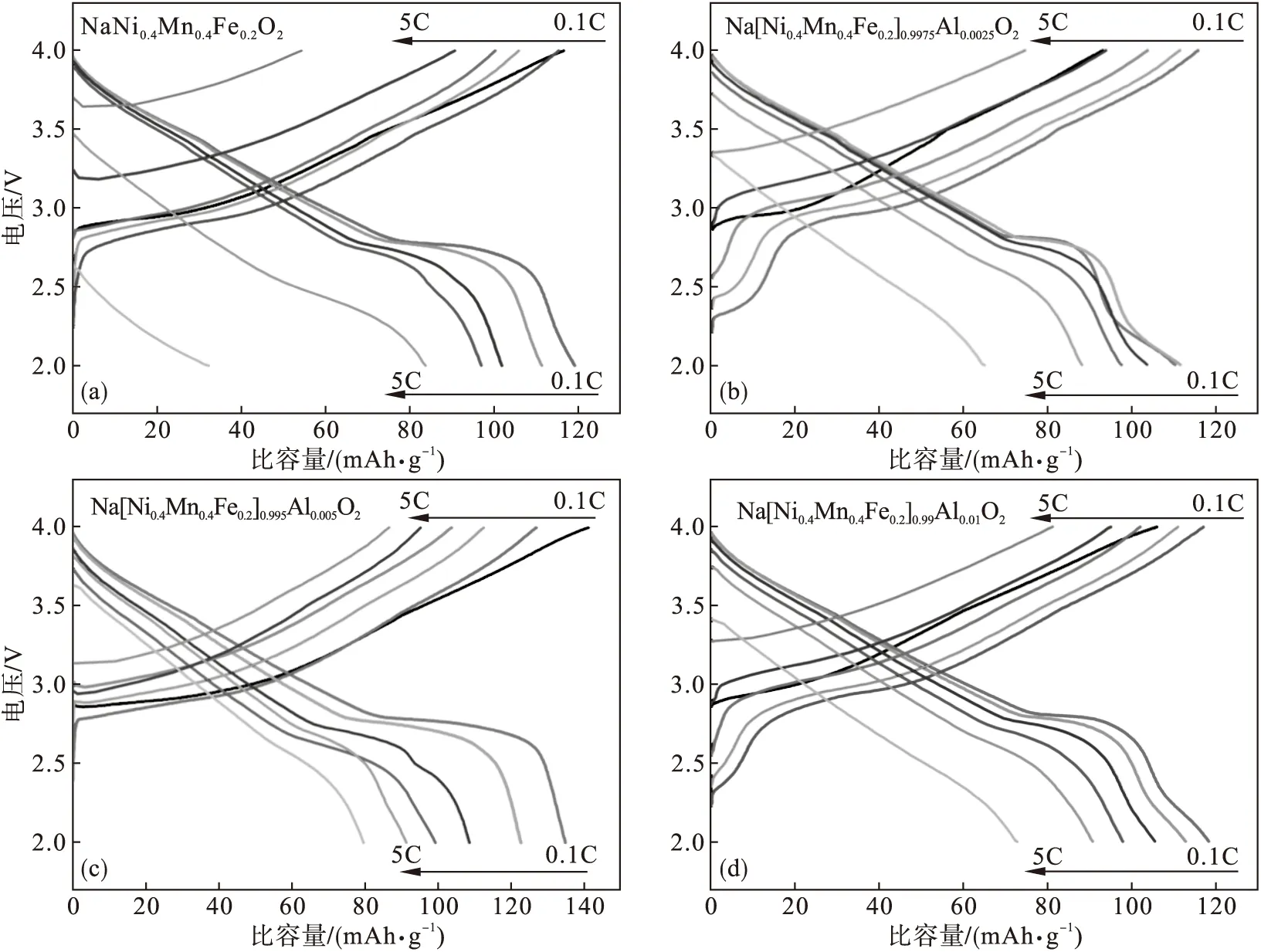
图5 正极材料的充放电测试Fig.5 Charge and discharge tests of cathodes(a)~(d)—充放电曲线; (e)—倍率性能; (f)—循环性能.
图6是对各种样品进行的循环伏安测试和交流阻抗测试.如图6a~图6d所示,在2.0~4.0 V电压范围内0.1 mV·s-1扫描速率下的循环伏安图中,所有样品均呈现标准的层状氧化物谱图,其中3.4 V左右存在的氧化还原峰与NiO相有关.然而,与未掺杂的NaNi0.4Mn0.4Fe0.2O2样品相比,Al掺杂的样品具有更宽的电压平台和更小的极化,表明掺杂样品具有更好的反应动力学.Na[Ni0.4Mn0.4Fe0.2]1-xAlxO2材料的电化学阻抗谱如图6e所示.所有的EIS测试是在对每个电池进行完整的循环伏安法测试后进行的.所有样品的阻抗谱类似,高频时有一个电容回路,低频区与Warburg阻抗(Zw)相关.感抗电阻(Rf)和具有非理想电容器(CPE1)的恒定相位元件对应于高频区半圆.电荷转移电阻(Rct)和具有非理想电容器(CPE2)的恒定相位元件对应于低频区半圆,阻抗曲线与Z′轴的交点与电极和电解质的电阻(Rs)相关[18].同时,钠离子的扩散系数(DNa)用公式(32)和(33)[19-20]计算:


图6 正极材料的循环伏安和交流阻抗测试Fig.6 CV and EIS tests of cathodes(a)~(d)—0.1 mV·s-1扫描速率下的循环伏安曲线; (e)—交流阻抗谱; (f)—角频率与阻抗谱实部和虚部的关系.
Z′=Rs+Rct+δω·ω-0.5,
(32)
(33)
其中:ω为频率;Warburg阻抗系数(δω)由Z′-ω-0.5的线性拟合获得,如图6f所示;R为理想气体常数;F(C·mol-1)为法拉第常数;T(K)为绝对温度;A(cm2)为活性材料的表面积;C(mol·cm-3)为与钠嵌入状态相关的活性电极材料中Na+的密度.
从等效电路计算的阻抗值如表4所示,较低的电荷转移电阻显著增强了电子导电性和电荷转移过程.这表明Al3+掺杂样品在Na+扩散的迁移率方面表现出明显的改善.Al掺杂对层状钠正极材料中的电子电导率和晶格结构的变化具有积极的影响.从电荷转移电阻值的变化可以看出,Al3+掺杂材料的电子传导激活能较低,进而提升材料的电子电导率.电子电导率的提高有助于提高层状钠离子正极材料的电化学性能[21].

表4 通过等效电路计算Na[Ni0.4Mn0.4Fe0.2]1-xAlxO2的阻抗参数Table 4 Impedance parameters for Na[Ni0.4Mn0.4Fe0.2]1-xAlxO2
3 结 论
1) 基于热力学计算,当多种离子共存于液体溶液中并同时发生结晶反应时,会发生耦合效应.
2) 尽管各种元素的沉淀结晶驱动力不同,但由于Al3+更高的过饱和度和少量Al3+添加带来的更负的吉布斯自由能变(ΔG),耦合效应可以有效地控制和平衡共沉淀过程,加速共沉淀过程.
3) Al3+的引入促进Ni2+和Mn2+的沉淀并抑制Fe3+的沉淀.当Al3+的添加量为x=0.005时,得到的前驱体粒径分布均匀,制备的正极材料表现出更好的电化学性能,为开发高性能钠离子电池正极材料铺平道路.

