人参皂苷Rg3靶向Wnt/β-连环蛋白信号通路调控胃癌顺铂耐药性
孟子琪,张 睿,吴旭微,金铁峰,张美花
1延边大学医学院肿瘤研究中心,吉林延吉 133000 2延边大学附属医院健康体检科,吉林延吉 133000
胃癌是消化道系统最常见的恶性肿瘤之一,每年有超过100万的新发病例[1]。尽管胃癌诊断和治疗水平已取得了进步,但患者5年生存率仅约为25%。术后辅助放化疗是预防复发转移和提高患者长期生存率的重要治疗手段,然而其不良反应和肿瘤细胞的耐药性是影响化疗效果的关键因素[2]。因此,寻求解决肿瘤细胞耐药的有效途径,是癌症临床治疗的热点之一。人参皂苷Rg3是从中药人参中提取的四环三萜单体,具有多种药理作用[3]。研究表明,人参皂苷Rg3可诱导肿瘤细胞凋亡并抑制肿瘤细胞增殖、迁移、血管形成和耐药性等[4-5]。人参皂苷Rg3已作为一种有效的抗肿瘤药物,应用于肺癌、乳腺癌、肝癌和卵巢癌等恶性肿瘤的治疗[6-9]。Wnt/β-连环蛋白(β-catenin)信号通路,又称经典Wnt信号通路,是一个保守的信号轴,参与细胞增殖、凋亡、侵袭和迁移等多种病理生理过程[10]。研究表明,靶向Wnt/β-catenin信号通路可抑制多种癌症干细胞自我更新、细胞增殖和分化等。目前关于人参皂苷Rg3对胃癌顺铂(cisplatin,DDP)耐药作用影响的文献报道较少,本研究通过分析人参皂苷Rg3对DDP耐药细胞株SGC-7901/DDP的增殖、凋亡、迁移及上皮-间充质转化(epithelial-mesenchymal transition,EMT)进程的影响,探究其抑制胃癌细胞株耐药性的具体分子机制,为临床治疗胃癌DDP耐药提供理论依据。
材料和方法
材料和试剂1640培养基、胰蛋白酶和胎牛血清均购自以色列Biological Industries公司,顺铂购自江苏豪森药业集团有限公司,人参皂苷Rg3购自上海源叶生物科技有限公司,MTT购自杭州碧云天生物技术有限公司,ECL化学发光试剂盒和鼠抗人β-actin单克隆抗体均购自康为世纪生物科技有限公司,EdU试剂盒购自广州锐博生物技术有限公司,Annexin V/PI凋亡试剂盒购自美国Becton Dickinson公司,兔抗人活化的半胱氨酸天冬氨酸蛋白酶-3(cysteinyl aspartate specific proteinase,Caspase-3)、活化的Caspase-8、E钙黏蛋白(E-cadherin)和转录因子Snail克隆抗体均购自美国Cell Signaling Technology公司,鼠抗人Bax、Bcl2、ZO-1、波形蛋白(Vimentin)、转录因子Slug、基质金属蛋白酶(matrix metalloproteinase,MMP)2、MMP9、Wnt、β-catenin、C-myc和细胞周期蛋白D1(Cyclin D1)单克隆抗体均购自美国Santa Cruz公司,辣根过氧化物酶标记的山羊抗兔和山羊抗鼠IgG购自北京中杉金桥生物技术有限公司,Alexa Fluor®568标记的山羊抗鼠IgG(H+L)购自美国Invitrogen公司。
细胞培养人胃黏膜细胞GES-1、人胃癌细胞SGC-7901及DDP耐药细胞SGC-7901/DDP均由延边大学肿瘤研究中心提供。将细胞置于含有10%胎牛血清和1%双抗(100 U/ml青霉素和100 μg/ml链霉素)的1640培养基中,37 ℃、5%CO2培养箱内培养,待细胞贴壁至80%~90%融合度时传代,取对数生长期的细胞进行后续实验。
MTT法检测细胞活力取对数生长期的人胃黏膜细胞GES-1、人胃癌细胞SGC-7901和SGC-7901/DDP常规消化制成悬液,以5×103个/孔的密度接种于96孔板中,置于培养箱中培养24 h后更换培养基,分别加入浓度为0、0.2、0.4、0.8、1.6、3.2 μg/ml的DDP和浓度为0、10、20、40、80、160 μg/ml的人参皂苷Rg3,置于培养箱中培养48 h。每孔加入100 μl的MTT(1 μg/ml),培养4 h。每孔加入100 μl二甲基亚砜,酶标仪测量490 nm波长处吸光值。细胞存活率=用药组吸光值/对照组吸光值×100%,计算48 h的半数抑制浓度(median inhibition concentration,IC50)。
平板克隆形成实验取对数生长期的SGC-7901/DDP细胞以每孔500个细胞的密度接种于6孔板中,置于培养箱中培养。待细胞贴壁时,分别用人参皂苷Rg3和DDP单独或联合治疗SGC-7901/DDP细胞,对照组加入培养基。48 h后更换新鲜培养基继续培养15 d,其中每2 d更换1次培养基,当形成肉眼可见的细胞克隆后终止培养。PBS洗3次,每孔加入2 ml甲醇室温固定20 min,苏木素染色10 min,蒸馏水冲洗晾干,拍照并统计细胞集落数。
EdU细胞增殖实验取对数生长期的SGC-7901/DDP细胞以5×104个/孔的密度接种于96孔板中,置于培养箱中培养24 h更换培养基,分别用人参皂苷Rg3和DDP单独或联合治疗SGC-7901/DDP细胞48 h,对照组加入等量培养基。每孔加入100 μl EdU工作液(5 μmol/L)培养2 h。PBS洗2次,100 μl的4%多聚甲醛室温固定20 min,50 μl甘氨酸(2 mg/ml)孵育5 min,100 μl的PBS脱色5 min,100 μl的0.5%Triton X-100的PBS渗透剂孵育10 min,100 μl的Apollo染色反应液室温避光孵育30 min,100 μl的甲醇孵育5 min,100 μl的Hoechst 33342染色液室温避光孵育30 min,PBS洗3次。荧光显微镜下拍照。
流式细胞术检测细胞凋亡取对数生长期的细胞以1×105个/孔的密度接种于6孔板中,置于培养箱中培养24 h更换培养基,分别用人参皂苷Rg3和DDP单独或联合治疗SGC-7901/DDP细胞48 h,对照组加入等量培养基。消化离心各组细胞,重悬细胞至密度为5×105个/ml,取100 μl细胞悬液至EP管中,分别加5 μl的Annexin V染料和5 μl的PI染料,室温避光孵育15 min,分别加400 μl的1×结合缓冲液轻轻混匀,用滤网过滤后上机检测并分析。
Hoechst 33342染色检测细胞凋亡取对数生长期的细胞以5×104个/孔的密度接种于载有盖玻片的6孔板中,置于培养箱中培养24 h更换培养基,分别用人参皂苷Rg3和DDP单独或联合治疗SGC-7901/DDP细胞48 h,对照组加入等量培养基。每孔加入2 ml的4%多聚甲醛室温固定10 min,PBS洗3次,加入1 ml的Hoechst 33342染色液(10 mg/L)室温孵育30 min,PBS洗3次,封片后在荧光显微镜下拍照。
Western blot检测取对数生长期的细胞以5×104个/孔的密度接种于6孔板中,分别用人参皂苷Rg3和DDP单独或联合治疗SGC-7901/DDP细胞48 h,对照组加入等量培养基。每孔加入适量含1%蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液冰上孵育10 min,刮下细胞于EP管中,冰上进行超声破碎裂解细胞。用BCA法检测蛋白浓度,加入5×上样缓冲液,100 ℃变性5 min。每孔加入30 μg变性蛋白于8%SDS-PAGE分离胶中分离蛋白,以5 μl的β-actin为对照,将含有蛋白的分离胶转移至PVDF膜上,5%脱脂牛奶室温封闭1 h,加入相应一抗(1∶1000)孵育PVDF膜4 ℃过夜。1×TBST洗膜3次,加入对应属性的二抗(1∶3000)室温孵育2 h,1×TBST洗膜3次,ECL化学发光试剂显影,Image J分析条带灰度值。
细胞划痕愈合实验取对数生长期的细胞常规消化制成悬液接种于6孔板中,置于培养箱中培养,待细胞融合度为70%~80%时,用200 μl无菌枪头在每孔中垂直划痕,分别用人参皂苷Rg3和DDP单独或联合治疗SGC-7901/DDP细胞48 h,对照组加入等量培养基。分别于0、24、48 h在显微镜下拍照并计算细胞划痕愈合率。
Transwell迁移实验取对数生长期的细胞以5×105个/ml的密度接种于Transwell小室内,下室加入800 μl培养基,置于培养箱中培养6 h后更换培养基,上室分别用人参皂苷Rg3和DDP单独或联合治疗SGC-7901/DDP细胞,下室加入800 μl含10%胎牛血清的培养基,置于培养箱中培养48 h后取出小室,每孔加入2 ml甲醇室温固定20 min,苏木素染色10 min,棉签擦拭小室内残留细胞,沿小室边缘切割薄膜,中性树胶封片,显微镜下拍照并统计个数。
免疫荧光染色取对数生长期的细胞以5×104个/孔的密度接种于6孔板中,分别用人参皂苷Rg3和DDP单独或联合治疗SGC-7901/DDP细胞48 h,对照组加入等量培养基。每孔分别依次加入2 ml的4%多聚甲醛室温固定10 min、2 ml的0.5% Triton X-100室温渗透10 min、2 ml的3% BSA室温封闭2 h,再加入100 μl的一抗(1∶100)4 ℃过夜。PBS洗3次,每孔加入100 μl荧光二抗(1∶400)室温避光孵育1 h,含有DAPI的封片剂封片,荧光显微镜下拍照。
统计学处理采用SPSS 26.0统计软件,计量资料以均数±标准差表示,组间比较采用t检验,多组间比较采用单因素方差分析。所有实验均独立重复3次。P<0.05为差异有统计学意义。
结 果
人参皂苷Rg3增强SGC-7901/DDP细胞对DDP的敏感性MTT法检测结果显示,DDP对SGC-7901细胞的IC50为0.65 μg/ml,对SGC-7901/DDP细胞的IC50为1.40 μg/ml,人参皂苷Rg3联合DDP对SGC-7901/DDP细胞的IC50为1.12 μg/ml。与0 μg/ml组比较,10、20、40、80、160 μg/ml人参皂苷Rg3处理后SGC-7901/DDP细胞活力分别为(86.33±4.51)%、(83.33±4.04)%、(82.00±5.29)%、(74.33±2.52)%、(72.00±1.73)%,差异有统计学意义(t=5.250,P=0.034;t=7.143,P=0.019;t=5.892,P=0.028;t=17.670,P=0.003;t=28.000,P=0.001);人正常胃黏膜细胞GES-1的活力分别为(99.67±0.58)%、(99.33±1.16)%、(98.33±1.16)%、(98.00±1.00)%、(97.67±1.53)%,差异无统计学意义(t=1.000,P=0.423;t=1.000,P=0.427;t=2.500,P=0.130;t=3.464,P=0.074;t=2.646,P=0.118)。40 μg/ml人参皂苷Rg3和0、0.2、0.4、0.8、1.6、3.2 μg/ml DDP联合治疗组的SGC-7901/DDP细胞活力明显低于对照组(t=7.559,P=0.002;t=7.000,P=0.002;t=1.565,P=0.193;t=7.273,P=0.002;t=7.620,P=0.002;t=3.897,P=0.018)(图1A)。根据本实验结果,选取40 μg/ml人参皂苷Rg3和1.40 μg/ml DDP用于后续实验。EdU染色实验结果显示,人参皂苷Rg3和DDP联合治疗组的细胞增殖率明显低于人参皂苷Rg3治疗组[(18.00±5.57)%比(45.67±2.08)%;t=8.062,P=0.001]和DDP治疗组[(18.00±5.57)%比(42.33±2.08)%;t=7.090,P=0.002](图1B、1C)。平板克隆形成实验结果显示,人参皂苷Rg3和DDP联合治疗组的克隆形成数量明显低于人参皂苷Rg3治疗组(52.33±7.51比95.67±5.51;t=8.062,P=0.001)和DDP治疗组(52.33±7.51比86.67±6.11;t=6.144,P=0.004)(图1D、1E)。

DDP:顺铂
人参皂苷Rg3联合DDP协同促进SGC-7901/DDP细胞凋亡能力流式细胞术检测结果显示,人参皂苷Rg3和DDP联合治疗组的细胞凋亡率明显高于人参皂苷Rg3治疗组[(21.59±5.02)%比(5.78±0.13)%;t=5.530,P=0.031]和DDP治疗组[(21.59±5.02)%比(10.45±2.01)%;t=6.036,P=0.026](图2A、2B)。Hoechst 33342染色结果显示,与单药治疗组比较,联合治疗组凋亡小体数量增多(图2C)。Western blot检测结果显示,与人参皂苷Rg3治疗组和DDP治疗组比较,联合治疗组的活化的Caspase-3(1.31±0.08比0.85±0.01;t=9.534,P=0.007和1.31±0.08比1.03±0.09;t=4.039,P=0.016)、活化的Caspase-8(1.38±0.02比0.82±0.01;t=61.030,P<0.001和1.38±0.02比0.94±0.01;t=48.390,P<0.001)、Bax/Bcl2(1.63±0.06比0.75±0.01;t=27.860,P<0.001和1.63±0.06比0.87±0.03,t=20.700,P<0.001)表达水平显著升高(图2D、2E)。
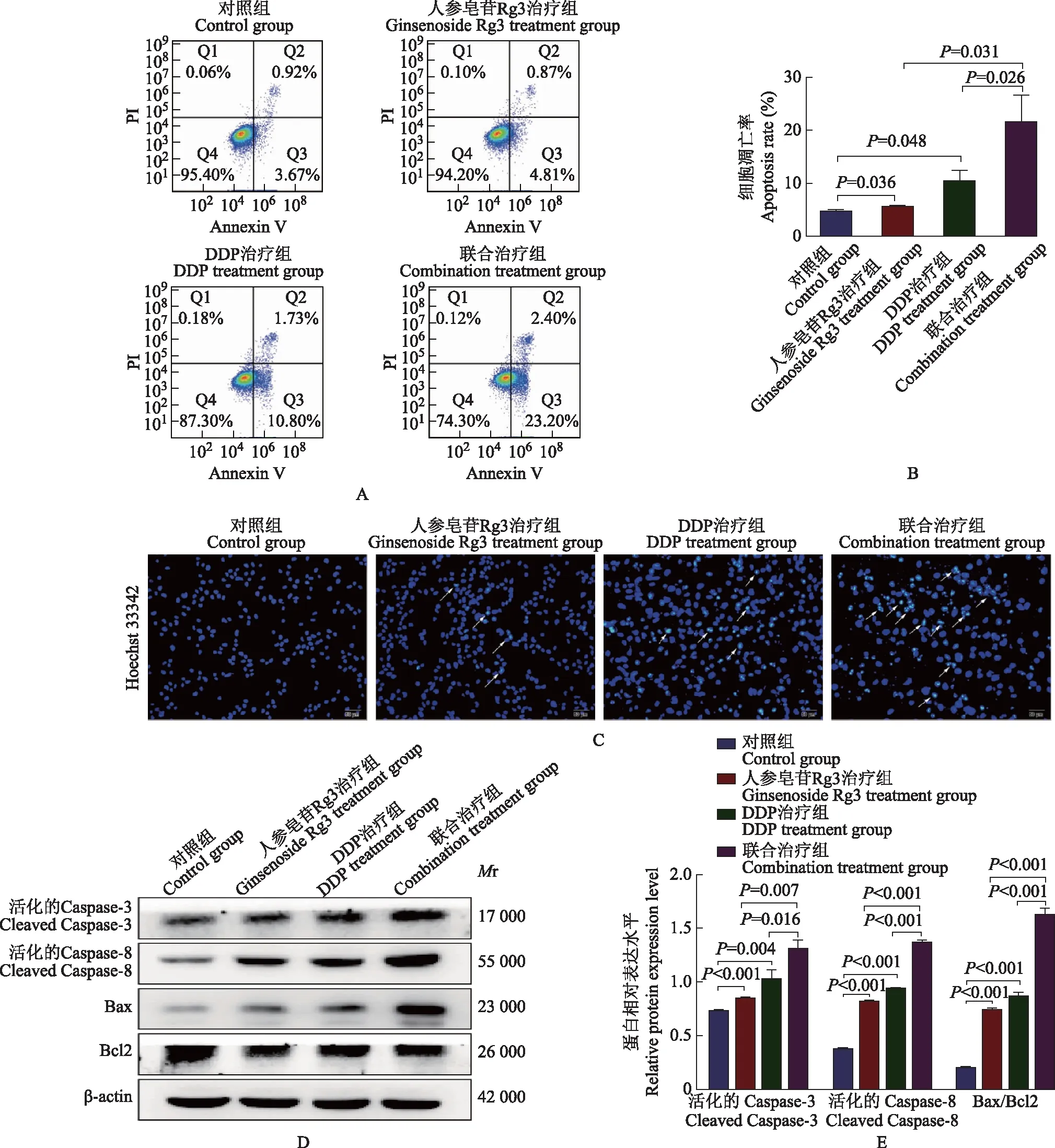
Mr:相对分子质量;Caspase:半胱氨酸天冬氨酸蛋白酶
人参皂苷Rg3联合DDP协同抑制SGC-7901/DDP细胞迁移能力细胞划痕实验检测结果显示,人参皂苷Rg3和DDP联合治疗组的SGC-7901/DDP细胞48 h迁移率明显低于人参皂苷Rg3治疗组[(10.64±2.18)%比(43.12±7.26)%;t=7.424,P=0.002]和DDP治疗组[(10.64±2.18)%比(31.39±8.04)%;t=4.317,P=0.013](图3A、3B)。Transwell实验检测结果显示,人参皂苷Rg3和DDP联合治疗组的SGC-7901/DDP细胞的迁移率明显低于人参皂苷Rg3治疗组[(52.33±7.51)%比(95.67±5.51)%;t=7.140,P=0.019]和DDP治疗组[(52.33±7.51)%比(86.67±6.11)%;t=5.179,P=0.035](图3C、3D)。

A.细胞划痕实验检测人参皂苷Rg3与DDP单独或联合治疗对SGC-7901/DDP细胞迁移能力的影响;B.不同治疗组的细胞愈合率;C.Transwell实验检测人参皂苷Rg3与DDP单独或联合治疗对SGC-7901/DDP细胞迁移能力的影响;D.不同治疗组的细胞迁移数量
人参皂苷Rg3联合DDP协同抑制SGC-7901/DDP细胞EMT进程Western blot检测结果显示,人参皂苷Rg3和DDP联合治疗组的上皮标志物E-cadherin(1.02±0.01比0.65±0.01;t=36.450,P<0.001和1.02±0.01比0.68±0.01;t=33.810,P<0.001)和ZO-1(1.30±0.04比0.39±0.01;t=37.060,P<0.001和1.30±0.04比0.37±0.01;t=37.030,P<0.001)蛋白表达水平明显高于人参皂苷Rg3治疗组和DDP治疗组;间质标志物Vimentin(0.32±0.01比0.56±0.00;t=24.450,P<0.001和0.32±0.01比0.44±0.01;t=14.750,P<0.001)、Snail(0.46±0.01比0.76±0.02;t=29.640,P<0.001和0.46±0.01比0.86±0.00;t=70.700,P<0.001)、Slug(0.20±0.00比0.90±0.01;t=89.230,P<0.001和0.20±0.00比0.59±0.01;t=87.360,P<0.001)及转移标志物MMP2(0.19±0.00比0.56±0.01;t=84.540,P<0.001和0.19±0.00比0.46±0.01;t=67.120,P<0.001)、MMP9(0.14±0.00比0.59±0.04;t=19.010,P<0.001和0.14±0.00比40.41±0.04;t=10.890,P<0.001)蛋白表达水平均明显低于人参皂苷Rg3治疗组和DDP治疗组(图4A)。免疫荧光染色结果显示,与单药治疗组相比,联合治疗组上调E-cadherin的表达,下调Vimentin的表达(图4B)。

MMP:基质金属蛋白酶
人参皂苷Rg3联合DDP抑制Wnt/β-catenin信号通路的激活Western blot检测结果显示,人参皂苷Rg3和DDP联合治疗组的Wnt(0.40±0.02比0.87±0.01;t=35.480,P<0.001和0.40±0.02比0.59±0.01;t=14.670,P<0.001)、β-catenin(0.36±0.00比0.56±0.00;t=155.800,P<0.001和0.36±0.00比0.90±0.01;t=118.100,P<0.001)、C-myc(0.32±0.02比0.56±0.01;t=20.870,P<0.001和0.32±0.02比0.36±0.01;t=3.334,P=0.029)和Cyclin D1(0.85±0.05比1.04±0.04;t=5.007,P=0.008和0.85±0.05比1.12±0.02;t=8.347,P=0.001)蛋白表达水平均明显低于人参皂苷Rg3治疗组和DDP治疗组(图5)。

图5 Western blot检测人参皂苷Rg3与DDP单独或联合治疗对SGC-7901/DDP细胞中Wnt、β-连环蛋白、C-myc和细胞周期蛋白D1蛋白表达水平的影响
讨 论
胃癌是全球发病率及死亡率分别位居第5位和第4位的恶性肿瘤,手术治疗和放化疗是治疗胃癌的主要方法。对于没有淋巴结和远处转移且临床分期为T2以下的胃癌患者,新辅助化疗是首选的治疗策略。DDP是胃癌化疗中的基础药物,但胃癌治疗过程中产生的耐药性常导致治疗失败[12]。肿瘤细胞产生化疗药物耐药性的机制是药物在细胞内积累减少,药物靶部位的有效浓度降低。因此,迫切需要寻找可用于临床逆转耐药性的方法,以提高患者的临床收益。
人参具有抗炎、抗癌和抗血管生成等作用,人参皂苷Rg3是从人参中提取出来的主要活性成分之一[13]。研究表明,人参皂苷Rg3可增强5-氟尿嘧啶、奥沙利铂和紫杉醇等化疗药物在肿瘤治疗中的作用[14-16]。有文献报道人参皂苷Rg3通过下调程序性死亡配体-1表达、抑制增殖并促进凋亡,从而减弱肺癌DDP耐药[17]。本研究结果显示,人参皂苷Rg3通过抑制SGC-7901/DDP细胞增殖并促进凋亡,增强胃癌对DDP的敏感性。
转移是一个复杂的过程,涉及部分肿瘤细胞的间质转化、微环境的重塑和转移细胞的定植等一系列变化。研究表明,人参皂苷Rg3增强吉非替尼在肺癌细胞中的抗转移能力[18]。EMT是上皮细胞特征逐渐转化为间质细胞特征的一种胚胎学过程,被认为对体内局部侵袭和癌细胞扩散等过程至关重要[19]。研究发现,EMT与肿瘤转移和不良预后密切相关,长链非编码RNA H19和血管内皮生长因子C通过促进EMT进程介导癌症转移,是多种癌症转移的必要过程[20-21]。人参皂苷Rg3通过下调结肠癌细胞中的Notch-Hes1信号通路抑制EMT进程[22];通过阻断神经纤维网蛋白1介导的EMT进程从而抑制胃癌细胞增殖和迁移[23];通过阻断核因子κB介导的EMT进程从而增强肺癌细胞对DDP的敏感性[24]。因此,下调肿瘤细胞EMT进程的相关蛋白表达有助于抑制胃癌转移并增强胃癌对化疗药物的敏感性。本研究结果显示,人参皂苷Rg3与DDP联合治疗通过上调上皮标志物表达和下调间质标志物表达,从而抑制SGC-7901/DDP细胞迁移。
研究表明,人参皂苷Rg3通过阻断缺氧诱导因子1α/环氧合酶2/人血管内皮生长因子信号通路抑制结肠癌细胞增殖、转移及新生血管的形成[25];通过上调缺氧诱导因子1α靶向的miR-519a-5p抑制卵巢癌细胞的瓦博格效应[26];通过增加Rho GTPase激活蛋白9的表达抑制肝癌细胞迁移和侵袭[27]。这些提示人参皂苷Rg3可通过靶向不同的通路或基因调控癌症细胞的增殖、凋亡、迁移和EMT进程。Wnt/β-catenin信号通路的激活在肿瘤增殖、凋亡、迁移和耐药等过程中起着重要作用。研究表明,耐DDP的胃癌细胞株SGC-7901/DDP与Wnt/β-catenin信号通路密切相关[28]。人参皂苷Rg3通过阻断Wnt/β-catenin信号通路抑制胶质母细胞瘤和骨肉瘤的增殖、转移并促进细胞凋亡[29-30]。本研究结果显示,人参皂苷Rg3与DDP联合治疗显著抑制Wnt/β-catenin信号通路相关蛋白的表达,从而增强胃癌对DDP的敏感性。
综上,本研究结果表明,人参皂苷Rg3联合DDP可抑制SGC-7901/DDP细胞的增殖、迁移和EMT进程,并促进细胞凋亡。同时,人参皂苷Rg3联合DDP可阻断Wnt/β-catenin信号通路的相关蛋白表达水平,提示Wnt/β-catenin信号通路的激活在人参皂苷Rg3调控SGC-7901/DDP的耐药性中起重要作用,但具体作用机制亟待进一步研究。

