泡菜源植物乳杆菌HY41产细菌素性质及其基因簇挖掘
汪立平 ,贾 爽,张晓妍,周婉婷,张逸鑫
(1.上海海洋大学食品学院,上海 201306;2.农业部水产品贮藏保鲜质量安全风险评估实验室,上海 201306;3.上海海洋大学食品热加工工程技术研究中心,上海 201306)
影响食品质量关键因素之一是食品安全。细菌素是天然食品防腐剂之一,可满足消费者保健需求。乳酸菌可调节肠道菌群平衡、降低胆固醇和血压、提高人体免疫力和抵抗力[1],具有一定益生特性。此外,乳酸菌代谢产物如有机酸、酶、细菌素、乙醇、丁醇、去多糖和双乙酰也具有应用价值[2]。其中的细菌素,一般称为乳酸菌细菌素。近年来,学者研究乳酸菌细菌素特性[3],筛选拮抗特定指示菌产细菌素乳酸菌,纯化所产细菌素,探究细菌素抑菌机制,使用基因工程手段分析产细菌素基因。其中全基因组测序已成为调查食源性疾病重要工具[4],部分国家已将全基因组测序纳入国家食品控制系统。从基因层面分析菌株安全性,可有效判断菌株可否用于食品行业,保障菌株使用安全性。
尽管许多产细菌素乳酸菌应用潜力优秀,但乳酸链球菌素(NisaplinTM)仍然是唯一获得美国食品药品管理局批准的市售细菌素,其纯化成本较高,不利于产品扩大化生产[5]。有必要进一步筛选有应用价值的产细菌素乳酸菌,扩大乳酸菌细菌素市场多样性。
在前期研究中,从中国广西北海地区农家自制泡菜产品中筛选到一株产细菌素植物乳杆菌HY41,发现其具有广谱抑菌特性且在发酵植物基产品时具有抑制产品后酸化潜力。本研究进一步探究菌株潜在适用性和安全性,对菌株细菌素生产曲线、抑菌谱和不同环境稳定性进行评估,并分析菌株全基因组数据,深入分析细菌素基因编码产物。研究旨在为该菌株和菌株所产细菌素进一步在食品工业或其他行业上应用提供理论支持。
1 材料与方法
1.1 菌种及指示菌来源
植物乳杆菌HY41分离自中国广西北海地区农家自制泡菜。金黄色葡萄球菌(Staphylococcus aureusATCC 41002)、单核细胞增生李斯特菌(Listeria monocytogenesATCC 19116)、沙门氏菌(SalmonellaATCC 15611)、副溶血性弧菌(Vibrio parahaemolyticusATCC 33847)以及大肠杆菌(Escherichia coli,ATCC 25922)购自美国典型微生物菌种保藏中心(American type culture collection,ATCC)。腐生葡萄球菌(Staphylococcus saprophyticus)、蜡样芽胞杆菌(Bacillus cereus)、变异链球菌(Streptococcus mutans)、摩根氏菌(Morganella)、豚鼠气单胞菌(Aeromonas caviae)、嗜水气单胞菌(Aeromonas hydrophila)、柠檬酸杆菌(Citrobacter freundii)、腐败希瓦氏菌(Shewanella)、铜绿假单胞菌(Pseudomonas aeruginosa)、酿酒酵母(Saccharomyces cerevisiae)、汉逊德巴利酵母(Debaryomyces hansenii)以及近平滑假丝酵母(Candida albicans)均由上海海洋大学食品学院微生物实验室保藏。
1.2 培养基
MRS培养基:称取54 g MRS培养基于1 L蒸馏水中,固体培养基添加18 g·L-1琼脂,煮沸。121 ℃高压蒸汽灭菌20 min。
LB培养基:胰蛋白胨10 g·L-1、酵母粉5 g·L-1、氯化钠10 g·L-1,固体培养基加入10 g·L-1琼脂,煮沸。121 ℃高压蒸汽灭菌20 min。
YPD 培养基:酵母提取物10 g·L-1、蛋白胨20 g·L-1、葡萄糖20 g·L-1,固体培养基加入18 g·L-1琼脂,煮沸。121 ℃高压蒸汽灭菌20 min。
1.3 方法
1.3.1 植物乳杆菌HY41生长和储存条件
植物乳杆菌HY41 在MRS 培养基中37 ℃,150 r·min-1生长24 h,并保存在-20 ℃含有40%(V/V)甘油中,测定前传代培养2次。
1.3.2 琼脂扩散法测定抑菌圈直径
以单核细胞增生李斯特菌(Listeria monocytogenesATCC 19116)为指示菌,将单核细胞增生李斯特菌接种至LB 培养基中,37 ℃、150 r·min-1培养12 h后,制备成菌浓度为106CFU·mL-1指示菌悬液。将固体LB 培养基加热熔化,加入1%(V/V)指示菌悬液,混合均匀倾倒入培养皿中,待培养基凝固后,使用打孔器打下直径为6 mm 孔,将50 μL 无细胞发酵上清液加入到孔中,37 ℃培养12 h,观察是否出现抑菌圈,并测量抑菌圈直径(mm),每组试验均设置3个重复。
1.3.3 植物乳杆菌HY41生长曲线及细菌素生产曲线
参考Yi等方法略作修改[6]。将菌株接种到MRS培养液中培养,37 ℃孵育36 h,每2 h 检测一次OD600和pH。同时,8 000 r·min-1,4 ℃离心15 min,过0.22 μm滤膜,制备无细胞发酵上清液,作琼脂扩散试验。
1.3.4 植物乳杆菌HY41所产细菌素稳定性
1.3.4.1 温度稳定性
分别取等量无细胞发酵上清液于离心管中,置于-20、40、50、60、70、80、90、100 ℃水浴和121 ℃高压釜中加热10和30 min,然后立即用冰水浴冷却至室温,4 ℃保存细菌素作为对照[7],作琼脂扩散试验。
1.3.4.2 酸碱稳定性
取等量无细胞发酵上清液,用6 mol·L-1NaOH溶液和6 mol·L-1HCl 溶液调节无细胞发酵上清液pH,使样品pH 为2、3、4、5、6、7、8、9、10、11 和12,37 ℃水浴4 h 后,将各溶液pH 均调节至6[8],作琼脂扩散试验。
1.3.4.3 有机溶液稳定性
取等量无细胞发酵上清液于离心管中,分别与等体积丙酮、甲醇、乙醇、乙腈混合,对照组加入等体积无菌水,室温下作用4 h,作琼脂扩散试验。
1.3.4.4 紫外稳定性
将等量无细胞发酵上清液,置于离心管中,放于超净工作台内,用紫外灯照射10、20、30、40、50、60 min后,以未经紫外灯照射无细胞发酵上清液为对照,作琼脂扩散试验。
1.3.4.5 酶敏感性试验
将蛋白酶K、木瓜蛋白酶和碱性蛋白酶分别在最适pH条件下配置成4 mg·mL-1酶溶液。将其加入无细胞发酵上清液中,使其终浓度为2 mg·mL-1,37 ℃水浴4 h[8],作琼脂扩散试验。
1.3.5 植物乳杆菌HY41所产细菌素部分纯化
采用Westley等溶剂提取方法[9],将植物乳杆菌HY41 培养24 h,制备无细胞发酵上清液用于细菌素粗提。在分液漏斗中以体积比1∶1 混合无细胞发酵上清液和乙酸乙酯。剧烈摇晃10 min,静置分层。分离含有细菌素的有机层。通过旋转蒸发除去有机溶剂。将提取物溶解在0.020 mol·L-1PBS(pH 7.4)中,使之浓缩后体积为初始体积0.1 倍。0.22 μm滤膜过滤,4 ℃保存备用。
1.3.6 植物乳杆菌HY41抑菌谱
将部分纯化后细菌素用于抑菌谱测定。采用琼脂孔扩散法测定部分纯化后细菌素抑菌谱。指示菌株包括革兰氏阳性菌、革兰氏阴性菌和酵母菌。细菌类指示菌在LB 培养基中37 ℃培养12 h。酵母类指示菌在YPD 培养基中30 ℃培养16 h。
1.3.7 植物乳杆菌HY41所产细菌素分子质量测定
部分纯化后细菌素分子质量根据Schagger等描述方法进行Tricine-SDS-PAGE凝胶电泳[10]。
1.3.8 植物乳杆菌HY41全基因组测序及生物信息学分析
植物乳杆菌HY41 在MRS 培养基中37 ℃培养22 h,4 ℃、8 000 r·min-1离心15 min,除去上清液,得到菌体,而后由上海美吉生物进行第二代细菌基因组扫描图测序。
从Illumina 平台生成数据用于生物信息学分析。所有分析均使用上海美吉I-Sanger 云平台(www.i-sanger.com)。所得全基因组序列对比GO、COG、KEGG数据库进行功能注释,将得到序列比对VFDB毒力基因数据库和CARD抗生素抗性基因数据库,作毒力基因和抗生素抗性基因预测,使用Diamond 软件作比较,设置水平为E<10-5,序列一致性和序列覆盖率>80%[11]。植物乳杆菌HY41编码细菌素序列由BAGEL4(http://bagel4.molgenrug.nl/index.php)数据库进行挖掘。
对于BAGEL4 比对细菌素,由在线软件Prot-Param(https://web.expasy.org/protparam/)分 析 细 菌素基因编码产物理化性质,在线软件Conserved Domain(https://www.ncbi.nlm.nih.gov/Structure/lexington/lexington.cgi)分析其保守结构域,在线软件TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析跨膜螺旋信号,在线软件SOMPA(https://npsaprabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析其二级结构,在线软件SWISS-MODEL(https://swissmodel.expasy.org/)分析其三级结构。
2 结果与分析
2.1 植物乳杆菌HY41生长曲线及细菌素生产曲线
植物乳杆菌HY41 在5 h 进入对数期,在16~36 h 进入稳定期(见图1)。酸为一种初级代谢产物,随细菌总量增加而增加。因此,pH 在对数期迅速下降,但pH 3.6 时并未持续下降。因稳定期细菌总量未增加,故酸度未降低。生产细菌素乳酸菌在稳定期后发酵液pH小于4.0较为常见[12]。该菌株抑菌活性在10 h 时达到最大值,抑菌直径达到21.77 mm。随培养时间增加,菌株抑菌活性略下降。
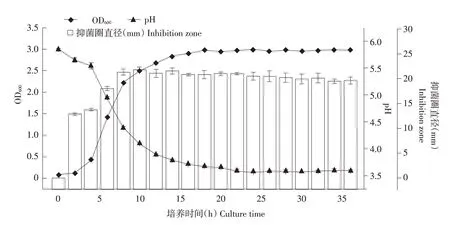
图1 植物乳杆菌HY41生长曲线、pH变化和抑菌圈直径Fig.1 Growth curve,pH variation and inhibitory zone diameter of L.plantarum HY41
2.2 植物乳杆菌HY41所产细菌素稳定性
2.2.1 温度稳定性
植物乳杆菌HY41产生细菌素温度稳定性如图2A 所示。在60 ℃、10 min 条件下,其活性保持在92.06%。当60 ℃作用时间增加至30 min 时,活性保持在91.04%。满足一般巴氏杀菌条件,可用于乳制品消杀。随温度升高,抑菌物质在100 ℃作用10 min 下仍保持83.17%活性,证明在短时高温作用下HY41 所产细菌素活性并未明显下降。在121 ℃作用30 min 下,细菌素活性保持在71.52%,表明其可承受高压蒸汽灭菌,对温度耐受性较强。因此,植物乳杆菌HY41产生细菌素可能属于一类耐热细菌素,可接受短期高温处理。这与植物乳杆菌R23[11]和植物乳杆菌PKLP5[13]产生细菌素特性相似。表明在加工过程中该细菌素可耐受巴氏杀菌和高压蒸汽灭菌,对进一步延长食品保质期具有重要作用。
2.2.2 酸碱稳定性
图2B 表示pH 对植物乳杆菌HY41 所产细菌素稳定性影响。以pH为5.0时所产生抑菌圈大小为对照。菌株HY41 所产细菌素对pH 具有较强耐受性,pH 在2.0~10.0 之内抑菌活性仍保持在90%以上,在pH达到11.0时,活性为81.62%。在极端酸性(pH 2.0)和极端碱性(pH 10.0)情况下仍保持93.95%和92.01%抑菌活性。说明菌株HY41所产细菌素酸碱稳定性良好,在极端环境下仍可发挥明显抑菌作用,有利于食品工业应用。
2.2.3 有机溶剂稳定性
图2C 表示有机溶剂对植物乳杆菌HY41 所产细菌素稳定性影响。与乙醇混合后,抑菌直径增加0.4 mm(P<0.05),其余抑菌直径无明显变化(P>0.05)。说明有机溶剂未降低植物乳杆菌HY41所产细菌素活性,可为后续蛋白质分离纯化试验提供前提。
2.2.4 紫外稳定性
图2D 表示辐照时间对植物乳杆菌HY41 所产细菌素稳定性影响。从图中可看出,随辐照时间增加,抑菌直径逐渐减小,60 min 时直径减小0.83 mm。说明紫外照射对活性物质有影响,但差异不显著(P>0.05)。
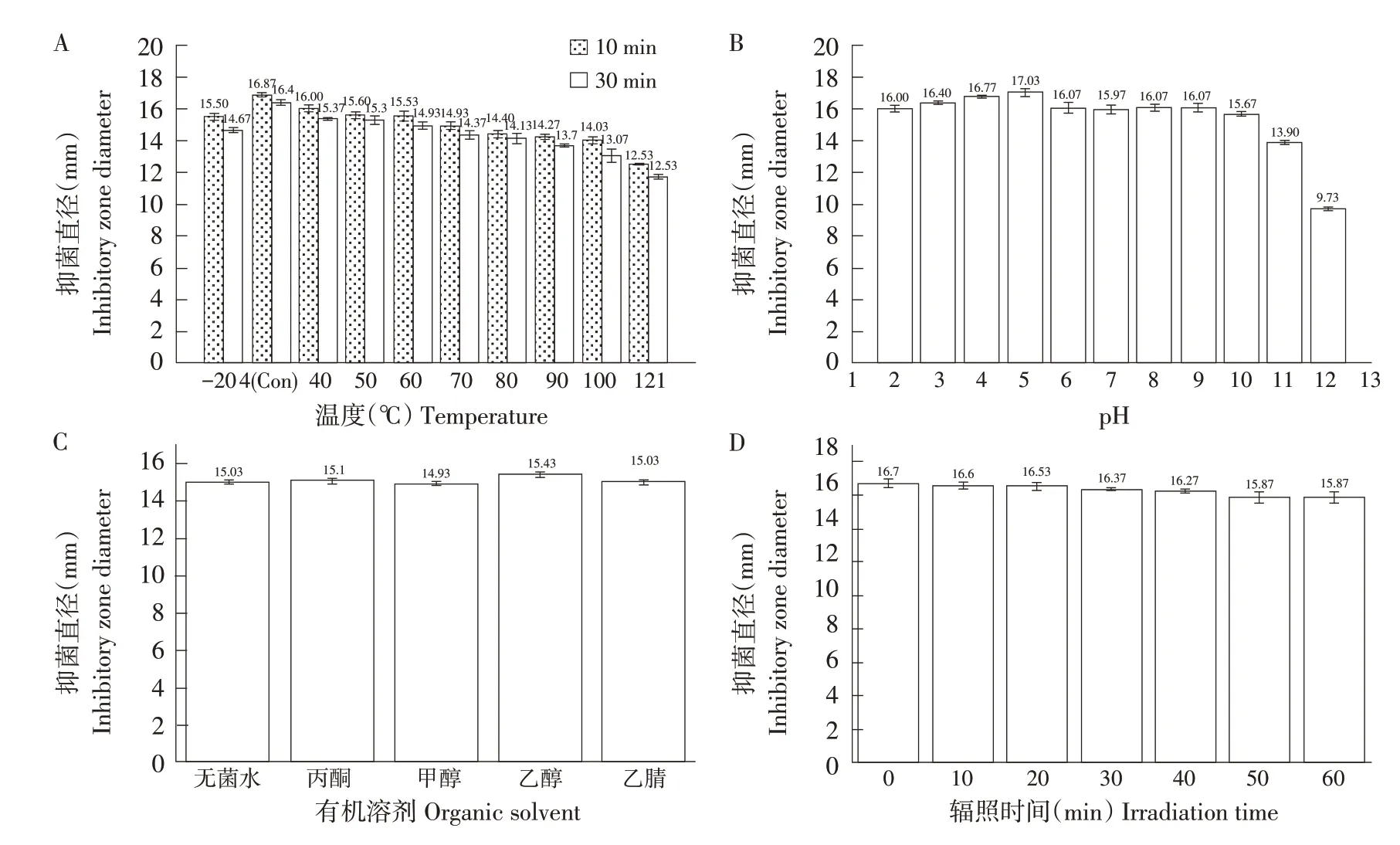
图2 植物乳杆菌HY41所产细菌素稳定性Fig.2 Stability of the bacteriocin produced by L.plantarum HY41
2.2.5 酶敏感性试验
植物乳杆菌HY41 所产细菌素在蛋白酶K、木瓜蛋白酶和碱性蛋白酶作用下,不显示抑菌活性。说明该活性物质可被蛋白酶水解,因此推断属于蛋白类物质。
2.3 植物乳杆菌HY41所产细菌素抑菌谱
从表1 中可知,植物乳杆菌HY41 所产细菌素具有广谱抑菌活性,包括革兰氏阳性菌、革兰氏阴性菌和酵母类真菌。植物乳杆菌HY41部分纯化细菌素对5 株革兰氏阳性菌中金黄色葡萄球菌(Staphylococcus aureus)、单核细胞增生李斯特菌(Listeria monocytogenes)及变异链球菌(Streptococcus mutans)抑菌直径分别达到27.00±0.20 mm、20.57±0.06 mm、25.00±0.26 mm;对8 株革兰氏阴性菌中副溶血性弧菌(Vibrio parahaemolyticus)、摩根氏菌(Morganella)和大肠杆菌(Escherichia coli)抑菌直径达到(21.03±0.15)mm、(24.40±0.78)mm、(18.93±0.23)mm。植物乳杆菌HY41部分纯化细菌素对革兰氏阳性细菌和革兰氏阴性细菌均有抑制作用,但对革兰氏阳性菌抑制作用更强。对汉逊德巴利酵母(Debaryomyces hansenii)和近平滑假丝酵母(Candida albicans)抑菌直径达到(21.47±0.42)mm、(19.97±0.06)mm,对酿酒酵母(Saccharomyces cerevisiae)无抑菌活性。综上可知,植物乳杆菌HY41具有广谱抑菌活性,对食品腐败菌和食源性病原菌有较强抑制作用,在食品生产中应用潜力巨大。
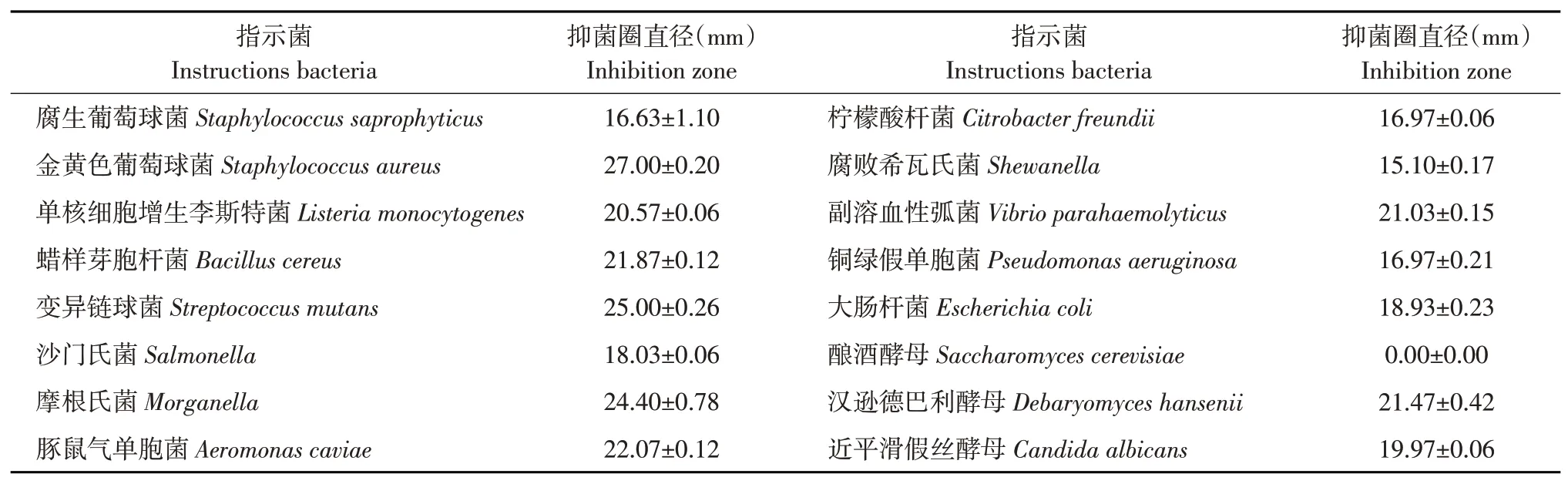
表1 植物乳杆菌HY41所产细菌素抑菌谱Table 1 Antimicrobial spectrum of the bacteriocin produced by L.plantarum HY41
2.4 植物乳杆菌HY41所产细菌素分子质量
通过Tricine-SDS-PAGE 凝胶电泳测定部分纯化后细菌素分子质量在3.3~5.8 ku。用考马斯亮蓝G 250染色时观察到一条蛋白质条带,当蛋白质条带被单核细胞增生李斯特菌覆盖时,在蛋白质条带位置出现抑菌现象,与超低分子质量Marker中活性细菌素标记位置一致,验证得到条带为抑菌条带。

图3 植物乳杆菌HY41所产生细菌素Tricine-SDS-PAGE电泳图Fig.3 Tricine-SDS-PAGE analysis and size determination of the bacteriocin produced by the L.plantarum HY41
2.5 植物乳杆菌HY41全基因组测序结果
2.5.1 植物乳杆菌HY41基因信息
分析植物乳杆菌HY41 全基因组测序结果发现,编码该菌株基因数量达到2 778,基因总长度达到2 473 086 bp,基因组平均GC 含量46.02%,具体统计结果见表2。

表2 植物乳杆菌HY41全基因组测序结果统计Table 2 Statistical table of whole genome sequencing results of L.plantarum HY41
2.5.2 COG功能注释
COG 注释结果见图4,共2 356 个基因获得COG 基因注释,占所有基因比例为84.81%,共分为19 个类型,其中占比较大有:转录(K: Transcription),218 个基因,占总比例7.85%;碳水化合物运输和代谢(G: Carbohydrate transport and metabolism),206 个基因,占总比例7.42%;氨基酸运输和代谢(E: Amino acid transport and metabolism),194个基因,占总比例6.98%。
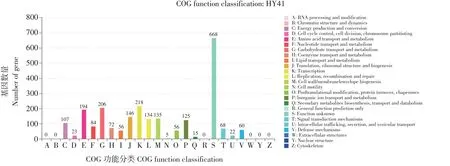
图4 植物乳杆菌HY41 COG功能分类Fig.4 COG functional classification of L.plantarum HY41
2.5.3 GO功能注释
使用blast2go软件比对gene ontology数据库,对植物乳杆菌HY41基因组进行GO功能注释。由图5可知,2 186 个基因进行GO 功能注释,占所有基因78.69%。GO 注释结果主要分为3 大亚类,在生物学过程(Biological process)中基因数量最多为转录(translation);在细胞组分(Cellular component)中基因数量最多为膜组成部分(integral component of membrane);在分子功能(Molecular function)中基因数量最多为ATP结合功能(ATP binding)。
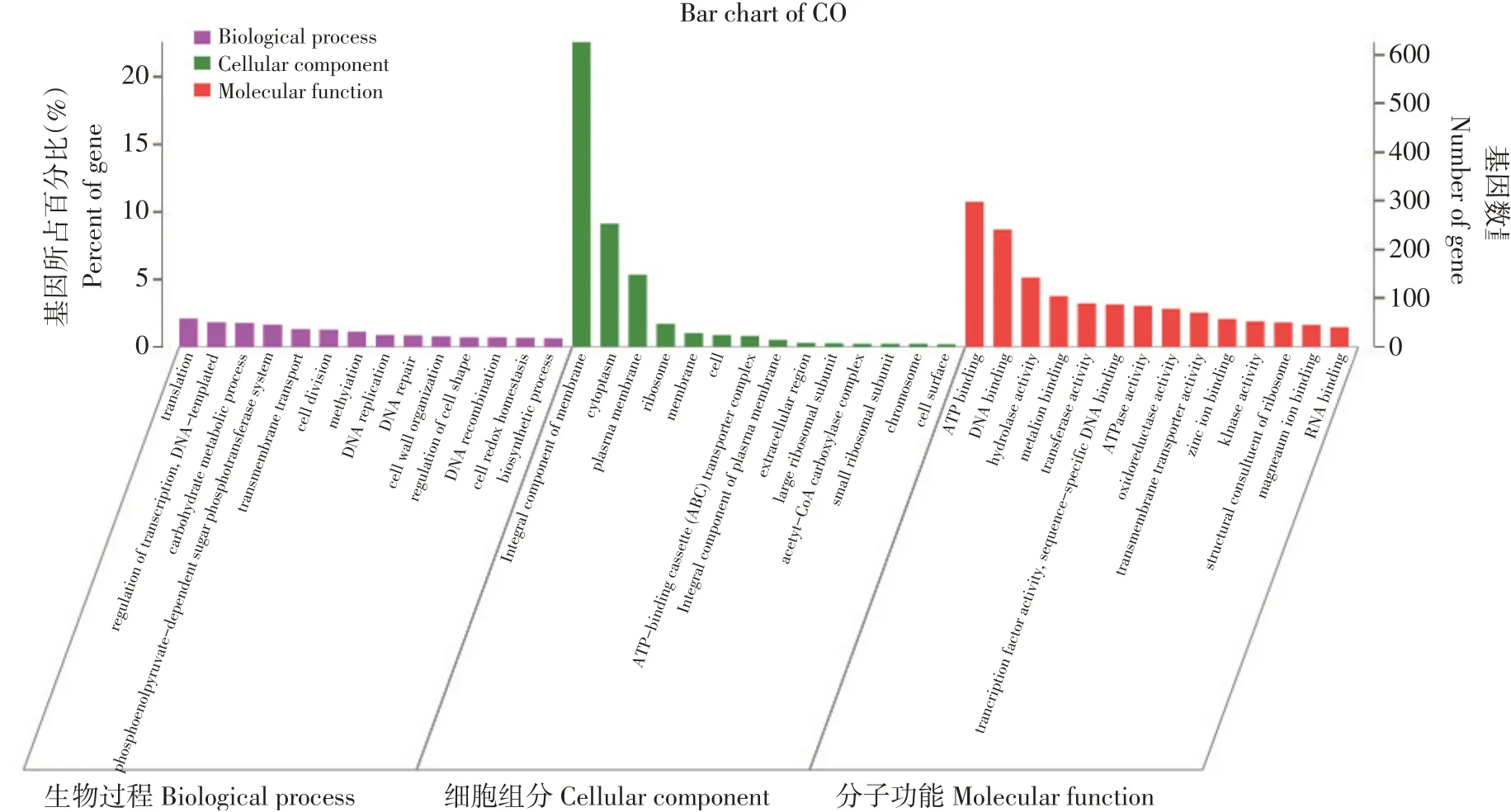
图5 植物乳杆菌HY41 GO功能分类Fig.5 GO functional classification of L.plantarum HY41
2.5.4 KEGG功能注释
对菌株HY41 进行KEGG 功能注释,共2 508个基因获得KEGG功能注释,将基因组分为六大代谢途径,新陈代谢(Metabolism,1 913个基因)、细胞过程(Cellular processes,70 个基因)、遗传信息处理(Genetic information processing,199 个基因)、人类疾病(Human diseases,86 个基因)、环境信息处理(Environmental information processing,200 个基因)、有机系统(Environmental information processing,40个基因)。
2.5.5 抗生素抗性基因和毒力基因检测
使用Diamond 软件将植物乳杆菌HY41 全基因组测序数据与抗生素抗性基因数据库(CARD)作比对,未发现抗生素抗性基因。同样在毒力基因数据库(VFDB)中进行比对,未发现毒力基因。Joana Barbosa 从芝麻菜中筛选出植物乳杆菌R23[11],通过全基因组测序鉴定也不含抗生素抗性基因和毒力基因,可认为是食品工业安全培养物,本试验与其研究结果一致。
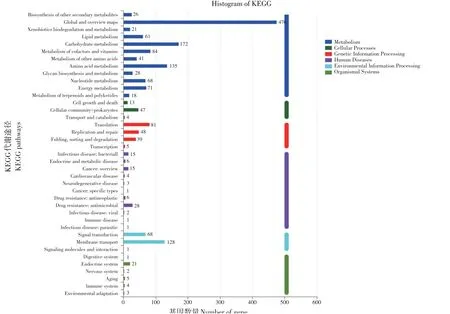
图6 植物乳杆菌HY41 KEGG功能分类Fig.6 KEGG functional classification of L.plantarum HY41
2.5.6 植物乳杆菌HY41细菌素基因簇挖掘
将全基因组测序结果用次级代谢产物基因簇数据库BAGEL4 进行比对。结果显示,植物乳杆菌HY41 基因组中存在2 个潜在热点区域(Areas of Interest,AOI)。在组装Scaffold 33.21上编码两种核心蛋白(见图7A),均属于II a 类细菌素且与Pediocin和Pediocin PA 序列重合度高达100%。在编码细菌素基因上游和下游,有两个开放阅读框(orf00004和orf00018)具有复制蛋白功能。在编码细菌素基因下游,开放阅读框orf00015 编码细菌素Pediocin PA 生物合成蛋白Ped C。lan T基因编码Pediocin PA的ATP结合蛋白Ped D。开放阅读框orf00029 编码重组酶Yoe C。在组装Scaffold 4.13上编码两种ABC转运蛋白(见图7B),含有ABC转运蛋白通常具有抑菌活性[14]。
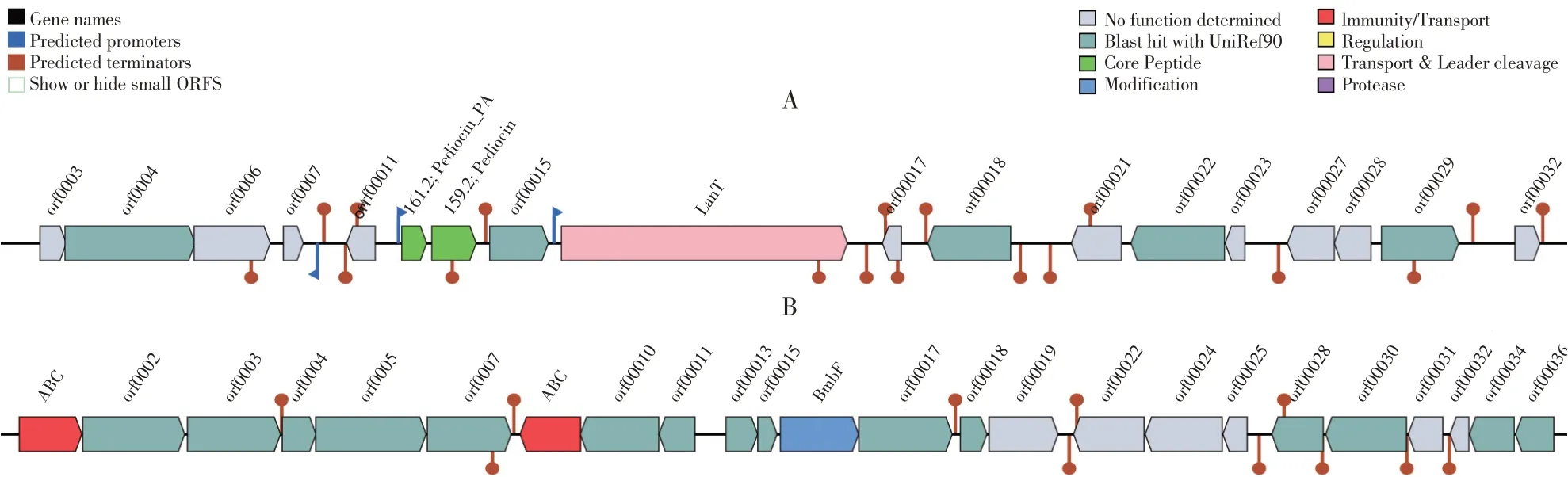
图7 植物乳杆菌HY41菌株细菌素基因簇图谱Fig.7 Genetic organization map of bacteriocin gene clusters of the L.plantarum HY41
2.6 植物乳杆菌HY41细菌素基因编码产物分析
2.6.1 理化性质分析
在线软件分析结果显示,植物乳杆菌HY41基因编码产物Pediocin PA 氨基酸残基数量为62 个,分子量为6 643.64 ku,理论等电点(PI)为9.02,分子式为C284H452N84O86S7,脂肪系数为55.16,亲水系数为-0.482,不稳定系数为19.72,说明蛋白质性质稳定。带负电氨基酸残基数(Asp+Glu)为4 个,带正电氨基酸残基数(Arg+Lys)为8个。
植物乳杆菌HY41 基因编码产物Pediocin 氨基酸残基数量为112个,分子量为12 993.71 ku,理论等电点为(PI)为6.97,分子式为C579H913N161O175S2,脂肪系数为82.77,亲水系数为-0.685,不稳定系数为36.73,说明蛋白质性质稳定。带负电氨基酸残基数(Asp+Glu)为13 个,带正电氨基酸残基数(Arg+Lys)为13个,其理论等电点(PI)接近于中性。
2.6.2 跨膜螺旋信号分析
由表3 及图8 可知,Pediocin PA 和Pediocin 不存在预测跨膜区数,跨膜螺旋中氨基酸残基数小于1,说明植物乳杆菌HY41 所产细菌素不存在相关跨膜结构,需借助其他转运蛋白运送至细胞基质外。Ped D 跨膜螺旋中氨基酸残基数为112.8162且存在5 个预测跨膜区数。由此推断Ped D 在细菌素转运中起重要作用,初步推断植物乳杆菌HY41所产细菌素由Ped D转运出细胞基质,发挥拮抗有害菌作用。Ped D具体作用机制还需进一步研究。
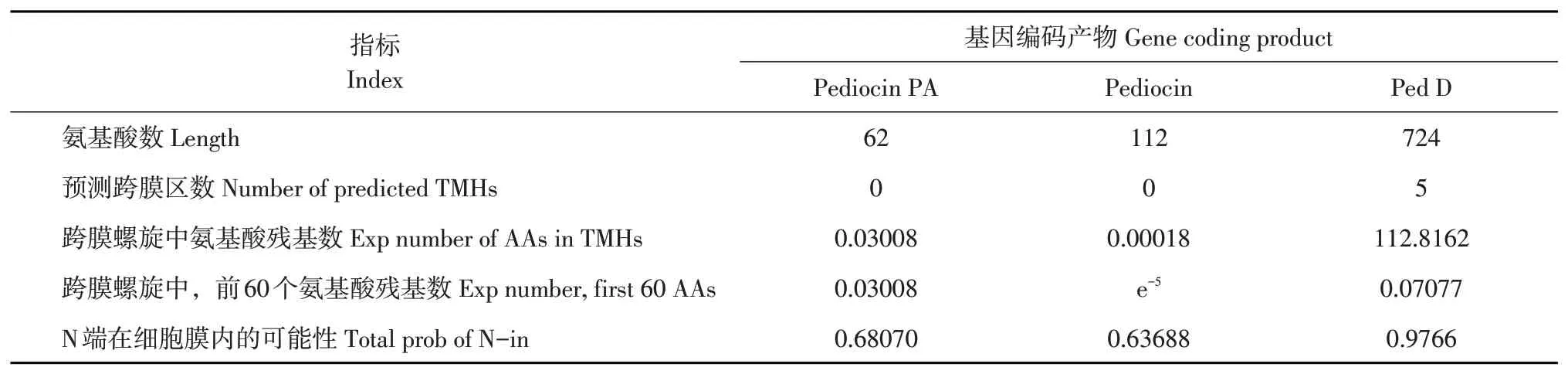
表3 植物乳杆菌HY41细菌素相关基因编码产物氨基酸跨膜螺旋数据Table 3 Analysis of amino acid trans-membrane helix of products encoded by bacteriocin genes in L.plantarum HY41
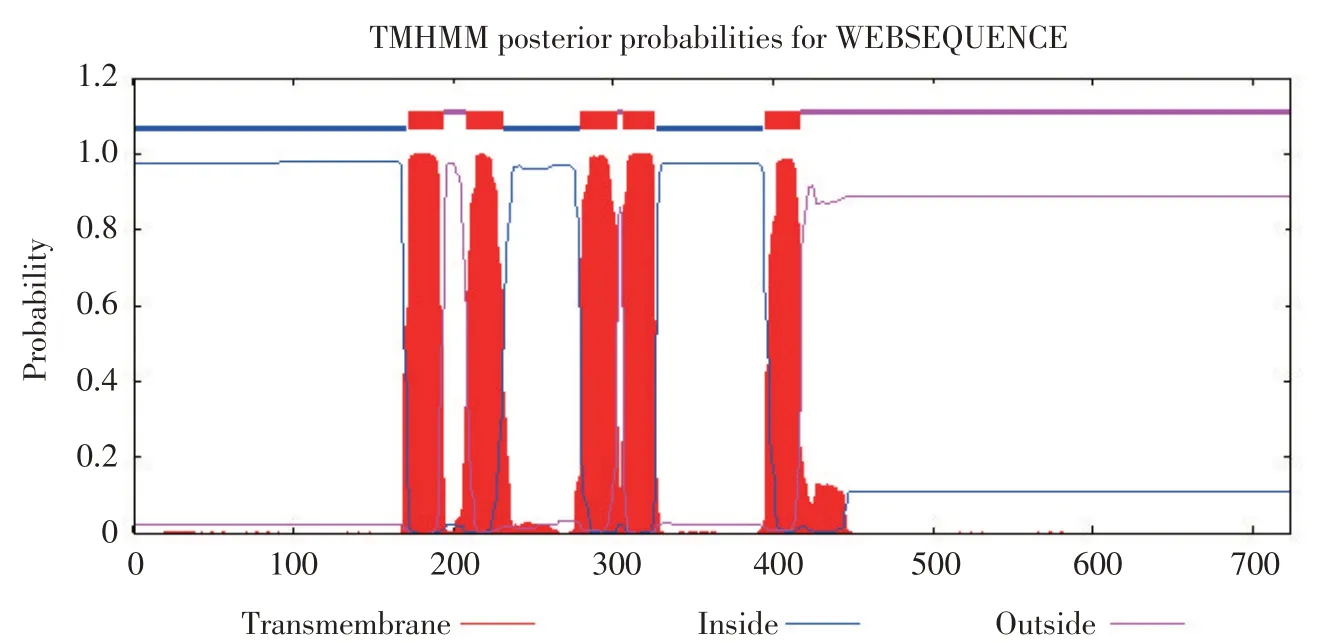
图8 lan T基因编码产物Ped D跨膜螺旋预测分析Fig.8 Prediction of the transmembrane helixes of lan T gene encoding product Ped D
2.6.3 保守结构域分析
通过Conserved Domain 数据库分析保守结构域,Pediocin PA保守结构域位于21~53个氨基酸之间,存在Ⅱ类细菌素超家族结构特征,可通过渗透细胞膜抑制靶细胞。Ped D 保守结构域位于13~722个氨基酸之间,属于ABC型细菌素转运体,氨基末端结构处理来自细菌素N末端前导肽,而C末端结构类似于ABC转运蛋白膜结构。Pediocin不存在保守结构域。
2.6.4 二级和三级结构分析
通过SOPMA 分析植物乳杆菌HY41 细菌素相关基因编码产物二级结构见表4,结果表明,Pediocin PA 和Pediocin 结构相似,均以α-螺旋为主,其次为无规则卷曲,最少为延伸链和β-转角。其中Pediocin 结构中α-螺旋与β-转角比例之和为67.85%,显著高于Pediocin PAα-螺旋与β-转角比例之和。在二级结构中α-螺旋和β-转角比例越高,说明该蛋白质稳定性越高,因此推断Pediocin相比Pediocin PA具有较好稳定性。
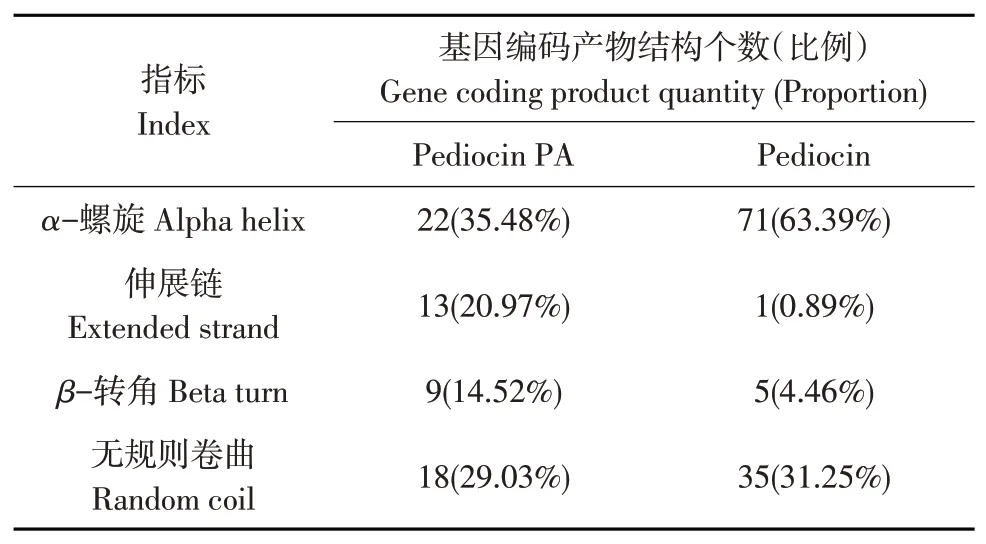
表4 植物乳杆菌HY41细菌素相关基因编码产物二级结构分析Table 4 Analysis of secondary structures of proteins encoded by the bacteriocin-related genes of L.plantarum HY41
通过Swiss Model分析植物乳杆菌HY41细菌素基因编码产物三级结构见图9,Pediocin PA 三级结构 与Bacteriocin pediocin PA- 1 M31L(SMTL ID:5ukz.1)同源性最高,两者序列相似度达到97.73%。Pediocin 三级结构与Ped B 晶体结构(SMTL ID:2ip6.1)同源性最高,两者序列相似度达100%,Ped B 晶体结构为一种类细菌素免疫蛋白结构基础。模型显示,植物乳杆菌HY41细菌素基因编码产物含有大量α-螺旋、无规则卷曲等二级结构,与二级结构预测结果相符,说明模型可信度较高。
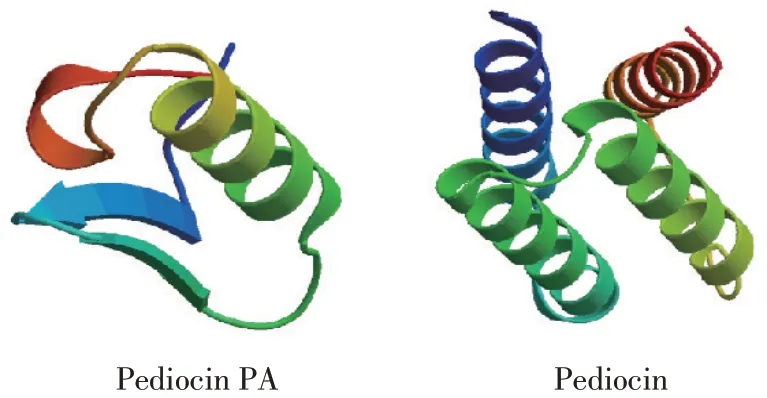
图9 植物乳杆菌HY41相关基因编码产物三级结构Fig.9 Tertiary structures of proteins encoded by the bacteriocin related genes of L.plantarum HY41
3 讨 论
植物乳杆菌HY41产生细菌素,抵抗食品腐败菌和病原微生物(金黄色葡萄球菌、沙门氏菌、副溶血性弧菌、单核细胞增生李斯特菌),具有广谱抑菌特性。本研究测定生长曲线发现,植物乳杆菌HY41 在10~16 h 时表现最大抑菌活性,此时处于对数期末期与稳定期前期之间,与Leroy 等研究结果一致[15]。植物乳杆菌HY41 细菌素产生于早期阶段,在达到稳定期前抑制病原体,植物乳杆菌HY41生长周期优势较大。
评估植物乳杆菌HY41 产生细菌素在酶、温度、pH、有机溶剂和紫外辐照下稳定性。植物乳杆菌HY41产生细菌素在pH>10时,易受影响。表明这种细菌素对碱性环境敏感。研究表明,碱性环境使细菌素结构遭到破坏,影响抑菌效果[16]。植物乳杆菌HY41 产生细菌素在121 ℃仍然观察到抑菌活性。一般乳酸菌细菌素在121 ℃作用下丧失抑菌活性[17],证实植物乳杆菌HY41 具有良好热稳定性。大多数有机溶剂测试细菌素活性不变,而与乙醇混合后抑菌活性略有增大,乙醇单独作用灭活部分指示菌,并未增加细菌素活性。紫外辐照对细菌素活性影响不显著,说明植物乳杆菌HY41所产细菌素紫外稳定性良好。在蛋白酶K、木瓜蛋白酶和碱性蛋白酶作用下,植物乳杆菌HY41不显示抑菌活性,证实其蛋白质性质,利于食品安全。因此该菌株在食品上应用潜力较大。
对植物乳杆菌HY41 开展全基因组测序后作COG 功能注释发现植物乳杆菌HY41 细胞存在15 个与次级代谢产物生物合成、转运和分解代谢(Q: Secondary metabolite biosynthesis, transport and catabolism)相关基因,占注释基因总比例0.64%。细菌素属于次级代谢产物,这15 个基因中存在与细菌素合成相关基因。植物乳杆菌WCFS1 已注释基因COG功能分类中最多三类与本研究不同[18],说明不同菌种有不同功能侧重,植物乳杆菌HY41侧重于转录、碳水化合物和氨基酸转运。在GO注释结果中,膜组成部分获得最多注释,共626 个基因,占所有基因比例22.53%,说明植物乳杆菌HY41有较强生物膜形成能力。发现22个ABC转运蛋白基因,占所有基因比例0.79%。ABC转运蛋白存在可实现物质与外界交换,将细菌素释放到细胞外部需借助ABC 转运蛋白。KEGG 功能注释发现,整体代谢(476个基因)、碳水化合物代谢(172个基因)和氨基酸代谢(135 个基因)在代谢通路中基因数量最多。膜运输(128 个基因)和信号转导(68 个基因)在环境信息处理过程中基因数量最多。说明该菌株整体代谢通路情况良好,碳水化合物代谢和氨基酸代谢较强,应对环境变化能力较强。
植物乳杆菌HY41全基因组测序结果表明该菌株基因组不包含任何抗生素抗性基因。然而,由于组装基因组不完全封闭,因此在细菌基因组未覆盖区域中可能存在抗生素抗性基因。抗生素抗性也可能是由一些与抗性有关蛋白质基因突变所引起[11]。毒力因子一般存在于基因组编码区域,在组装基因组中未检测到毒力因子,表明植物乳杆菌HY41无典型毒力因子,推断该菌株不产生毒性物质。以上特征表明植物乳杆菌HY41可被认为是用于食品工业的安全培养物,但仍需动物试验或临床试验验证。全基因组测序分析发现,该乳酸菌编码两种细菌素——Pediocin PA 和Pediocin。Pediocin PA 可由不同乳酸菌产生[19-20]。Pediocins 和Pediocin PA 均属于II 类细菌素,具有热稳定性,与温度稳定性测定结果相同。
通过Tricine-SDS-PAGE测定植物乳杆菌HY41所产细菌素分子质量。植物乳杆菌HY41所产细菌素分子质量低于5.8 ku。与全基因组测序获得结果不一致,推测在细菌素表达过程中,可能存在信号肽或不表达部分序列,因此测定分子质量小于预测分子质量,可进一步纯化该细菌素,测定分子质量。测定分子质量范围在II 类细菌素范围内(<10 ku),该分子质量仍有参考价值。
设计特定细菌素引物,PCR 扩增是检测菌株中细菌素基因簇是常用方法之一[21],但无法检测到新型细菌素和其他类型细菌素。对菌株测序分析全基因组,比对所有基因组序列,可找出所有产细菌素基因簇,但无法检测出新型细菌素。分析植物乳杆菌HY41细菌素基因编码产物发现,菌株HY41基因组中未出现典型植物乳杆菌素基因,但存在两种典型Ⅱ类片球菌细菌素基因簇。在线分析两种细菌素基因编码产物理化性质,结果表明,两种细菌素均属于稳定亲水性蛋白质,与二级结构中出现大量α-螺旋有关。两种细菌素均不存在跨膜螺旋结构,需借助其他转运蛋白释放到细胞外,发挥生物学功能。分析两种细菌素保守结构域发现Pediocin PA 存在保守结构域,保守结构域编码蛋白质仍有抑制单增李斯特菌作用的片球菌素。保守结构域作为发挥主要生物功能的蛋白功能单元具有重要作用不能被改变。两种细菌素三级结构中Pediocin PA 结构与Bacteriocin pediocin PA-1 M31L 最为相近,Bacteriocin pediocin PA-1 M31L 是一种片球菌素[22],具有抗氧化作用,推测两者生理功能相同或相似。Pediocin三级结构与Ped B 晶体结构相似,即一种类片球菌素免疫蛋白[23],推测Pediocin 具有保护自身免受细菌素降解功能。两种细菌素具体功能特性还需进一步研究。
4 结 论
植物乳杆菌HY41所产细菌素在热、酸碱、紫外和有机溶剂作用下具有稳定性,可抑制单核细胞增李斯特菌等病原菌和其他食品腐败菌,全基因组测序分析,植物乳杆菌HY41不含毒力因子和抗生素抗性因子,此外,植物乳杆菌HY41基因组中存在两种典型II类细菌素Pediocin PA 和Pediocin基因。植物乳杆菌HY41所产细菌素对食源性病原菌抗菌活性和作用机制,有待进一步探究。

