腹泻仔猪肠道大肠杆菌分离鉴定与毒力基因及耐药性分析
刘 琳 ,郭晓银 ,何彦侠 ,张 阳 ,吴保庆 ,于文会,田 浪 *
(1.广东海大集团股份有限公司畜牧水产研究中心,广州 511400;2.农业农村部微生态资源养殖利用重点实验室,广州 511400;3.东北农业大学动物医学学院,哈尔滨 150030)
仔猪腹泻是养猪行业的常见疾病,其导致的高死亡率影响养猪业健康持续发展,严重损害养殖户收益。仔猪腹泻由多种病原感染引起,如流行性腹泻病毒、传染性胃肠炎病毒、轮状病毒、大肠杆菌、沙门氏菌、球虫等,其中大肠杆菌被认为是最重要致病原之一[1]。大肠杆菌作为机体肠道中常见致病菌群,一旦宿主免疫力下降或致病性大肠杆菌侵入肠道外组织或器官,则引起胃肠炎、腹泻,故又被称为致泻性大肠杆菌[2]。仔猪大肠杆菌病主要引起仔猪黄痢、仔猪白痢和水肿病[3]。根据大肠杆菌流行病学、致病机制、临床症状等特征,将其分为5 种类型:肠出血型大肠杆菌(EHEC)、产志贺毒素型大肠杆菌(STEC)、肠侵袭型大肠杆菌(EIEC)、产肠毒素型大肠杆菌(ETEC)和肠致病性大肠杆菌(EPEC)[4]。新生仔猪大肠杆菌性腹泻主要是由ETEC 感染引起的传染性疾病,ETEC 通过携带的菌毛黏附素识别并结合肠黏膜上皮细胞受体,实现菌株在肠道中定植,产生肠毒素并分泌至胞外影响肠上皮细胞功能,引发水和电解质流入肠腔,导致腹泻[5]。ETEC 分泌的肠毒素主要分为耐热肠毒素(STa 和STb)和不耐热肠毒素(LT),携带的黏附素通常为F4(K88)、F5(K99)、F6(987P)、F18ac、F41,其他黏附素(F165、F42、F17)则较为少见[6]。此外,志贺毒素Stx2e作为STEC感染引起仔猪水肿病的重要致病因子,也可导致腹泻[7]。
Lu 等报道猪源大肠杆菌流行病学调查发现大肠杆菌分离株主要携带STa、STb、STx 3种毒力基因,而国内整体调查情况发现大肠杆菌分离株毒力基因携带率远高于国外地区,主要以STa、STb、K88、K99 为主要毒力基因且存在地区差异性,这些毒力因子表达是导致临床仔猪腹泻主要原因[8-9]。抗生素是治疗大肠杆菌病主要方法,随集约化、规模化养殖模式不断发展,全球抗生素滥用现象十分普遍,世界各地均有耐药性猪源大肠杆菌相关报道。我国不同地区猪源耐药大肠杆菌相关报道表明,临床大肠杆菌分离株对四环素、氨苄西林、磺胺异恶唑等常用抗生素普遍耐药,多达20 种抗菌药物,细菌耐药性已成为严重的公共卫生问题[10-11]。2020 年9 月,调查发现广东省西部(粤西)地区部分猪场发生新生仔猪腹泻,表现为整窝发病,病猪排黄色、黄白色或白色稀粪,死亡率达8%~15%,初步判断为大肠杆菌导致。为进一步了解粤西地区部分猪场内腹泻仔猪肠道中大肠杆菌流行和耐药情况,本研究对2021年9 月~11 月期间采集于粤西地区部分规模化养猪场腹泻仔猪直肠拭子进行大肠杆菌分离鉴定、生化鉴定、常规毒力基因检测及耐药谱分析,以揭示致仔猪腹泻大肠杆菌特性和耐药性发展,为当地大肠杆菌病防控策略制定提供数据支持。
1 材料与方法
1.1 材料
1.1.1 样品来源
114 份样本采集自粤西地区5 个市区(肇庆市、云浮市、阳江市、茂名市、湛江市)内11个自繁自养规模化养猪场中腹泻仔猪,样本详细信息见表1。
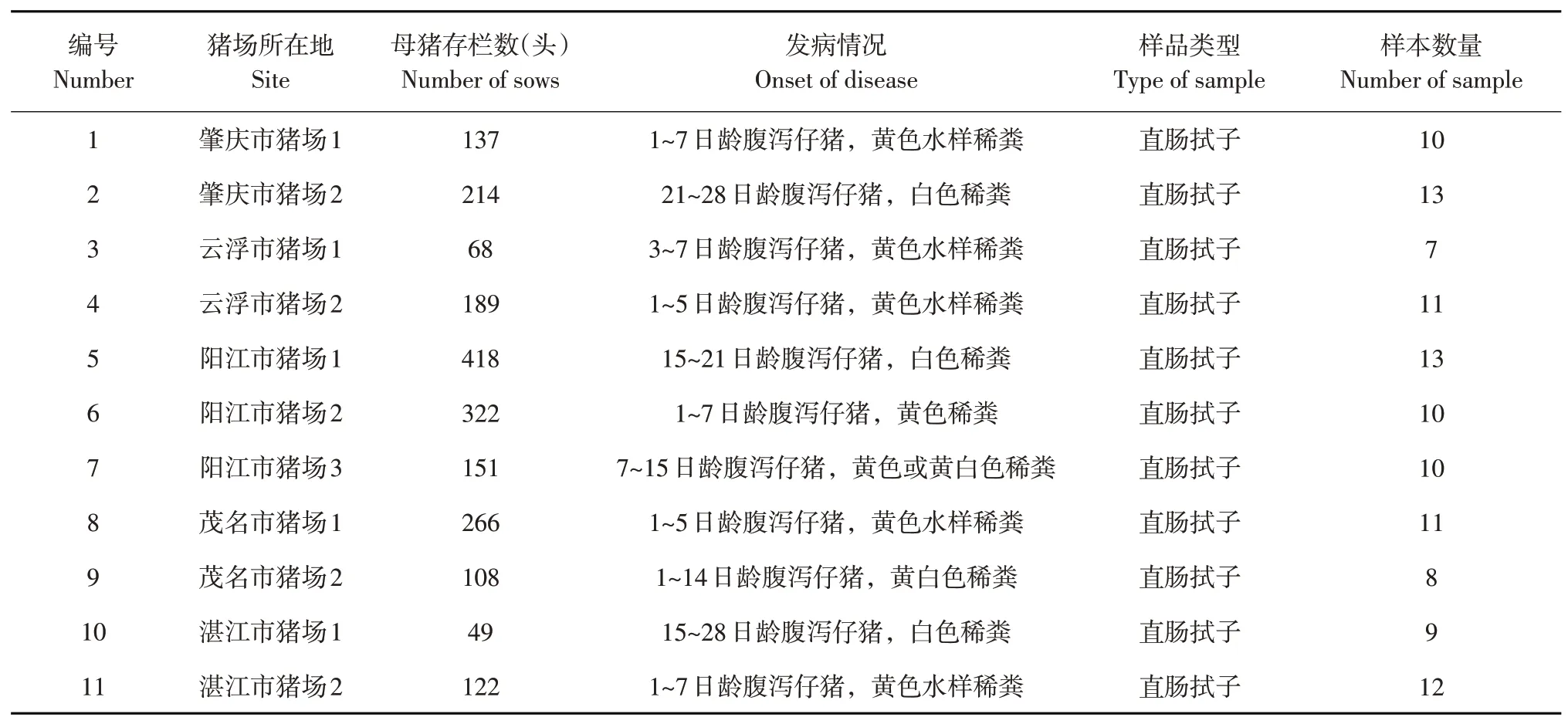
表1 样本信息Table 1 Information of samples
1.1.2 参考菌株
大肠杆菌标准质控菌株ATCC 25922 由东北农业大学中兽医教研室保存。
1.1.3 主要试剂
LB肉汤培养基、LB琼脂培养基、麦康凯培养基、伊红美蓝培养基、技术琼脂粉、革兰氏染色液试剂盒(均购自广东环凯微生物科技有限公司);大肠杆菌生化鉴定试剂盒(购自青岛海博技术有限公司);琼脂糖、核酸DL2000 DNA Marker、T3 Super PCR Mix(均购自北京擎科生物科技有限公司);核酸染料GoldView(购自天津阿尔法生物科技有限公司);50×TAE核酸电泳缓冲液(购自上海麦克林生化科技有限公司);药敏纸片庆大霉素(GEN)、氨苄西林(AMP)、多黏菌素B(PB)、四环素(TET)、环丙沙星(CIP)、左氧氟沙星(LVX)、新霉素(NEO)、磺胺甲基异恶唑(SMZ)、头孢噻呋(CTF)(均购自杭州微生物试剂有限公司)。
1.1.4 主要仪器
超净工作台(型号为SW-CJ-2FD);PCR仪(型号为T100 Thermal Cycler);生化培养箱(型号为LRH-70);电子天平(型号为FA2204N);核酸电泳仪(型号为DYCP-31DN);凝胶成像系统(型号为ChemiScope6100);振荡培养箱(型号为HZ-2410KB);恒温金属浴(型号为DKT200-2);高速离心机(型号为TG18.5)。
1.2 方法
1.2.1 细菌分离鉴定
将腹泻仔猪直肠拭子放入LB 肉汤培养基中,37 ℃、200 r·min-1摇床培养4 h,接种环蘸取培养基划线接种于麦康凯培养基,37 ℃恒温培养箱过夜培养。次日接种环挑取粉色单个菌落继续接种于伊红美蓝培养基,37 ℃恒温培养箱过夜培养,随后挑取表面有金属光泽菌落于LB 肉汤中扩大培养,最后置于30%甘油肉汤培养基中保存。
1.2.2 革兰氏染色与生化鉴定
按照革兰氏染色试剂盒说明书,分别对上述保存菌株进行革兰氏染色镜检,观察细菌形态特征。对符合大肠杆菌形态特征菌株进行大肠杆菌生化特性鉴定,鉴定试验按照生化鉴定试剂盒说明书操作。
1.2.3 大肠杆菌及其毒力基因检测
1.2.3 .1引物设计与合成
通过Clonemanager软件并参考相关文献设计本研究所用引物,由生工生物工程(上海)股份有限公司合成,引物信息见表2,引物最终使用浓度为10 μmol·L-1,稀释后于-20 ℃保存备用。

表2 引物序列列表Table 2 The list of primer sequences
1.2.3 .2 PCR扩增
将上述分离得到的大肠杆菌划线接种于LB 琼脂培养基,37 ℃恒温培养箱过夜培养,次日挑取单菌落至LB液体培养基中,37 ℃摇床培养5 h,取1 mL 大肠杆菌悬液,12 000 r·min-1离心5 min,吸弃上清,加入100 μL 无菌水重悬,100 ℃煮沸15 min,随后立即12 000 r·min-1离心5 min,吸取上清,即为DNA模板,于-20 ℃保存备用。PCR扩增体系(总体积25 μL):上、下游引物各1 μL,T3 Super PCR Mix 22 μL,DNA模板1 μL。PCR扩增程序:98 ℃预变性2 min;98 ℃变性10 s,遵循引物Tm值退火15 s,72 ℃延伸15 s,共35个循环;72 ℃再延伸2 min。取10 μL扩增产物于1%琼脂糖凝胶电泳检测,观察结果。对单一明亮特异性条带进行胶回收和测序分析,随后GenBank比对分析。
1.2.4 大肠杆菌抗生素药敏试验
药敏试验严格按照临床实验室标准化委员会(Clinical and laboratory standards institute,CLSI)规定,采用常规Kirby-Bauer 药敏纸片扩散法检测大肠杆菌对9种抗生素的敏感性[13]。药敏试验以大肠杆菌ATCC 25922 作为质控菌,对此次腹泻仔猪肠道分离得到的大肠杆菌进行药敏试验,使用游标卡尺测量抗生素抑菌圈直径,根据直径大小判断分离菌株耐药性,将大肠杆菌分为敏感(S)、中敏(I)和耐药(R)。如果大肠杆菌对3种及以上抗生素耐药,则判定为多重耐药菌株。
2 结果与分析
2.1 病原菌分离培养及特征观察
试验结果显示114份临床腹泻仔猪直肠拭子经扩菌培养后均在麦康凯培养基中呈现典型粉色、光滑、湿润、圆形隆起、边缘齐整的菌落,结果见图1A。挑取该菌落划线接种于伊红美蓝培养基后呈现隆起、光滑、边缘整齐并带有金属光泽的典型菌落,结果见图1B,符合大肠杆菌鉴别特征。
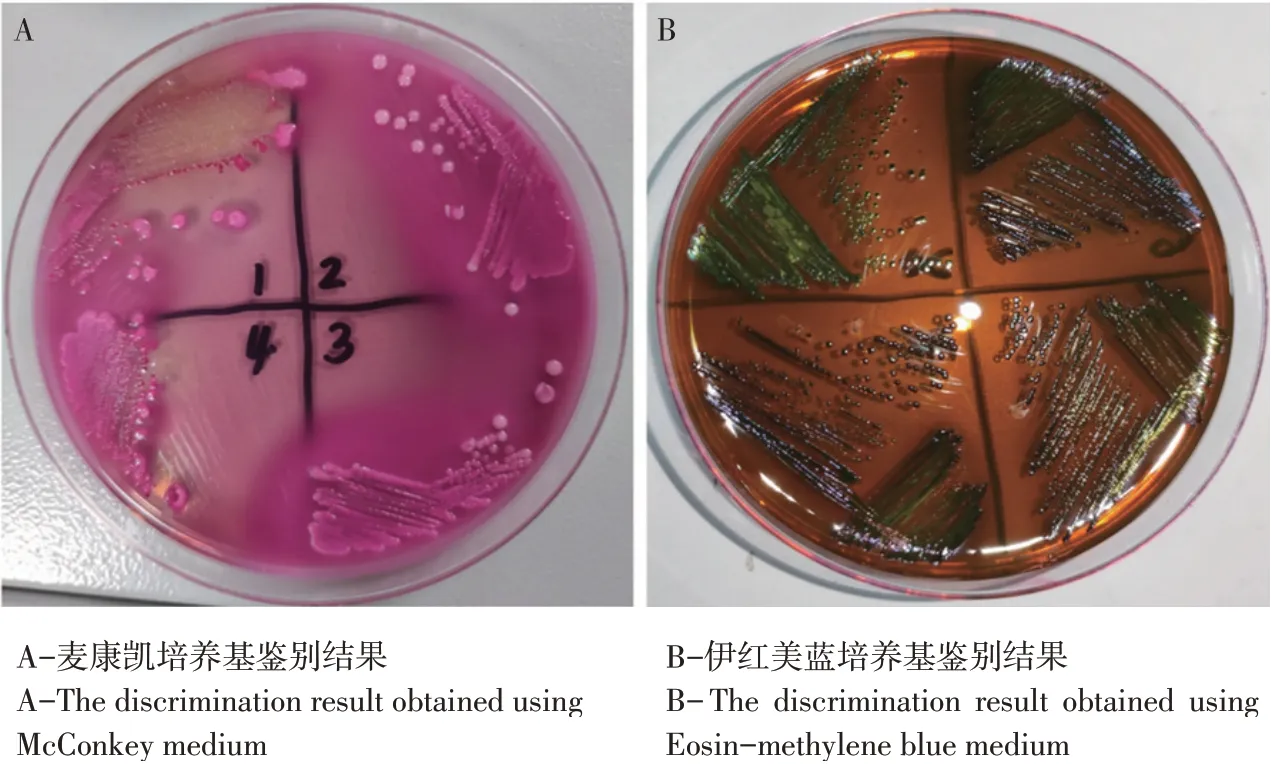
图1 分离菌株鉴别培养基鉴定结果Fig.1 Identification results of isolated strains using differential medium
2.2 分离菌株革兰氏染色及生化鉴定
分别对上述114份分离菌株以及质控菌株进行革兰氏染色镜检,结果见图2A,所有菌株均呈现革兰氏染色阴性、中等大小杆状、两短钝圆的杆菌特征。生化鉴定试验显示所有临床分离菌株均与质控菌具有相同生化特性,即靛基质试验阳性、M-R 试验阳性、V-P 试验阴性以及柠檬酸盐试验阴性(见图2B和表3),参考GB489.38-2012标准[14],全部符合典型大肠杆菌生化特性,故大肠杆菌分离率达到100%。

表3 生化鉴定统计结果Table 3 Statistical results of biochemical characterization

图2 大肠杆菌革兰氏染色及生化鉴定结果Fig.2 Results of Gram staining and biochemical characterization of E.coli
2.3 大肠杆菌及其毒力基因PCR鉴定
分别用大肠杆菌特异性引物和毒力基因引物对分离的114株大肠杆菌进行PCR扩增,结果见图3,除987P之外,其余引物均可扩增出单一明亮特异性条带,经对特异性条带进行胶回收、测序分析、GenBank 比对分析,显示相似度均超过99%,故PCR产物被确定为目标大肠杆菌毒力基因片段。在大肠杆菌特异性基因鉴定中,包含质控菌在内的115株大肠杆菌均呈现阳性结果。毒力基因检测结果见图4,毒力基因STa 和STb 检出率最高,分别为71.93%(82/114)和61.40%(70/114),其次是LT(11.40%,13/114);黏附素K99,F41,F18ac,K88 检出率分别为7.02%(8/114),6.14%(7/114),5.26%(6/114),0.88%(1/114),而黏附素987P未在分离菌株中检出;另外少量Stx2e在分离菌株中检出,检出率为3.51%(4/114)。
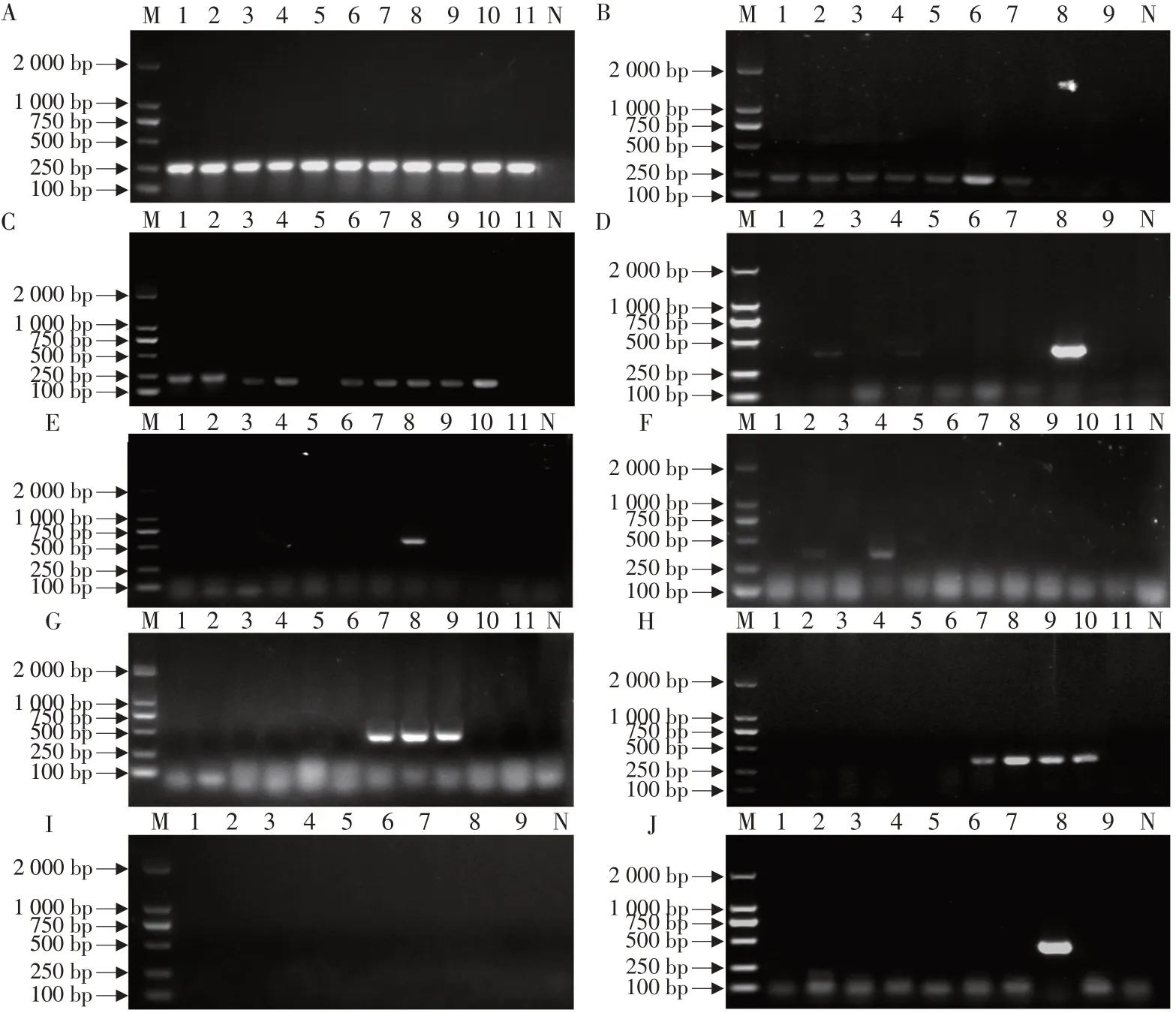
图3 毒力基因PCR扩增结果Fig.3 Amplification results of virulence genes by PCR
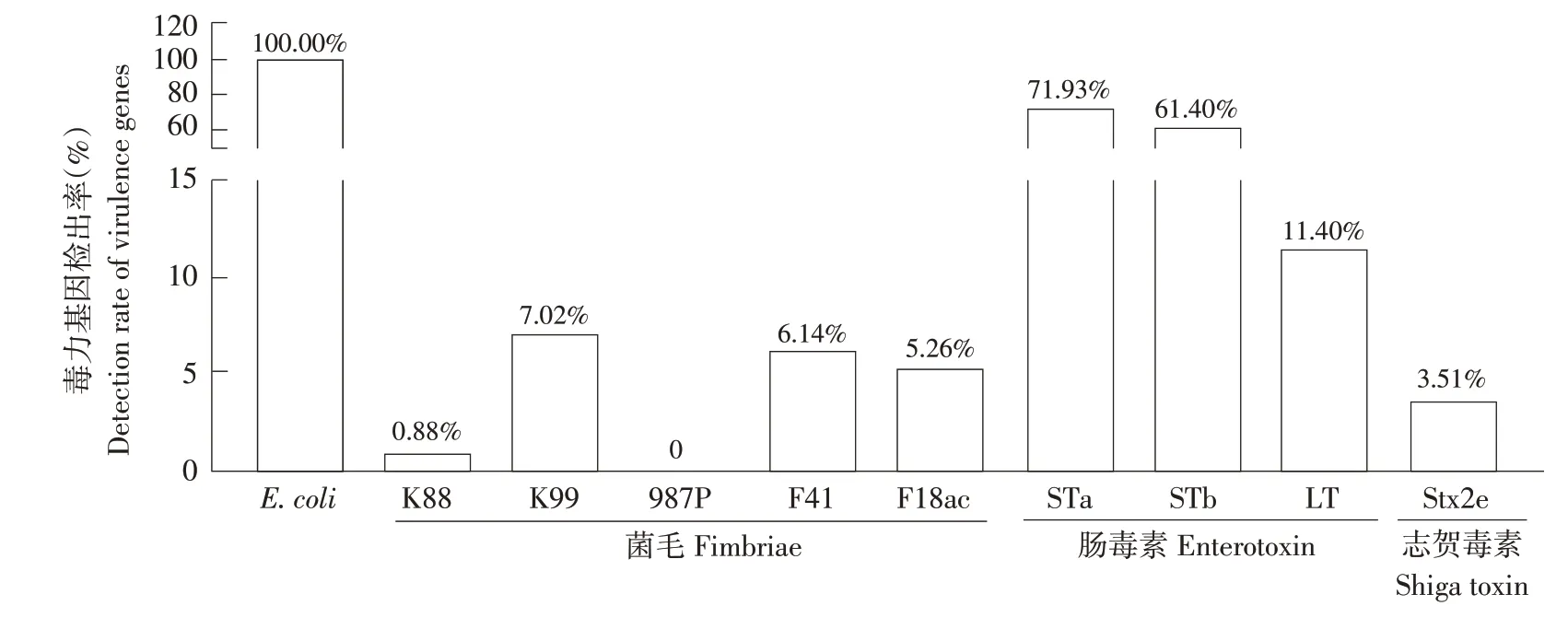
图4 大肠杆菌及其毒力基因检测结果Fig.4 Detection results of E.coli and its virulence genes
大肠杆菌毒素类型分析见表4,共有103 株大肠杆菌被检测出上述毒力基因,检出率为90.35%(103/114)。毒力基因PCR 结果显示肠道分离大肠杆菌主要为ETEC,检出率为86.84%(99/114),也有少量STEC,检出率为3.51%(4/114)。ETEC 中毒力基因组合方式较多,单独含有STa、STb、LT、F41 毒力基因分别有17、14、1、1 株;同时含有两种毒力基因的组合STa+STb+、STa+LT+、STa+F18ac+、STa+F41+、STb+K99+分别有42、5、1、2、1 株;同时含有3 种毒力基因的组合STa+STb+F41+、STa+STb+K88+、STa+STb+LT+、STa+STb+K99+,STa+LT+K99+、STa+F41+F18ac+分别有3、1、4、3、1、1 株;同时含有STa、STb、LT 和F18ac 4 种毒力基因的菌株有1 株;同时含有STa、STb、LT、K99 和F18ac 5 种毒力基因菌株有1 株。STEC 中单独含有毒力基因Stx2e 的菌株有2 株,同时含有Stx2e、K99和F18ac 3种毒力基因菌株有2株。

表4 114株临床分离仔猪大肠杆菌毒力基因检测结果Table 4 Detection results of virulence genes of 114 clinical E.coli isolated from piglets
2.4 腹泻仔猪肠道分离大肠杆菌对9 种抗生素耐药情况
分别对分离的114 株大肠杆菌进行药敏试验,结果见表5,大肠杆菌对磺胺异噁唑,氨苄西林,四环素高度耐药,耐药率分别为100%(114/114),97.37%(111/114),96.49%(110/114)。对其余抗生素的耐药率从高到低依次为新霉素48.25%(55/114),左氧氟沙星43.86%(50/114),多黏菌素B 42.98%(49/114),庆大霉素42.11%(48/114),环丙沙星39.47%(45/114),头孢噻呋24.56%(28/114)。大肠杆菌对环丙沙星、多黏菌素B以及头孢噻呋3种药物相对敏感,处于中度敏感状态,即环丙沙星中度敏感率为39.47%(45/114),头孢噻呋为46.49%(53/114),多黏菌素B为57.02%(65/114),细菌耐药性呈增强趋势。

表5 抗生素药敏试验结果Table 5 Results of antibiotic susceptibility testing
2.5 大肠杆菌多重耐药谱分析
114 株分离大肠杆菌多重耐药谱分析结果见表6 和图5,其中仅有1 株分离株耐2 种药物(氨苄西林和磺胺甲基异恶唑),占比0.88%。大部分菌株呈现多重耐药,耐3~9 种药物的菌株占比为99.12%(113/114),其中有19 株对3 种抗生素耐药(占比16.67%);27 株对4 种抗生素耐药(占比23.68%);20 株对5 种抗生素耐药(占比17.54%);8株对6种抗生素耐药(占比7.02%);20株对7种抗生素耐药(占比17.54%);16 株对8 种抗生素耐药(占比14.04%);3 株对全部9 种抗生素耐药(占比2.63%)。
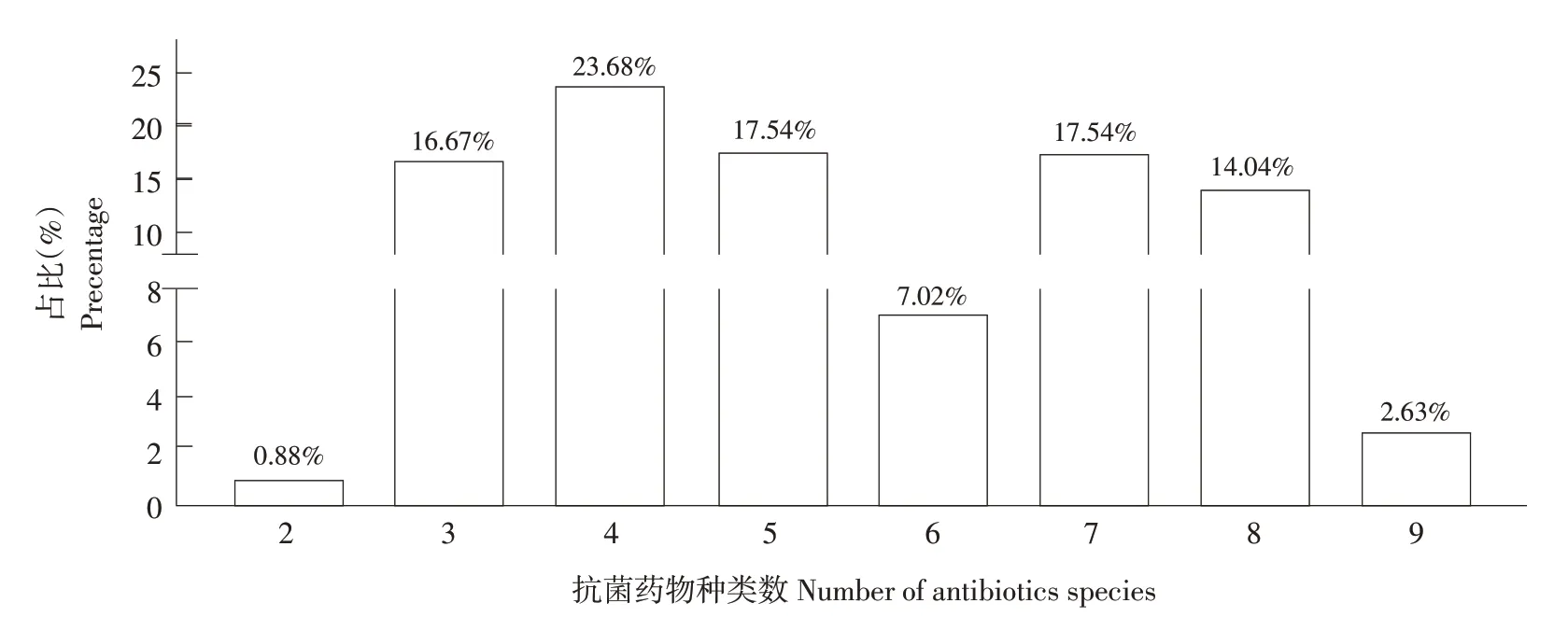
图5 大肠杆菌分离株多重耐药性分析结果Fig.5 Results of multiple drug resistance analysis of E.coli isolates
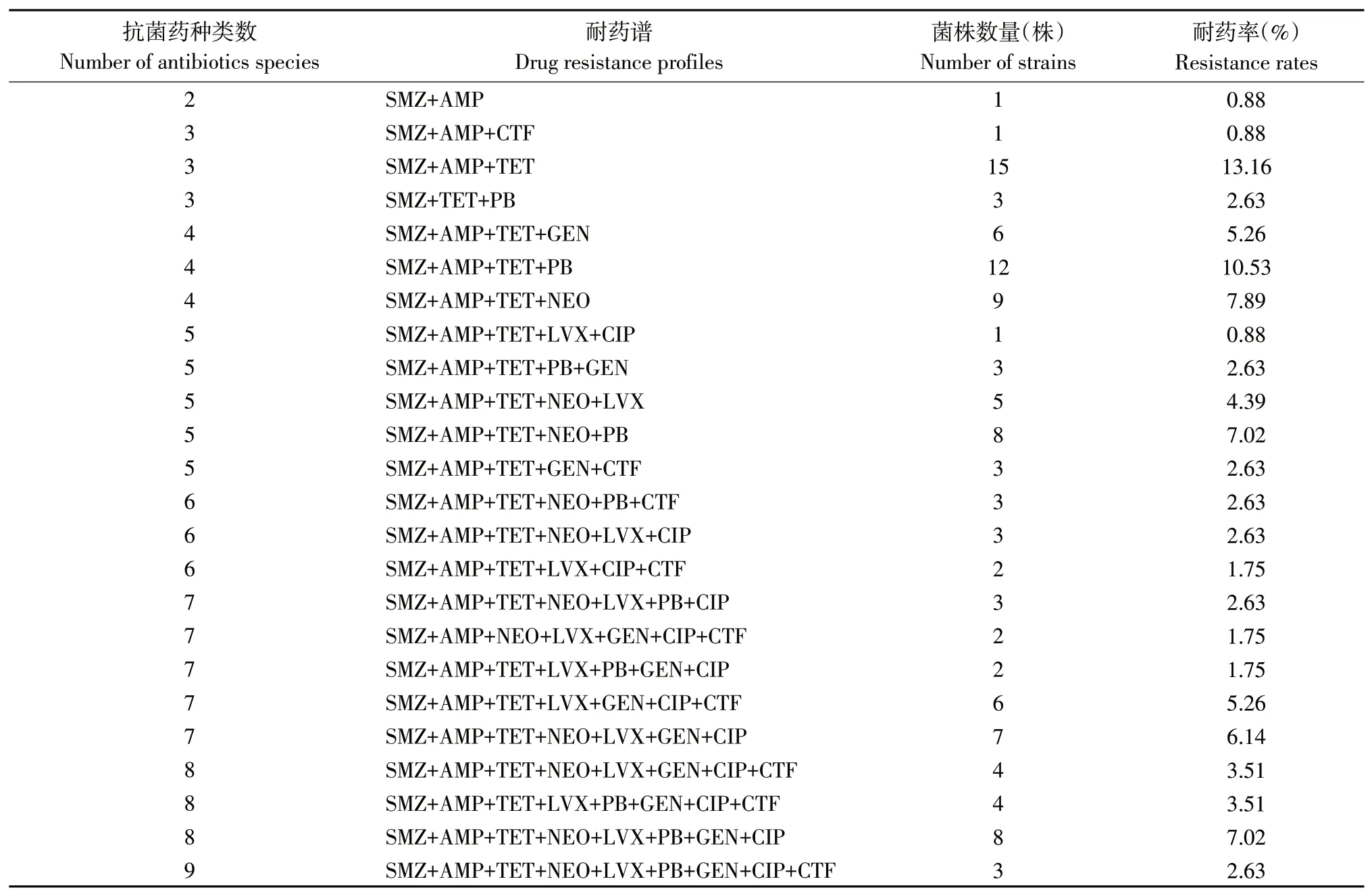
表6 大肠杆菌分离株多重耐药谱Table 6 Multidrug resistance profiles of E.coli isolates
3 讨 论
目前,我国养殖业中,仔猪大肠杆菌性腹泻常处于流行状态,梅雨季节和寒冷潮湿环境更易爆发,导致饲料报酬率降低、成活率下降、生长缓慢等问题,给猪场养殖经济造成巨大损失[14]。本研究对分离自粤西地区5 个市区(肇庆市、云浮市、阳江市、茂名市、湛江市)内腹泻仔猪肠道114 株大肠杆菌进行毒力基因鉴定和耐药性分析,为广东省仔猪大肠杆菌病防治提供数据支持。
大肠杆菌毒力因子与致病性关系一直是国内外研究热点,毒力因子合成与分泌可推动大肠杆菌在宿主体内定植和感染过程。STa、STb 和LT 是由ETEC分泌并引起仔猪腹泻的重要毒素,其在肠道中积累引起肠上皮细胞对液体的吸收功能变差,导致机体脱水[15]。本研究从腹泻仔猪肠道拭子中分离得到的大部分大肠杆菌属于ETEC,分离率达到86.84%(99/114),耐热肠毒素STa和STb存在于大多数分离大肠杆菌中,检出率高达71.93%(82/114)和61.40%(70/114),而不耐热肠毒素LT 检出率为14.40%(13/114)。王红宝等测定山西省致病性猪大肠杆菌毒力基因,发现肠毒素STa、STb和LT是检出率最高的3种毒力基因[16]。石大丽在广西部分地区猪源大肠杆菌检测中发现,STb在毒力基因检测中检出率最高,但STa 并未被检测到[9]。以上研究证实肠毒素在腹泻仔猪肠道大肠杆菌中检出率较高,说明ETEC可能是引起当前粤西部分地区仔猪腹泻主要病原菌。南文金等在2017 年关于粤北地区仔猪腹泻源大肠杆菌毒力基因检测中发现STb检出率远远高于STa 和LT,达到53.57%[17]。本研究中,STa比STb检出率更高,LT检出率较高,说明广东省仔猪源大肠杆菌感染有加重趋势,且与粤北地区流行的肠毒素主要类型呈地区性差异。大肠杆菌黏附素是决定大肠杆菌与宿主结合和定植的重要因素,引起猪腹泻的ETEC主要通过黏附素K88、K99、987P、F18ac或F41定植于肠道,稳定分泌肠毒素,引起机体腹泻[18]。唐树霄[19]和高小攀[20]研究发现猪源大肠杆菌黏附素携带率分别为14.37%(50/348)和29.21%(26/89),但本研究对分离菌株黏附素检测中并未发现较高检出率,K99,F41,F18ac,K88检出率分别为7.02%(8/114),6.14%(7/114),5.26%(6/114),0.88%(1/114),987P未在分离菌株中被检测到,可能是本次调查分离菌株中有未被检测到呈阳性黏附素基因。ETEC 致病力强弱取决于毒力因子的表达,Yang 等研究认为大肠杆菌黏附素与肠毒素之间存在正相关关系,同时表达黏附素和肠毒素的ETEC 通常致病力较强[21]。本研究中检测到肠毒素和黏附素组合菌株所占比例为13.15%(15/114),且组合呈现多样性流行,菌株致病力需在体内感染模型中进一步探究。此外,Stx2e 作为STEC 分泌的引起仔猪水肿病毒素,在腹泻仔猪肠道分离菌株中被检测到,说明STEC感染引起的仔猪水肿病也对猪群健康产生威胁,需对此加强防控意识。
由于抗生素被广泛用于临床治疗畜禽大肠杆菌病,导致细菌耐药性。本研究检测9种抗生素对粤西地区腹泻仔猪肠道大肠杆菌敏感性发现,除头孢噻呋,分离菌株对其余8 种药物耐药率均在39.47%~100%,较高耐药率可能与饲养过程中不规范使用抗生素有关。猪源大肠杆菌对四环素的耐药率较高,达到96.49%,与苏丹萍等[22]、郭潇木等[23]研究结果相似,可能与我国四环素作为兽药使用较早有关。本研究中分离菌株对氨苄西林同样表现较高耐药率(97.37%),与最近粤北地区大肠杆菌菌株耐药报告类似,氨苄西林和四环素耐药率分别达到85.0%和97.5%[24]。此外,磺胺类磺胺甲基异恶唑耐药性最为严重,达到100%,与刘艳红等[25]研究结果相同。四环素、磺胺甲基异恶唑、氨苄西林三种耐药性过高,提示临床治疗大肠杆菌感染应尽量规避这三类药物的使用。相比之下,分离菌株对庆大霉素、多黏菌素B、环丙沙星、左氧氟沙星和新霉素耐药率均在40%左右,虽有一定敏感性,但也需引起重视,因为环丙沙星中度敏感率达到39.47%(45/114),多粘菌素B更是高达57.02%(65/114),反映药物抑菌作用呈现减弱趋势。因此,在未来临床治疗中,应对临床菌株做药物敏感性分析后再合理用药,避免过度、盲目用药。头孢噻呋在本次药敏试验中抑菌效果较好,耐药率仅为24.56%,相比于郭潇木等[23]早期报道,耐药率明显下降,这种差异可能与样本采集时间、来源有关,也可能与该地区用药习惯有关。本研究分离的腹泻仔猪肠道大肠杆菌总体上对9种抗生素表现多重耐药性,耐3~9种药物的大肠杆菌占比为99.12%,不同类型的药物之间存在不同交叉耐药,与刘哲等研究结果相似[25-26]。
结合粤西地区部分养殖场的药敏检测结果看,猪源大肠杆菌具有较强耐药性,尤其是对猪养殖过程中常用抗生素普遍呈现耐药性,且出现大量多重耐药菌株,给发生大肠杆菌感染的养殖场治疗方案选择增加困难,联合用药效果变差,养殖成本增加。应合理调整用药方案,本研究具有一定临床指导作用。

