氯胺酮对发育期大鼠肝脏氧化应激和细胞焦亡的影响
张志恒,白 荟,申美伦,邱 迪,李思瑶,高 利
(东北农业大学动物医学学院,黑龙江省动物疾病发生机制与比较医学重点实验室,哈尔滨 150030)
氯胺酮是一种非竞争性NMDA 受体拮抗剂,镇静、镇痛和麻醉作用良好。氯胺酮可经多种方式给药,给药后迅速在不同组织中分布[1],最终在肝脏中被细胞色素P450 酶(CYP2B6 和CYP3A4)催化,发生去甲基化生成去甲氯胺酮[2]。目前,氯胺酮广泛用于人类医学急诊、产科及儿科手术麻醉及镇痛[3]。在兽医临床中氯胺酮主要用于野生动物保定、伴侣动物麻醉及镇痛。除具有镇痛及麻醉特性,氯胺酮在抗炎和抗抑郁方面同样发挥重要作用[4]。但氯胺酮在临床应用中也存在一定副作用,在发育期动物中尤为明显。研究显示长时间氯胺酮麻醉可造成发育期动物大脑神经细胞焦亡,导致动物成年后学习、记忆功能障碍,且氯胺酮神经毒性作用呈时间和剂量依赖性[5]。González等研究显示在兔和小鼠中使用氯胺酮麻醉引起血清中肝功能酶类谷草转氨酶(AST)和谷丙转氨酶(ALT)含量升高,造成肝损伤[6]。此外,Thomson等研究指出氯胺酮通过增加自由基,引起线粒体损伤,降低肝脏氧气运输,导致机体缺氧[7]。然而,氯胺酮麻醉能否引起发育期动物肝脏损伤仍需进一步研究证实。
正常情况下,动物体内氧化和抗氧化系统处于动态平衡。在某些病理因素作用下,平衡被打破,引起氧化应激[8-9]。Ahmad 等研究显示全身麻醉药抑制细胞内抗氧化系统,引起细胞脂质过氧化增强,活性氧(ROS)含量增加及线粒体损伤,最终导致细胞氧化应激及凋亡[10]。研究发现,孕期大鼠使用氯胺酮麻醉导致其子代海马组织中ROS 累积,脂质过氧化物生成增加,最终导致氯胺酮相关神经毒性[11]。但氯胺酮对幼龄大鼠肝脏氧化应激的影响尚未见报道。
细胞焦亡是一种特殊炎性细胞死亡形式,以细胞肿胀、裂解和炎性内容物释放为主要特点。细胞焦亡激活受caspase-1/11(大鼠/小鼠)和caspase-4/5(人)调节[12]。通常情况下,细胞焦亡经以下方式被激活:微生物感染及某些疾病进程使细胞内模式识别受体(PPR)激活,PPR可与病原体相关模式分子(PAMPs)及损伤相关模式分子(DAMPs)结合,促进炎性小体激活及caspase-1/4/5/11 切割,随后引起Gasdermin 家族蛋白裂解和激活,最终导致细胞焦亡发生及炎性因子释放[13]。Petrasek等研究显示肝脏疾病引起NLRP3炎性小体激活并诱导细胞焦亡;同时,激活后NLRP3 复合物继续募集免疫细胞,加重炎症反应[14]。Zhong 等研究显示在高脂饮食诱导的小鼠慢性肥胖模型中,肝脏caspase-1 及GSDMD-N 蛋白表达明显上调,提示高脂饮食可诱导肝脏细胞发生焦亡,引起肝脏结构和功能损伤[15]。但氯胺酮能否造成发育期大鼠肝脏焦亡仍未知。
本试验以7 日龄SD 大鼠为研究对象,通过病理组织学检查、测定肝脏功能指标、氧化应激、炎性因子和细胞焦亡水平,探究氯胺酮麻醉对发育期大鼠肝脏的影响。研究旨在明确氯胺酮对幼龄动物肝损伤的潜在机制,为今后以氯胺酮为主的复合麻醉制剂开发提供理论支持。
1 材料与方法
1.1 实验动物及器材
7 日龄SD 大鼠(24 只)购自哈尔滨医科大学实验动物中心,雌性各半,体重(20±2)g。试验所有操作及规程均按照东北农业大学动物伦理使用委员会提供的指导方案执行。
谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、γ-谷氨酰转肽酶(γ-GT)、总胆红素(T-BIL)、甘油三酯(TG)、总蛋白(TP)和白蛋白(ALB)、谷胱甘肽(GSH)和超氧化物歧化酶(SOD)检测试剂盒(购自南京建成有限公司);丙二醛(MDA)检测试剂盒(购自碧云天生物科技公司);肿瘤坏死因子(TNF-α)、白介素-6(IL-6)、白介素-1β(IL-1β)和白介素-18(IL-18)ELISA检测试剂盒(购自江苏晶美生物科技有限公司)。
1.2 试验分组与药物处理
24 只7 日龄SD 大鼠随机分为对照组(Con 组,12 只)和氯胺酮组(Ket 组,12 只),Con 组腹腔注射生理盐水,Ket 组腹腔注射20 mg·kg-1氯胺酮。氯胺酮使用生理盐水稀释,Con 组和Ket 组共计注射5 次,注射间隔90 min,Ket 组幼鼠麻醉时间共7.5 h。
1.3 动物样本采集及保存
各组大鼠最后一次给药1.5 h 后,随机分为两部分:①使用1 mL注射器经心脏抽取约0.5 mL血液,静置30 min 后2 500 r·min-1离心,10 min,取血清;采血后大鼠置于冰面,使用剪刀剪开皮肤和腹腔,小心分离并收集肝组织;血清及肝组织于-80 ℃冷冻保存,用于蛋白、基因和试剂盒指标检测;②大鼠直接分离肝脏组织,置于4%多聚甲醛中固定,用于HE染色和病理组织学分析。
1.4 病理组织学检测
使用4%多聚甲醛固定肝脏样本48 h,按照下述步骤制备组织学切片:将组织置于石蜡包埋盒流水冲洗过夜,使用不同浓度乙醇(75%~100%)梯度脱水;脱水后组织使用二甲苯透明30 min;浸入蜡块包埋,冷却;使用病理切片机对包埋组织切片,厚度为5 μm,并将切片贴于载玻片,烤片2 h。HE染色步骤如下:使用二甲苯、不同浓度乙醇(75%~100%)对切片脱蜡,随后用蒸馏水漂洗;使用苏木素染色,流水冲洗;不同浓度酒精脱水后,伊红复染;再脱水,二甲苯透明化,中性树胶封片保存。使用显微镜观察肝脏病理组织学变化,采集图像并分析。
1.5 肝功能指标检测
取Con 组和Ket 组血清样本,解冻后,使用生化试剂盒检测各组中AST、ALT、ALP、γ-GT、TBIL、TG、TP和ALB含量,评价氯胺酮对7日龄大鼠肝脏功能的影响,所有操作方法均参照试剂盒说明书提供方案。
1.6 炎性细胞因子检测
取Con 组和Ket 组样本,解冻后制备10%组织匀浆,使用酶联免疫吸附分析(ELISA)试剂盒检测匀浆中TNF-α、IL-6、IL-1β和IL-18 含量,评价氯胺酮对7日龄大鼠肝脏炎性细胞因子的影响,所有操作均参照试剂盒说明书。
1.7 氧化应激水平分析
取Con组和Ket组肝脏组织匀浆样本,使用试剂盒检测匀浆中GSH、SOD和MDA含量,评价氯胺酮对7日龄大鼠肝脏氧化应激的影响,所有操作均参照试剂盒说明书。肝组织中MDA含量(nmol·mg-1),GSH含量(μmol·g-1),SOD活力(U·mg-1)。
1.8 蛋白提取及蛋白质免疫印迹分析
提取各组样本总蛋白并作蛋白质免疫印迹(Western blot)分析,方法如下:制备组织匀浆,使用含1%PMSF 的RIPA 蛋白质裂解液(RIPA∶PMSF 为99∶1)处理肝脏组织匀浆;高速离心后加入PBS 溶解沉淀,使用BCA 法测定蛋白质浓度;蛋白样本中加入5× Loading Buffer,金属浴100 ℃作用10 min使蛋白充分变性;使用SDS-PAGE凝胶快速制备试剂盒配制上层胶及下层胶;安装电泳槽和胶板,加入提前配置好的电泳液,分别于每个蛋白孔道加入蛋白样本及蛋白Marker,上层胶电泳参数为80 V,25 min,下层胶电泳参数为120 V,60 min;切胶,将蛋白转移至硝酸纤维素膜上,5%脱脂牛奶封闭1~3 h;封闭后NC膜与对应一抗(GSDMD、NLRP3、ASC、caspase-1、GAPDH)过夜孵育,4 ℃;TBST 洗膜3次,每次10 min,二抗室温孵育1 h,再使用TBST洗膜3次,每次10 min;提前配制ECL 显色试剂(A 液∶B 液为1∶1),并滴加至NC膜,使用凝胶成像系统(Tanon 5200化学发光成像仪,上海天能公司)曝光。使用ImageJ 软件分析Western Blot。
1.9 RNA提取和qPCR检测
按照总RNA 抽提试剂盒说明书操作,提取各组样本中RNA。使用反转录试剂盒将提取RNA反转录为cDNA;随后将cDNA、荧光染料和目的基因上下游引物混合,进行实时荧光定量PCR(qPCR)检测,分析氯胺酮对焦亡相关基因(GSDMD、NLRP3、ASC、caspase-1)表达的影响。使用2-ΔΔCt法分析和计算qPCR数据,目的基因引物序列见表1。

表1 引物序列Table 1 Primer sequence
1.10 统计与分析
试验数据使用SPSS 25.0 数据处理软件,使用独立样本T检验分析数据,结果使用平均值±标准差(即means±SD)表示,其中P<0.05 表示差异显著;P<0.01表示差异极显著。
2 结果与分析
2.1 氯胺酮对7日龄大鼠肝脏功能的影响
为评估连续氯胺酮注射对7日龄大鼠肝脏功能的影响,本试验检测血清中AST、ALT、ALP、γ-GT、TBIL、TP、ALB 和TG 含量变化。AST 和ALT是两种重要肝脏功能酶,结果如图1A、B 所示,与对照组相比,氯胺酮组大鼠血清中AST 和ALT含量极显著升高(P<0.01)。ALP 和γ-GT 广泛存在于组织中,肝细胞受损后明显增加。ALP 和γ-GT检测结果见图1C、D,对照组相比,氯胺酮组ALP和γ-GT 含量极显著增加(P<0.01)。TBIL 和TG 是判断肝脏脂质和胆红素代谢是否异常的重要指标,检测结果见图1E、F,对照组相比,氯胺酮组TG 和TBIL 含量极显著增加(P<0.01)。蛋白质主要在肝细胞中合成,血清TP 和ALP 含量间接反映肝脏蛋白质合成功能。与对照组相比,氯胺酮组大鼠血清中ALB 含量显著降低(P<0.05),TP 含量极显著降低(P<0.01)。上述结果提示连续氯胺酮麻醉对7日龄SD大鼠肝脏功能造成损伤。
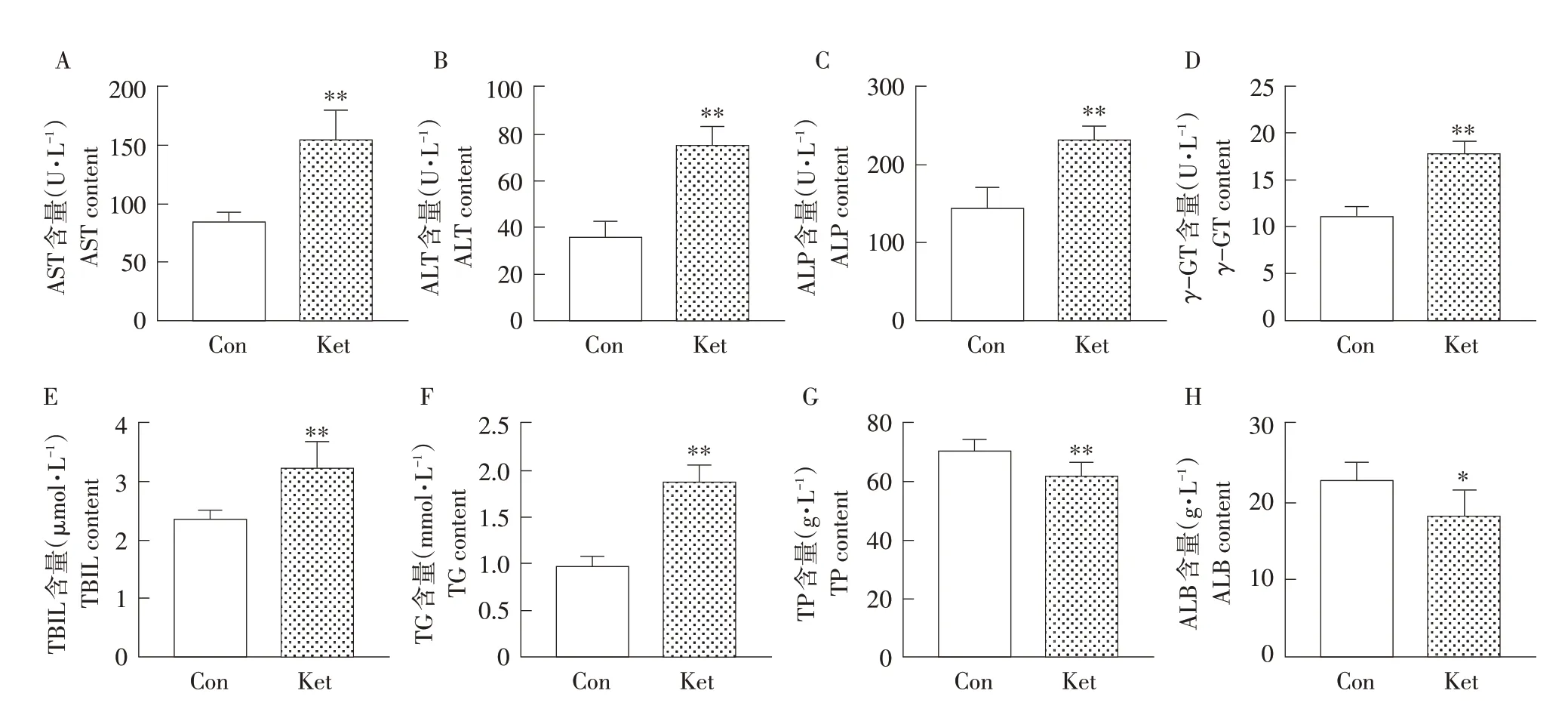
图1 肝功能指标检测Fig.1 Detection of liver function indices
2.2 氯胺酮对7日龄大鼠肝脏组织结构的影响
使用苏木精-伊红染料对肝脏组织学切片染色(HE 染色),并在显微镜下观察肝脏组织学变化。结果见图2,对照组大鼠肝脏结构无明显异常,肝小叶清晰可见,细胞结构正常,肝细胞索排列规则;氯胺酮组中7日龄大鼠肝脏组织发生明显结构损伤,肝细胞肿胀、细胞间存在间隙且排列混乱,偶见炎性细胞浸润。
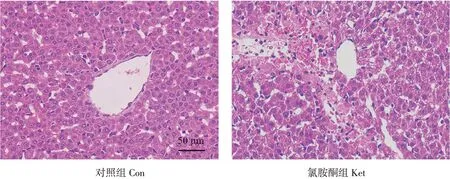
图2 肝脏HE染色(400×)Fig.2 HE staining in liver(400×)
2.3 氯胺酮对7日龄大鼠肝脏氧化应激水平的影响
GSH、SOD和MDA检测结果见图3。GSH主要在肝脏中合成且在肝脏中含量最高,当出现肝损伤时,GSH 含量下降。如图3A 所示,与对照组相比,氯胺酮组中7 日龄SD 大鼠肝脏GSH 含量极显著降低(P<0.01)。SOD 是机体非常重要的抗氧化酶,主要负责清除自由基。如图3B 所示,与对照组相比,氯胺酮组中7 日龄SD 大鼠肝脏SOD 含量极显著降低(P<0.01)。MDA 可反映体内脂质过氧化情况,如图3C 所示,与对照组相比,氯胺酮组中7日龄SD大鼠使用氯胺酮麻醉后,肝脏MDA 含量极显著增加(P<0.01)。
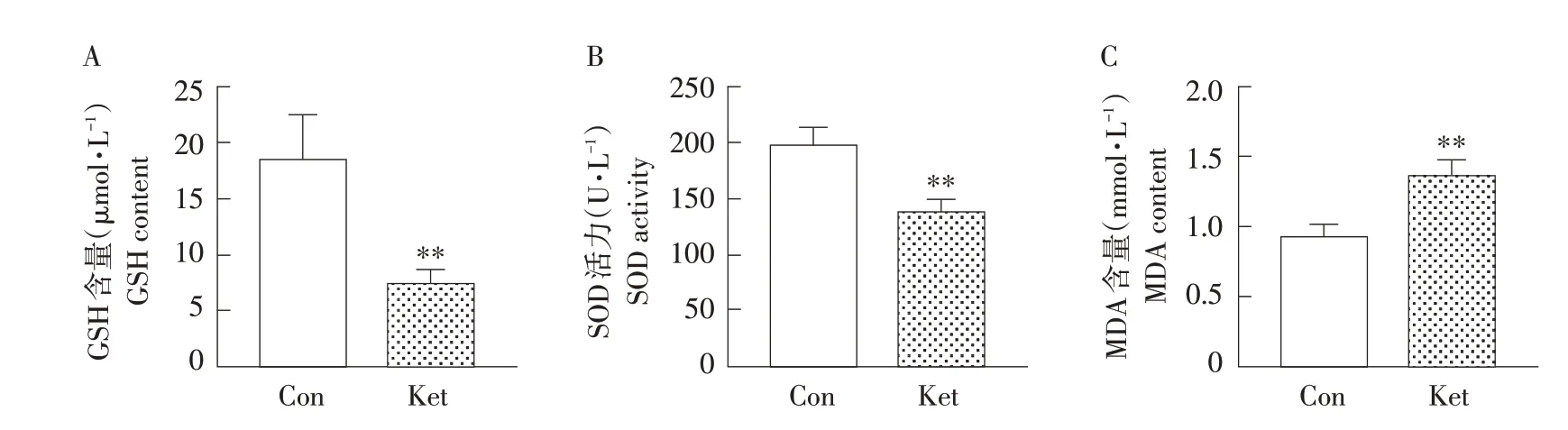
图3 大鼠肝脏中GSH、SOD和MDA含量变化Fig.3 Contents change of GSH,SOD and MDA in rat liver
2.4 氯胺酮对7日龄大鼠肝脏炎症水平的影响
TNF-α、IL-6、IL-1β和IL-18 是反映机体炎症程度重要指标,7日龄大鼠持续使用氯胺酮麻醉后肝脏组织中TNF-α、IL-6、IL-1β和IL-18 变化情况如图4所示。与对照组相比,氯胺酮组大鼠肝脏组织中TNF-α、IL-6和IL-1β显著升高,变化极显著(P<0.01)。此外,氯胺酮组肝脏IL-18含量与对照组相比升高,但无统计学差异。

图4 大鼠肝脏中TNF-α、IL-6、IL-1β和IL-18含量变化Fig.4 Contents change of TNF-α,IL-6,IL-1β and IL-18 in rat liver
2.5 氯胺酮对7 日龄大鼠肝脏焦亡蛋白和基因的影响
NLRP3、GSDMD-N、ASC 和Caspase-1 p20 是细胞焦亡关键调节蛋白。7 日龄SD 大鼠连续使用氯胺酮麻醉后肝脏细胞焦亡蛋白表达情况如图5所示。
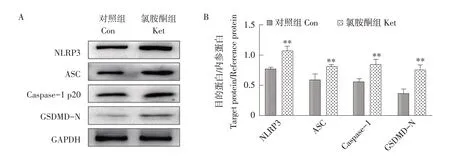
图5 大鼠肝脏焦亡相关蛋白表达情况Fig.5 Protein expression of pyroptosis in rat liver
氯胺酮给药组大鼠肝脏NLRP3、GSDMD-N、ASC 和Caspase-1 p20 蛋白表达显著上调,与对照组相比差异极显著(P<0.01)。mRNA水平分析结果如图6所示,氯胺酮给药后大鼠肝脏NLRP3、GSDMD、ASC和Caspase-1基因表达上调,与对照组相比差异极显著(P<0.01)。
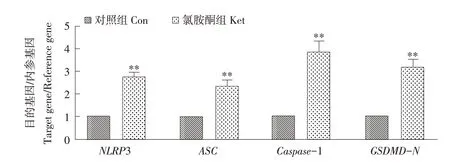
图6 大鼠肝脏焦亡相关基因表达情况Fig.6 Gene expression of liver pyroptosis in rats
3 讨 论
麻醉是兽医临床中辅助诊断及治疗重要手段,但麻醉药对幼龄动物肝脏造成的负担也引起关注。在成年动物相关研究中,氯胺酮显示一定肝脏毒性。Wong 等发现成年大鼠长期注射低剂量氯胺酮,导致肝糖原分解增强且含量降低,动物出现远期行为异常以及体重降低等临床表现[16]。Venâncio 等研究表明大鼠连续注射高剂量氯胺酮两周后,肝脏组织出现病变,线粒体产生损伤[17],肝细胞内ATP 含量降低[18],糖异生加速,血糖水平增加[19]。Wai等研究表明大鼠连续注射氯胺酮会引起肝脏脂肪变性及纤维化[20]。新生动物肝脏处于快速发育阶段,此时长期或多次使用氯胺酮可能造成肝脏损伤。本研究使用7 日龄SD 大鼠,评价氯胺酮麻醉对发育期大鼠肝脏的影响。结果显示7 日龄SD 大鼠连续注射20 mg·kg-1氯胺酮引起肝脏细胞结构损伤(肝脏细胞肿胀,结构排列混乱)、肝脏功能酶类(AST、ALT、ALP、γ-GT、TBIL 和TG)含量增加,蛋白合成能力(TP 和ALB)下降,与前人研究结果有相近之处。
氧化应激可引起多种疾病,如慢性肾病、糖尿病和肝炎等[21]。氧化应激时,细胞内产生大量的脂质过氧化物会造成细胞损伤;而机体存在抗氧化酶(如SOD 和GSH)可保护细胞免受氧化损伤[19]。De 等研究表明氯胺酮可增加海马组织及血液中氧化应激水平[22],Xi 等则指出氯胺酮可通过P38/NF-kB 通路增强膀胱组织氧化应激水平[23]。本研究发现氯胺酮导致发育期大鼠肝脏氧化/抗氧化平衡失调,导致MDA 含量增加,SOD 和GSH 含量降低,最终引起肝脏氧化应激。由此推断,氯胺酮经氧化应激途径对发育期大鼠肝脏造成损伤。
细胞焦亡参与多种疾病的病理生理学进程,如细菌感染[24]、癌症[25]和缺血再灌注损伤[26]等。在经典焦亡途径中,NLRP3 炎性小体激活后caspase-1 裂解,引起GSDMD 切割,最终导致细胞焦亡发生和炎性因子释放[27]。Bai 等研究指出在小鼠肝脏损伤模型中,NLRP3 炎性小体激活引起的细胞焦亡会导致肝脏炎症和纤维化[28]。Mridha等发现在非酒精性脂肪性肝炎(NASH)中,NLRP3炎性小体的激活可增加肝脏瘢痕形成及肝炎程度[29]。本试验分析焦亡和炎症相关指标,发现氯胺酮引起发育期大鼠肝脏NLRP3、caspase-1及GSDMD的蛋白及基因表达上调,炎性细胞因子TNF-α、IL-6、IL-1β和以及L-18含量增加,提示氯胺酮导致发育期大鼠肝脏焦亡和炎症,与上述研究结果一致。此外,Gaul 等研究显示氧化应激导致的ROS 水平增加是NLRP3 炎性小体激活的必要条件之一[30]。综上,连续使用氯胺酮增加肝脏氧化应激水平,激活NLRP3 炎性小体及细胞焦亡,导致发育期大鼠肝组织结构损伤。

