Microcystin-LR对体外牛子宫内膜上皮细胞增殖和凋亡的影响
张贵学,李晓宇,黄富硕,马铭钧,王子铭,冯 瑞,李玉龙,许钟峯,郑 鹏
(东北农业大学动物科学技术学院,哈尔滨 150030)
微囊藻毒素(Microcystin,MC)作为一种由水华爆发时微囊藻属等蓝藻产生的代谢产物[1],已成为广泛存在于水体的有害物质。其中,变异体MC-LR(L,R 分别代表亮氨酸和精氨酸)分布最广,毒性最强[2]。近年来对MC-LR 研究日益深入,发现其对动物肝、肾脏、神经、免疫系统和生殖系统均具有毒性[3-4]。Campos 等研究表明,MC-LR 可通过转运蛋白有机阴离子转运多肽(OATP)承载进入细胞[5],动物肝脏中存在OATP家族成员,是MC-LR 主要靶器官。向小鼠腹腔内注射用同位素标记的MC-LR 后,不仅在肝脏中检测到MC-LR 大量积累,且肾脏中也有分布[6]。此外,MC-LR 也可通过OATP 进入小鼠脑细胞,诱导小鼠海马神经元细胞(HT-22 细胞)产生氧化应激,引起神经细胞凋亡[7]。近年报道表明,MC-LR可减少淋巴细胞增殖,改变吞噬细胞(Phagocyte)和自然杀伤细胞(Natural killer cell,NK)等活性,干扰细胞因子合成等多种机制改变免疫系统,对动物免疫系统产生不利影响[8]。MC-LR 除上述毒性外,对雌性动物生殖系统也有毒性。Zhang等研究MCLR 对体外中国仓鼠卵巢(CHO)细胞影响发现,MC-LR可显著抑制CHO细胞体外增殖,MC-LR处理的CHO细胞显示强烈细胞周期停滞及凋亡诱导作用;此外,将CHO 细胞暴露于MC-LR 导致过量活性氧生成和细胞内钙释放,导致内质网应激(ERs),同时自噬泡也大量积累[9]。Wu 将MC-LR以200 μg·kg-1剂量注射雌性小鼠腹腔内,连续28 d饲养,表明MC-LR 注射组小鼠卵巢重量较正常组下降,发情期和发情期持续时间减少,孕酮水平显著降低[10]。尽管之前有MC 对母畜生殖系统产生毒性作用的研究,但大多数集中在卵巢,关于MC对母畜子宫影响的研究却鲜见报道。因此,本试验旨在通过用MC-LR 体外处理牛子宫内膜上皮细胞(Bovine endometrial epithelial cells,BEECs),探究其对细胞活率影响及分子调控机制,为后续提高奶牛繁殖效率相关研究提供理论和实践依据。
1 材料与方法
1.1 试验材料
牛子宫内膜上皮细胞购自广州华拓生物科技有限公司(Otwo Biotech)。
1.2 主要试剂
EMEM 培养基(购自美国Gibco 公司);胎牛血清(Pansera ES)(购自德国Pan Seratech 公司);PBS(P1010)、SDS-PAGE 电泳液(购自Solarbo 公司);胰蛋白酶、胰酶细胞消化液、1.5 mol·L-1Tris-HCl(pH=8.8)、1.0 mol·L-1Tris-HCl(pH=6.8)、ECL 发光底物试剂盒、四甲基乙二胺(TEMED)和双抗均(购自奥淇洛谱(biosharp)公司)、微囊藻毒素(MC-LR)(购自MedChemExpress 公司);β-actin、Caspase-3、Caspase-9 抗体以及其二抗均(购自博奥森(Bioss)公司);Trizol、PCR试剂盒和反转录试剂盒均(购自日本TaKaRa公司);TAE电泳液(购自纳川生物技术公司);琼脂糖(购自Biowest 公司);引物由上海生工生物科技公司合成;q-PCR 试剂盒FastStart Universal SYBR Green Master(ROX)(购自Roche 公司);Cell counting kit-8(CCK-8)(购自美国Bimake 公司);凋亡免疫荧光试剂盒(购自Beyotime Biotechnology 公司);流式测细胞周期试剂盒(购自杭州联科生物技术股份有限公司);流式测细胞凋亡试剂盒购自南京诺唯赞生物科技有限公司。
1.3 BEECs的培养
①细胞传代:参照詹同彤等方法[11],将培养瓶中细胞转移到大皿中培养,待皿中细胞汇合到80%~90%时,用移液器吸出培养液,选择3 mL 1×PBS 清洗皿表面,加入4 mL 胰酶细胞消化液,放入37 ℃恒温培养箱中消化3~4 min,显微镜下观察细胞,待细胞变圆、漂浮后加入等体积培养液终止消化,用移液器轻轻吹打,将混合液移入10 mL离心管,用1 000 r·min-1离心机离心4 min,离心完毕后立即倾倒上清,然后向离心管中加入2 mL 培养液,吹打均匀后,分别移至两个中皿,再向两个中皿分别加入2 mL 培养液,细胞继续生长。待贴壁细胞数量达到80%~90%时,再次传代。
②细胞冻存和复苏:待细胞传至2~3 代时,冻存部分细胞供后续试验使用。按照细胞传代步骤至离心完毕倾倒上清后,向离心管中加入冻存液,待管中细胞充分溶解于冻存液后,移至2 mL冻存管中,用封口膜将冻存管口封好,放入4 ℃预冷30 min,-20 ℃中停留2 h,-80 ℃冻存柜中过夜。第二天将冻存柜中细胞移入液氮(-196 ℃)中长期保存。细胞复苏时,从液氮中取出冻存细胞,迅速放入37~38 ℃水浴锅中解冻,待冻存管中液体融化后,用移液枪将液体移至离心管中,1 000 r·min-1离心机离心3 min,弃上清后加入培养液溶解,溶解后将液体移入中皿,加适量培养液稀释,置于5%CO2箱,37 ℃,饱和湿度培养。
1.4 CCK-8检测细胞存活率
将细胞传至3~4代后,移至96孔板,培养24 h后,移液枪吸走上清,加入新培养液,分为10组,分 别 用0、40、60、80、100、120、140、160、180、200 μg·L-1的MC-LR 处理细胞,培养12、24 h 后,加入CCK-8 试剂,继续培养2 h,之后用酶标仪测定450 nm 处吸光度,计算细胞存活率。
1.5 流式细胞术测定细胞凋亡率
待细胞传至3~4代,用160 μg·L-1MC-LR处理细胞24 h,培养至处理时间后弃掉培养液,用2 mL 1×PBS 清洗,用不含EDTA 的胰酶消化细胞,待皿中细胞被消化漂浮起来后收集细胞,用1 000 r·min-1、4 ℃离心机离心5 min,弃上清。预冷PBS洗涤细胞两次,均在1 000 r·min-1、4 ℃条件下离心5 min,弃上清。然后加入100 μL 1×Binding Buffer,轻轻吹匀直至成为单细胞悬液。之后加入5 μL Annexin V-FITC 和5 μL PI Staining Solution,轻轻吹匀;避光、室温(20~25℃)孵育10 min;最后加入400 μL 1×Binding Buffer,轻轻混匀。染色后样品在1 h内用流式细胞仪检测。
1.6 流式细胞术检测细胞周期
收集用100 μg·L-1的MC-LR 处理12 h 后细胞(2×105~1×106个),离心弃上清,用1×PBS 洗涤一次,离心弃上清。然后加入1 mL DNA Staining solution 和10 μL Permeabilization solution 旋涡振荡5~10 s混匀。室温避光孵育30 min。选择最低点上样速度,在流式细胞仪上检测。
1.7 RT-qPCR检测基因mRNA表达
收集不同处理条件下细胞后,使用Trizol 提取RNA,紫外分光光度法测定其浓度和纯度。当OD260/OD280比值在1.8~2.0,认为样品合格。之后用TaKaRa 试剂盒进行反转录。待反转录完成后,再按照试剂盒步骤进行PCR 扩增。其中引物见表1,扩增完毕后,以β-actin 为参照,采用2-ΔΔCt方法计算各基因mRNA表达量。
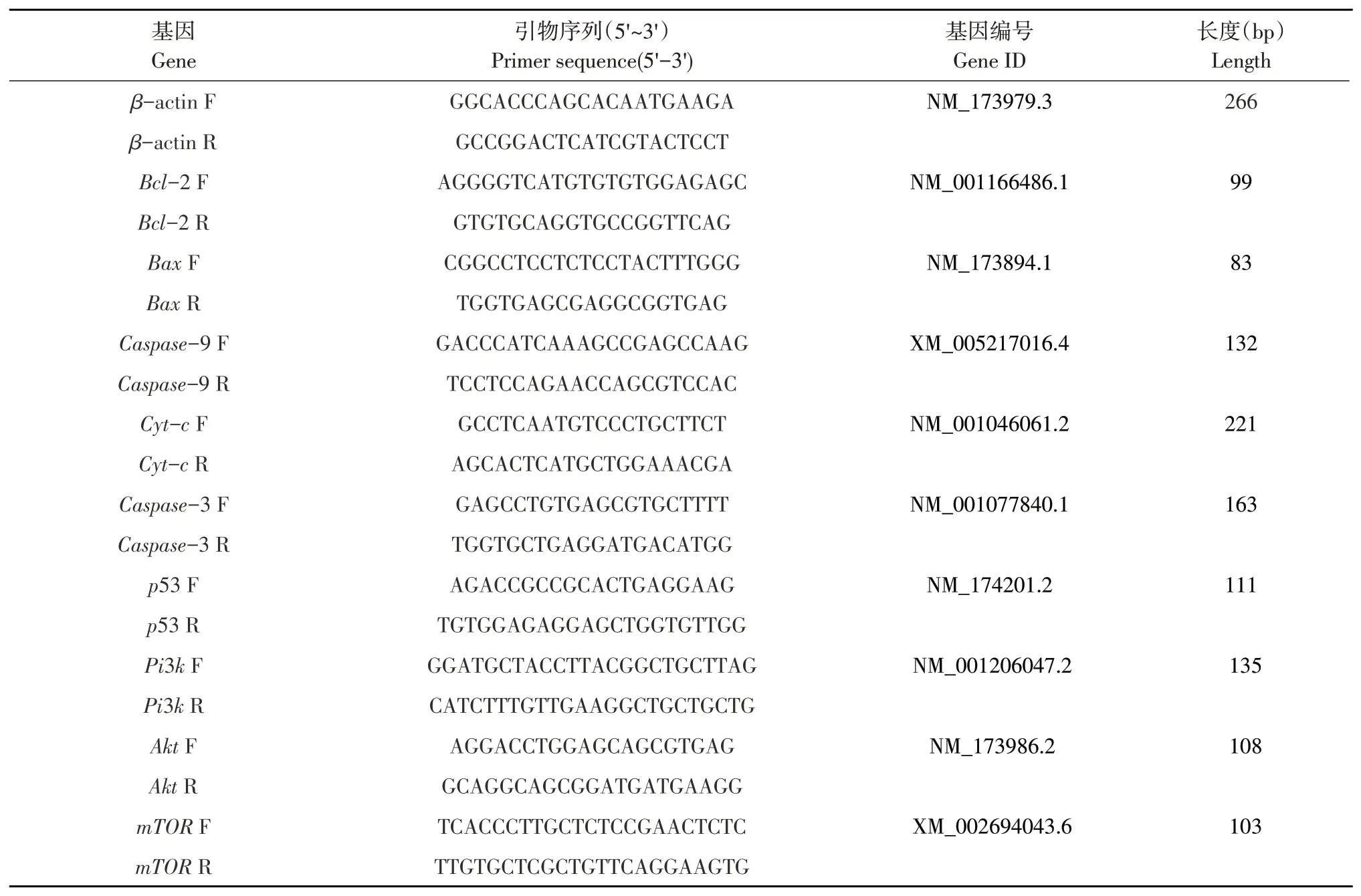
表1 引物序列Table 1 Primer sequences
1.8 Western blot 测定Pi3k、Akt、Caspase-9 和Caspase-3蛋白表达
收集经不同方案处理细胞后,用RIPA 裂解细胞获得蛋白。BCA 法确定蛋白浓度后,进行十二烷基硫酸钠(SDS)聚丙烯酰胺电泳。之后转膜,脱脂乳封闭,4 ℃一抗孵育过夜,16 h后TBST清洗三次后室温孵育二抗,孵育完毕后再用TBST 清洗三次,清洗后加ECL 显色液曝光。以β-actin 为参照,使用Image J软件分析光密度。
1.9 统计学分析
试验重复3次,数据表示为平均值(Means)±标准差(SD),使用SPSS 20.0 软件统计分析,单因素方差分析LSD 法检验显著性,使用GraphPad Prism 8 软件制图,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
2 结果与分析
2.1 CCK-8检测不同浓度及时间处理后细胞存活率变化
CCK-8检测细胞存活率,结果见图1,12 h处理组,MC-LR 处理后细胞存活率增加;24 h 处理组,MC-LR 处理后细胞存活率降低。根据已有结果选取12 h 100 μg·L-1(P<0.01),24 h 160 μg·L-1(P<0.01)两种方案作后续试验。
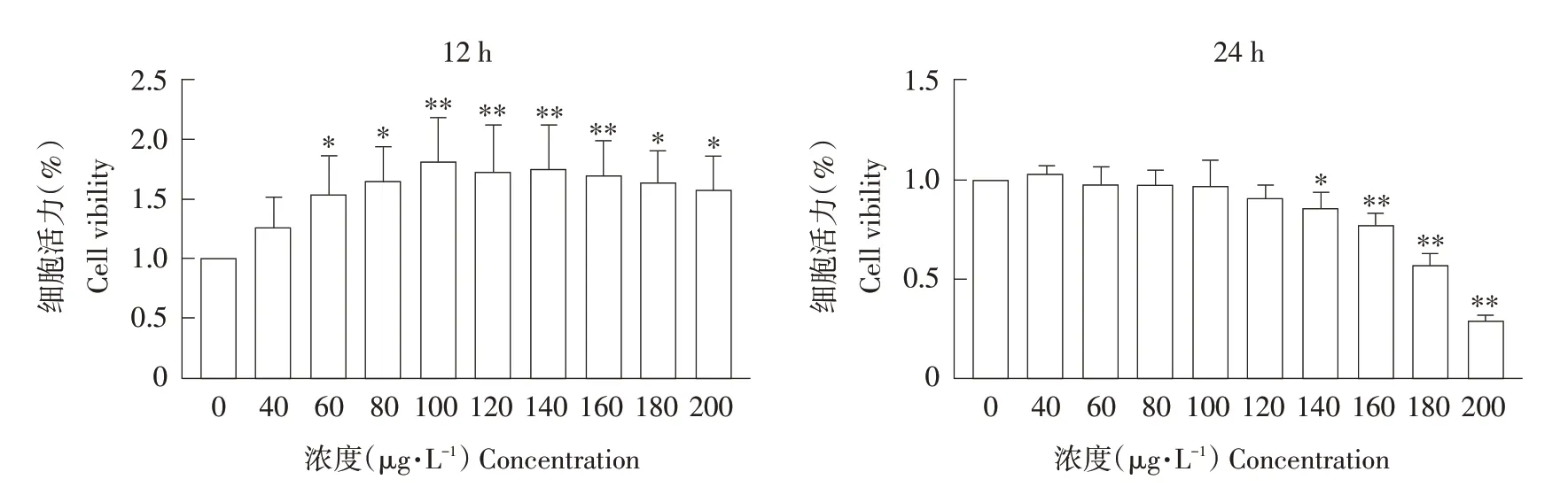
图1 不同浓度、不同时间MC-LR处理对细胞存活率的影响Fig.1 Effects of MC-LR treatment at different concentrations and different times on cell viability
2.2 100 μg·L-1 MC-LR处理细胞12 h的影响
2.2.1 100 μg·L-1MC-LR 处理细胞12 h 后对Pi3k信号通路的影响
qPCR 检 测Pi3k、Akt、mTOR等mRNA 表 达量,结果见图2,与对照组相比,上述基因mRNA表达极显著上升(P<0.01),表明使用100 μg·L-1MC-LR 处理细胞12 h 促 进Pi3k,Akt和mTOR的mRNA表达。此条件对Pi3k和Akt蛋白表达的影响见图3A,使用100 μg·L-1MC-LR 处理细胞12 h,Pi3k(110 ku)和Akt(56 ku)蛋白表达量均显著上升,其中Pi3k 蛋白表达量见图3B,表达量极显著上升(P<0.01),Akt蛋白表达量见图3C,表达量显著上升(P<0.05),与qPCR结果趋势一致。此试验结果表明用100 μg·L-1MC-LR处理细胞12 h,可强化Pi3k-Akt-mTOR通路导致细胞增殖。
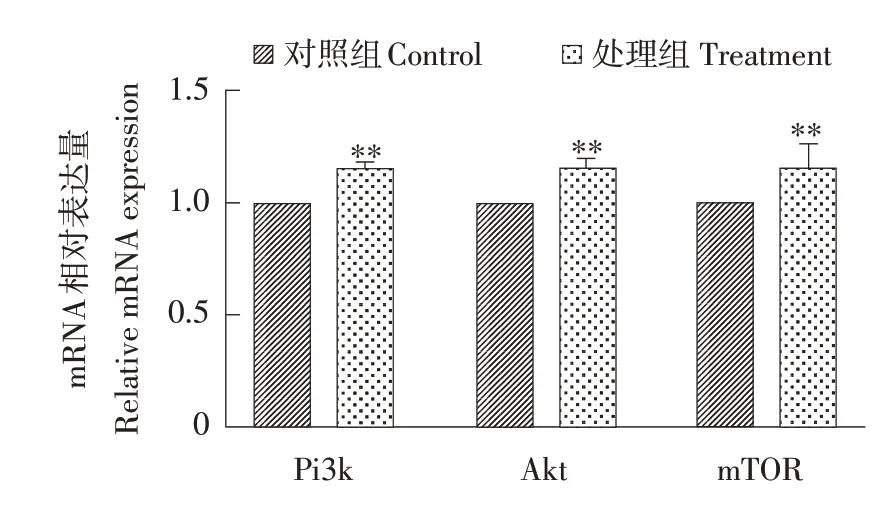
图2 12 h 100 μg·L-1处理对Pi3k信号通路基因的影响Fig.2 Effects of 12 h 100 μg·L-1 treatment on Pi3k signal pathway genes
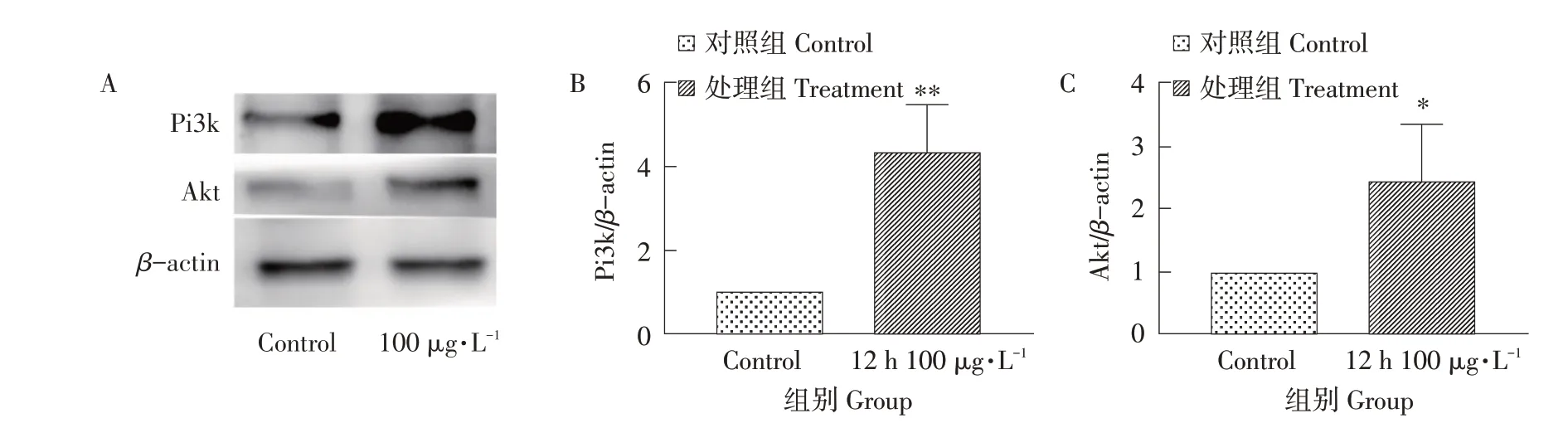
图3 12 h 100 μg·L-1处理对Pi3k及Akt蛋白的影响Fig.3 Effects of 12 h 100 μg·L-1 treatment on Pi3k and Akt protein
2.2.2 100 μg·L-1MC-LR 处理细胞12 h 后对线粒体凋亡通路的影响
100 μg·L-1MC-LR 处理细胞12 h 细胞线粒体凋亡通路相关基因mRNA 和蛋白相对表达量变化见图4,其中Cyt-c、Caspase-9、Caspase-3的mRNA 表达量与对照组相比均极显著下降(P<0.01);蛋白表达量条带结果见图5A,Caspase-9(35 ku)和Caspase-3(28 ku)表达均下降,Caspase-9蛋白表达结果见图5B,表达量显著下降(P<0.05),Caspase-3蛋白表达结果见图5C,表达量极显著下降(P<0.01)。以上试验结果表明,使用100 μg·L-1MC-LR处理细胞12 h,细胞线粒体凋亡通路被抑制,导致凋亡细胞数量减少,细胞数量增加。

图4 12 h 100 μg·L-1处理对线粒体凋亡通路基因mRNA的影响Fig.4 Effects of 12 h 100 μg·L-1 treatment on the mRNA of mitochondrial apoptosis pathway genes
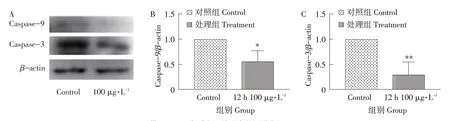
图5 12 h 100 μg·L-1处理对Caspase-3和Caspase-9蛋白的影响Fig.5 Effects of 12 h 100 μg·L-1 treatment on Caspase-3 and Caspase-9 proteins
2.2.3 100 μg·L-1MC-LR处理细胞12 h对细胞周期的影响
100 μg·L-1MC-LR处理细胞12 h,细胞周期发生变化见图6A,处理后处于G0/G1 期细胞比例减少,G2/M期细胞比例增加,S期细胞比例增加,且根据图6B结果,其变化均呈极显著趋势(P<0.01)。结果表明,100 μg·L-1MC-LR处理细胞12 h后,细胞处于G2/M期比例增加,有助于细胞增殖。

图6 12 h 100 μg·L-1处理对细胞周期的影响Fig.6 Effects of 12 h 100 μg·L-1 treatment on cell cycle
2.2.4 100 μg·L-1MC-LR处理细胞12 h后对p53基因mRNA表达的影响
100 μg·L-1MC-LR 处理细胞12 hp53 基因mRNA相对表达量变化如图7所示,p53基因mRNA表达量显著上升(P<0.05)。
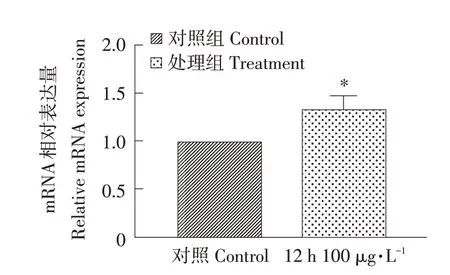
图7 12 h 100 μg·L-1处理对p53基因mRNA表达量的影响Fig.7 Effects of 12 h 100 μg·L-1 treatment on the expression of p53 gene mRNA
2.3 160 μg·L-1 MC-LR处理细胞24 h的影响
2.3.1 160 μg·L-1MC-LR处理细胞24 h后染色情况
160 μg·L-1MC-LR 处理细胞24 h 引起细胞变化结果如图8所示,染为绿色的为凋亡细胞,染为红色的为坏死细胞,其中黑色箭头指的是被绿色单染的凋亡细胞,白色箭头指示被绿色和红色双染的坏死细胞。统计分析表明160 μg·L-1MC-LR处理细胞24 h,引起细胞凋亡,且发现因凋亡死亡细胞数量大于坏死细胞数量。
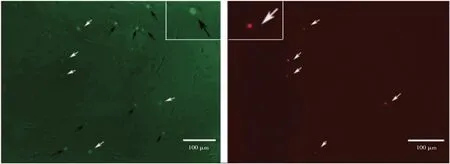
图8 24 h 160 μg·L-1处理后细胞染色结果Fig.8 Cell staining results after 24 h 160 μg·L-1 treatment
2.3.2 160 μg·L-1MC-LR处理细胞24 h后对细胞凋亡率的影响
为进一步探究160 μg·L-1MC-LR 处理细胞24 h对细胞凋亡率的影响,采用流式细胞仪检测处理后细胞凋亡变化,结果如图9A 所示,细胞发生凋亡,且大部分凋亡细胞处于凋亡早期阶段。凋亡率如图9B 所示,与对照组相比,表达量极显著上升(P<0.01)。
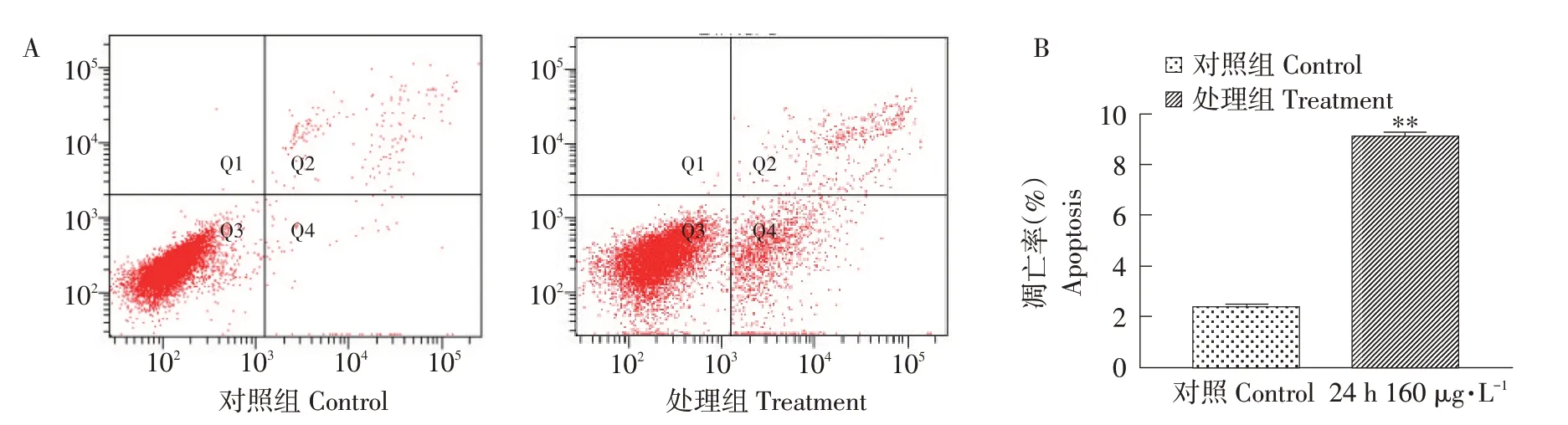
图9 24 h 160 μg·L-1处理对细胞凋亡率的影响Fig.9 Effects of 24 h 160 μg·L-1 treatment on cell apoptosis rate
2.3.3 160 μg·L-1MC-LR 处理细胞24 h 后对线粒体凋亡通路的影响
检测160 μg·L-1MC-LR 处理细胞24 h 线粒体凋亡途径主要基因变化见图10、11。图10 表明,160 μg·L-1MC-LR 处理细胞24 h后与对照组相比,Cyt-c、Caspase-9、Caspase-3、Bax/Bcl-2 基 因mRNA 相对表达量均上升,其中Cyt-c与Caspase-9显著升高(P<0.05),Caspase-3、Bax/Bcl-2极显著升高(P<0.01)。图11A蛋白条带结果显示,160 μg·L-1MC-LR 处理细胞24 h,与对照组相比,Caspase-9(35 ku)和Caspase-3(28 ku)蛋白表达量均升高,其中Caspase-9 表达量显著升高(P<0.05),Caspase-3表达量极显著升高(P<0.01),见图11B、11C。基因mRNA和蛋白表达趋势一致,试验表明,160 μg·L-1MC-LR处理细胞24 h,强化线粒体凋亡通路,导致细胞发生凋亡。
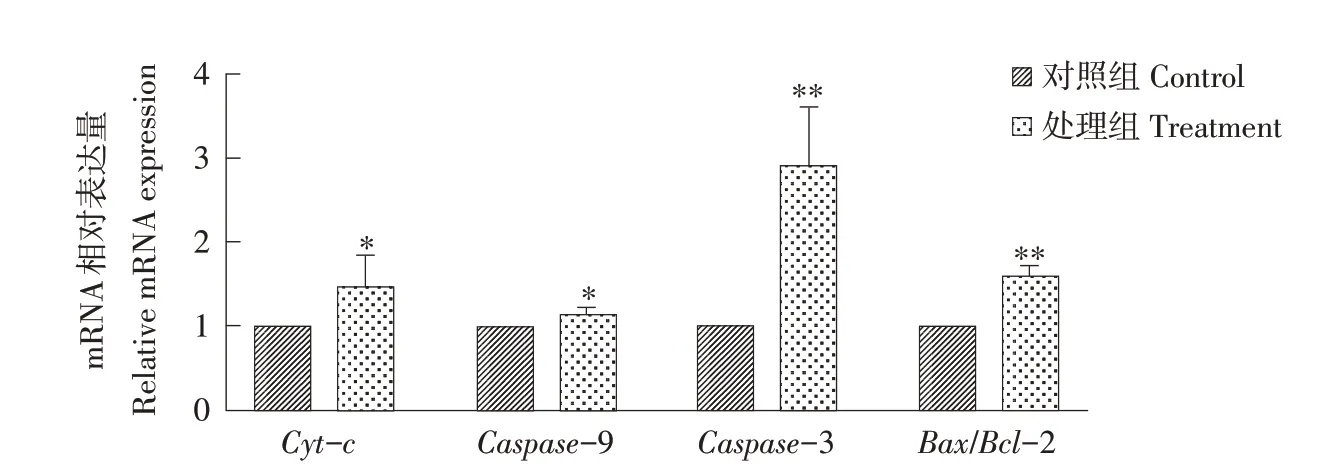
图10 24 h 160 μg·L-1处理对对线粒体凋亡通路基因mRNA的影响Fig.10 Effects of 24 h 160 μg·L-1 treatment on mitochondrial apoptosis pathway gene mRNA

图11 24 h 160 μg·L-1处理对Caspase-9及Caspase-3蛋白的影响Fig.11 Effects of 24 h 160 μg·L-1 treatment on Caspase-9 and Caspase-3 protein
3 讨 论
3.1 MC-LR处理对Pi3k通路的影响
研究证明Pi3k-Akt-mTOR 信号通路与细胞增殖联系密切[5-6],细胞接收外界刺激后,可通过磷脂酰肌醇三激酶(Pi3k)诱发三磷酸(3,4,5)磷脂酰肌醇(PIP3)生成,生成的PIP3 可作为具有普列克底物蛋白同源性(PH)结构域蛋白质膜停泊位点,与Akt 及其上游激活剂PDK1结合[7]。当Akt 通过其普列克底物蛋白同源(PH)结构域与PIP3 结合后,导致Akt 转位至细胞膜,通过双磷酸化机制激活Akt。同理,自身PH 结构域而转位至细胞膜的PDK1 激活Akt 苏氨酸308 位点使其磷酸化。此外,mTORC2 可激活Akt 丝氨酸473 位点使Akt 酶活性被完全激活[8-10]。Pi3k 相关激酶(Pikk)家族成员,包括DNA-PK 也同样在Akt 丝氨酸473 位点将其磷酸化[7]。被激活的Akt 导致大量下游底物磷酸化,包括共有序列RXRXXS/T,其主要功能之一是调控mTOR 信号转导通路,促进细胞生长与蛋白质合成,从而达到细胞增殖目的[12-13]。本试验使用100 μg·L-1MC-LR 处理细胞12 h,Pi3k和Akt的mRNA 和蛋白相对表达量均显著上调,mTOR的mRNNA 表达量显著上调,证明此处理条件可激活细胞内Pi3k-Akt-mTOR 信号通路,引起细胞增殖,导致细胞数量增加。
3.2 MC-LR处理对线粒体凋亡通路的影响
线粒体是生命体中必不可少的一部分,主要参与ATP 合成,为细胞各种生命活动提供能量。Hers 等研究发现,线粒体在细胞凋亡过程中也扮演重要角色[14]。当细胞受到辐射、缺氧、毒素等外界应激时,线粒体外膜通透性(MOMP)发生改变,导致线粒体膜空间蛋白(尤其是细胞色素c)释放到细胞质中,激活胱天蛋白酶。胱天蛋白酶一旦被激活,裂解数百种蛋白质,导致细胞快速死亡,且这些死亡细胞具有独特生化和形态特征[15]。在线粒体ATP生成过程中,细胞色素c可在电子传输链的配合物Ⅲ和Ⅳ之间穿梭电子,但进入到细胞质后,就会在三磷酸腺苷(ATP)作用下与衔接蛋白凋亡酶激活因子(aPoPtotic Protease activating factor-1,APaf-1)结合,导致APaf-1 发生别构效应被激活[16]。APaf-1上有和Caspase-9同源的Caspase激活与募集结合域(CRAD),所以激活后APaf-1 会与Cyt-c、Caspase-9结合形成凋亡小体,且在其形成过程中完成对Caspase-9的募集和激活。激活后的Caspase-9会进一步激活其下游信号分子Caspase-3启动凋亡程序,最终引起细胞凋亡[17-19]。本试验中,使用100 μg·L-1MC-LR 处理细胞12 h 后抑制基 因Cyt-c、Caspase-9 和Caspase-3 的mRNA 以及Caspase-9和Caspase-3蛋白表达,从而抑制细胞凋亡。这种抑制作用可能是通过Cyt-c间接抑制线粒体下游途径[20-21],也可能通过ATPase结构域直接和APaf-1 结合,阻碍ProcasPase-9 募集,抑制Caspase 级联反应,保护细胞免受Caspase-3 诱导表达[22]。而用160 μg·L-1MC-LR处理细胞24 h后促进Cyt-c、Caspase-9、Caspase-3、Bax/Bcl-2 基 因mRNA 和Caspase-9、Caspase-3 蛋白表达,进而导致细胞发生凋亡。
3.3 MC-LR处理对细胞周期及基因p53的影响
细胞周期变化直接影响细胞数量变化,通过对S 期细胞比率(S-Phase fraction,SPF)和增殖指数(Proliferous index,PI)计算可了解细胞增殖能力[23]。计算公式为SPF=S/(G0/1+S+G2/M)×100%,PI=(S+G2/M)/(G0/1+S+G2/M)×100%。本试验中,与对照组相比,经12 h 100 μg·L-1MC-LR 处理后细胞处于G0/G1 期数量显著下降,处于G2/M和S期细胞数量显著增加,SPF和PI值均增大,表明此处理条件使细胞周期发生变化,促使细胞发生增殖效应,导致细胞数量增多。
试验结果表明,用100 μg·L-1MC-LR 处理细胞12 h 后,细胞可通过Pi3k-Akt-mTOR 通路获得持续增殖信号,并且阻滞线粒体通路程序性细胞凋亡,此现象具有“肿瘤表征”,所以处理后导致细胞出现癌变趋势。p53基因作为抑癌基因,在抑制细胞癌变方面扮演重要角色。在细胞周期中,p53 调节功能主要体现在G1 和G2/M 期监测校正点,与转录激活作用密切相关。p53 还可通过与p21 和GADD45结合形成复合物,利用自身3'~5'核酸外切酶活性,在DNA 修复中发挥作用。正常情况下,p53 基因对细胞周期有“减慢或监视”作用。细胞中抑制癌变的基因p53 可判断DNA 变异程度,如变异程度较小,p53促使细胞自我修复,使其发挥正常功能。若DNA 变异较大,p53 诱导细胞凋亡[24]。本试验检测p53 基因在用100 μg·L-1MC-LR处理12 h 条件下mRNA 相对表达量,结果显示其相对表达量显著上升,因此认为该处理使细胞发生变异,但因变异程度较小而未产生凋亡效果。
4 结 论
综上所述,100 μg·L-1MC-LR 处理细胞12 h,细胞通过增强Pi3k-Akt-mTOR 信号通路和抑制线粒体凋亡通路促进细胞增殖,导致处于G1期细胞数量减少,G2/M 和S 期细胞数量增加;160 μg·L-1MC-LR 处理细胞24 h,细胞通过活化线粒体凋亡通路发生凋亡。

