外源2,4-表油菜素内酯对镉胁迫下黄瓜幼苗生长及光合生理特性的影响
闫 雷,孙小贺,李 威,曲娟娟,孟庆尧,张钰莹,武志民,苏 捷
(东北农业大学资源与环境学院,哈尔滨 150030)
随着城市化发展,工业“三废”、污水灌溉农田以及农药和化肥大量使用导致土壤重金属污染日趋严重。目前我国农田土壤重金属污染以镉、砷、汞、铅、铜及其复合污染较为严重,其中以镉超标最为突出[1]。重金属镉通过土壤进入植物,导致植物各器官产生毒害,抑制植物光合作用,影响植物生长发育,致使作物减产。不仅如此,镉易被植物吸收并且从根系转移至地上部,通过食物链传递危害动物及人体健康[2]。鉴于此,减少重金属对植物危害、保障蔬菜安全生产是农业生产中亟待解决的问题[3]。
植物激素是植物细胞接受特定环境信号诱导产生、在低浓度时可调节植物生长发育的活性有机物[4]。植物激素在植物防御反应中发挥重要作用,是介导植物胁迫反应关键内源因子[5]。多种植物激素被发现可促进镉胁迫下植物生长发育。褪黑素预处理缓解镉对苜蓿幼苗生长抑制作用[6],外源水杨酸通过增加光合色素和矿质元素减少浮萍镉积累[7]。因此,推测外源激素可减缓重金属胁迫对植物的损伤。油菜素甾醇类物质(Brassinosteroid,BR)是植物中最早发现的一类甾醇类激素[8],表油菜素内酯(EBL)作为BR高活性合成类似物,具有调节细胞伸长与分裂,调控植物种子及根部发育,调节植物光周期、光合作用,提高果实产量和品质等作用[9]。外源EBL已被证实可缓解植物高温、低温、盐、光照和干旱等方面胁迫,EBL刺激酶促和非酶促抗氧化剂生产系统,促进抗氧化防御系统、光合作用、激素稳态以及增加渗透液和大量营养素积累[10-12]。EBL 具有协助植物在逆境环境下修复的潜力。
1 材料与方法
1.1 试验设计与处理
供试黄瓜品种为“津春9号”。选用颗粒饱满黄瓜种子经10%过氧化氢溶液消毒,将种子洗净后播种至全蛭石育苗盘,待黄瓜幼苗长至两叶一心时采用水培法,将黄瓜幼苗移至装有700 mL 全Hoagland营养液黑色塑料盆中,每盆6株,置于人工气候箱中培养(昼/夜16 h/8 h,温度26 ℃/20 ℃,光照强度10 000 lx/0 lx,相对湿度65%),共培养3 周。期间每2 d 更换一次营养液,选取长势一致幼苗开展后续试验。根据预试验结果确定试验浓度并设置3 个处理:T1:镉浓度为0 μmol·L-1,叶面喷施去离子水;T2:镉浓度为100 μmol·L-1,叶面喷施去离子水;T3:镉浓度为100 μmol·L-1,叶面喷施0.5 μmol·L-1EBL,每组处理设置3 个平行。其中镉以CdCl2·2.5H2O形式加入营养液中,每日16:00 叶面喷施EBL 连续3 d,喷至叶面有水珠滴落为止。分别在镉处理2、4、6 d测定地上部和根部镉含量、光合叶绿素荧光相关参数,镉处理6 d测定MDA含量、抗氧化酶活性及观察叶片超微结构,每个试验处理3次重复。
1.2 生物量、株高、根长和Cd含量测定
黄瓜根系采用25 mmol·L-1Na2-EDTA溶液浸泡15 min,去除表面吸附的镉离子[14]。清洗后测量黄瓜幼苗株高、根长并记录鲜重,105 ℃杀青15 min,70 ℃烘干至恒重,记录干重。将干燥样品制成粉末状,根据GB 5009.15-2004 方法用HNO3/HClO4混合物(9/1,V/V)消化处理,砂浴锅(DK-2)于160 ℃加热消解,火焰原子吸收光谱仪(AAS;ZEEnit700P/650P,Analytik-Jena,Germany)测定镉含量。
1.3 叶绿素含量和光合参数测定
采用丙酮-乙醇浸提法测定黄瓜叶绿素含量,根据张宪政方法计算[15]。
GFS-3000 光合作用-荧光测量系统(WALZ,Germany)于9:00~11:00 测定植物顶端第一片完全展开叶净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)及蒸腾速率(Tr)。
1.4 快速叶绿素荧光诱导动力学曲线测定与分析
叶片经暗适应30 min 后,使用手持叶绿素荧光仪(Handy PEA,Hansatech,UK)于10:00~11:00测定黄瓜叶片(从顶端计数第一片叶子)OJIP 曲线。根据Strasser 和李鹏民等方法计算JIP-test 参数[16-17],具体参数及含义见表1。

表1 快速叶绿素荧光诱导动力学曲线(OJIP)分析中使用的参数和公式Table 1 Parameters and formulas used in the analysis of rapid chlorophyll fluorescence induction kinetic curve(OJIP)
1.5 MDA和抗氧化酶测定
分别取0.5 g 新鲜叶片和根系在预冷条件下磷酸缓冲液(pH 7.8)研磨,在4 ℃,12 000 r·min-1条件下离心10 min,取上清液测定。丙二醛(MDA)采用硫代巴比妥酸(TBA)法;超氧化物歧化酶(SOD)采用氮蓝四唑(NBT)还原法;过氧化物酶(POD)采用愈创木酚法[18];过氧化氢酶(CAT)使用南京建成生物有限公司试剂盒测定。
1.6 叶片超微结构观察
将黄瓜叶片切成3 cm×1 cm条状,2.5%戊二醛溶液中前固定,抽真空后用pH为6.8磷酸缓冲液将样品冲洗3 次,1%锇酸后固定。磷酸缓冲液冲洗后分别用浓度为50%、70%、90%乙醇脱水,最后用100%乙醇脱水,浸透包埋后,超薄切片机切成50~60 nm 切片,切片经醋酸双氧铀和柠檬酸铅染色后,透射电镜(JEOLTEM-1230EX,日本)观察拍照。
1.7 统计处理与分析
采用Origin8.5 绘图,SPSS 22.0 软件处理数据,采用One-Way ANOVA作统计分析,Duncan法分析显著(P<0.05)和极显著(P<0.01)差异性,结果用“平均值±标准误差”表示。
2)流程改造后入选细度的大幅增加,大幅改善选别指标,在精矿品位差别不大的情况下,精矿产率提高6.62个百分点,回收率提高12.61个百分点,每年经济效益增加2 053.73万元/a。本研究成果在昆钢集团内部建立了混合铁矿的磨选示范工程,并对公司内部及国内类似矿山混合铁矿选厂提供可借鉴的实践经验。
2 结果与分析
2.1 EBL对镉胁迫下黄瓜植株生长的影响
T1 对照组随时间增加,植物鲜重、干重、株高、根长均呈逐渐上升趋势;T2 镉处理组植物随处理时间增加长势较缓(见图1),表明镉处理对植物生长有抑制作用。T3 与T2处理相比,可不同程度提高植物株高、根长、鲜重、干重,处理6 d时差异显著,株高、根长、鲜重、干重分别较T2处理组升高10.75%、22.68%、16.84%、12.50%,说明叶面喷施EBL 可减轻镉对植物生长的抑制作用。
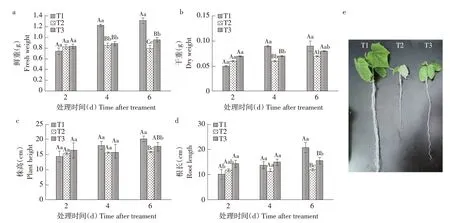
图1 EBL对镉胁迫下黄瓜幼苗鲜重、干重、株高、根长和表型图的影响Fig.1 Effects of EBL on fresh weight,dry weight,plant height,root length and phenotype of cucumber seedlings under cadmium stress
2.2 EBL对镉胁迫下黄瓜植株镉含量的影响
由图2可知,镉胁迫使植物地上部及根部积累大量镉,且随处理天数增加呈递增趋势,表明植物受镉胁迫时间越长,植物镉积累量越大。处理2 d后,T3处理显著抑制植物地上部镉积累,根部镉含量显著上升;处理4 d后,植物地上部和根部镉含量分别较T2镉处理降低22.78%和43.36%,呈极显著抑制作用;处理6 d后,T3处理显著降低植物地上部和根部镉含量,但抑制程度下降。
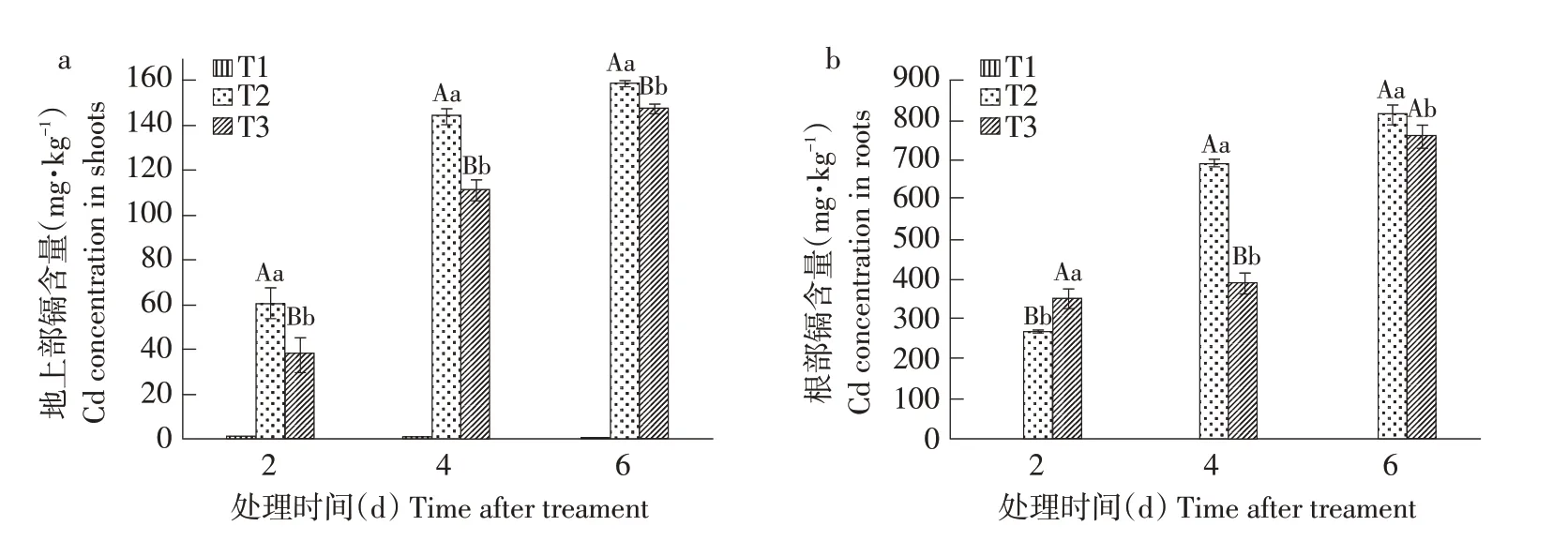
图2 EBL对镉胁迫下黄瓜幼苗地上部和根部镉含量的影响Fig.2 Effects of EBL on cadmium content in shoot and root of cucumber seedlings under cadmium stress
2.3 EBL 对镉胁迫下黄瓜植株叶绿素含量和光合系统的影响
由表2 可见,处理后第2天,T2处理组黄瓜叶片叶绿素a 和总叶绿素含量显著降低,T3 处理镉胁迫下叶绿素a和总叶绿素含量显著增加,分别增加6.21%和4.06%。处理后第4 天,T2 处理导致叶绿素a、叶绿素b和总叶绿素含量呈不同程度降低,与T1 对照相比分别减少30.64%、8.77%、5.22%;而T3处理组叶绿素a和总叶绿素含量显著上升,与T2处理相比分别增加12.41%、8.99%。处理后第6天,T2处理组黄瓜叶片叶绿素a、叶绿素b和总叶绿素含量显著降低,且降幅较大,经T3处理后大幅上升。由表2可看出,随镉处理时间增加,植物叶绿素含量受镉影响越大。叶面喷施EBL显著提高镉胁迫下黄瓜叶片叶绿素a、叶绿素b 和总叶绿素含量,且随镉处理时间增加呈上升趋势。
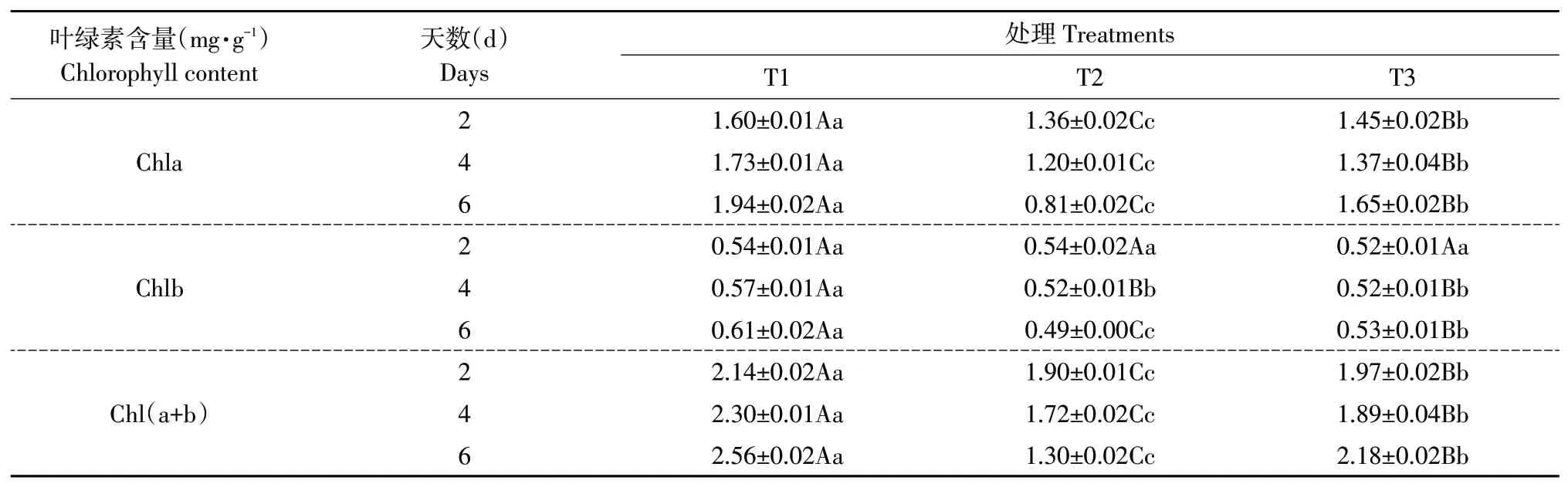
表2 EBL对镉胁迫下黄瓜幼苗叶绿素含量的影响Table 2 Effects of EBL on chlorophyll contents of cucumber seedlings under cadmium stress
由图3可知,处理2、4、6 d后T2镉处理组黄瓜叶片Pn、Tr和Gs显著降低,但第2、6天Ci显著提高。镉胁迫第2 天,T3 处理组黄瓜叶片Pn、Tr、Gs 和Ci 与T2 相比差异显著,分别升高63.58%、83.66%、87.74%和6.57%。处理后第4天,T3 处理显著提高镉胁迫下黄瓜叶片Pn、Tr、Gs 和Ci,分别提高46.13%、40.65%、42.64%、6.44%。处理后第6 天,T2 处理使植物Pn 和Tr 分别较T1 下降76.32%、66.83%,Ci 较T1 升高8.75%。T3 处理显著提高黄瓜叶片Pn 和Tr,对植物Gs无显著影响,Ci则显著下降。
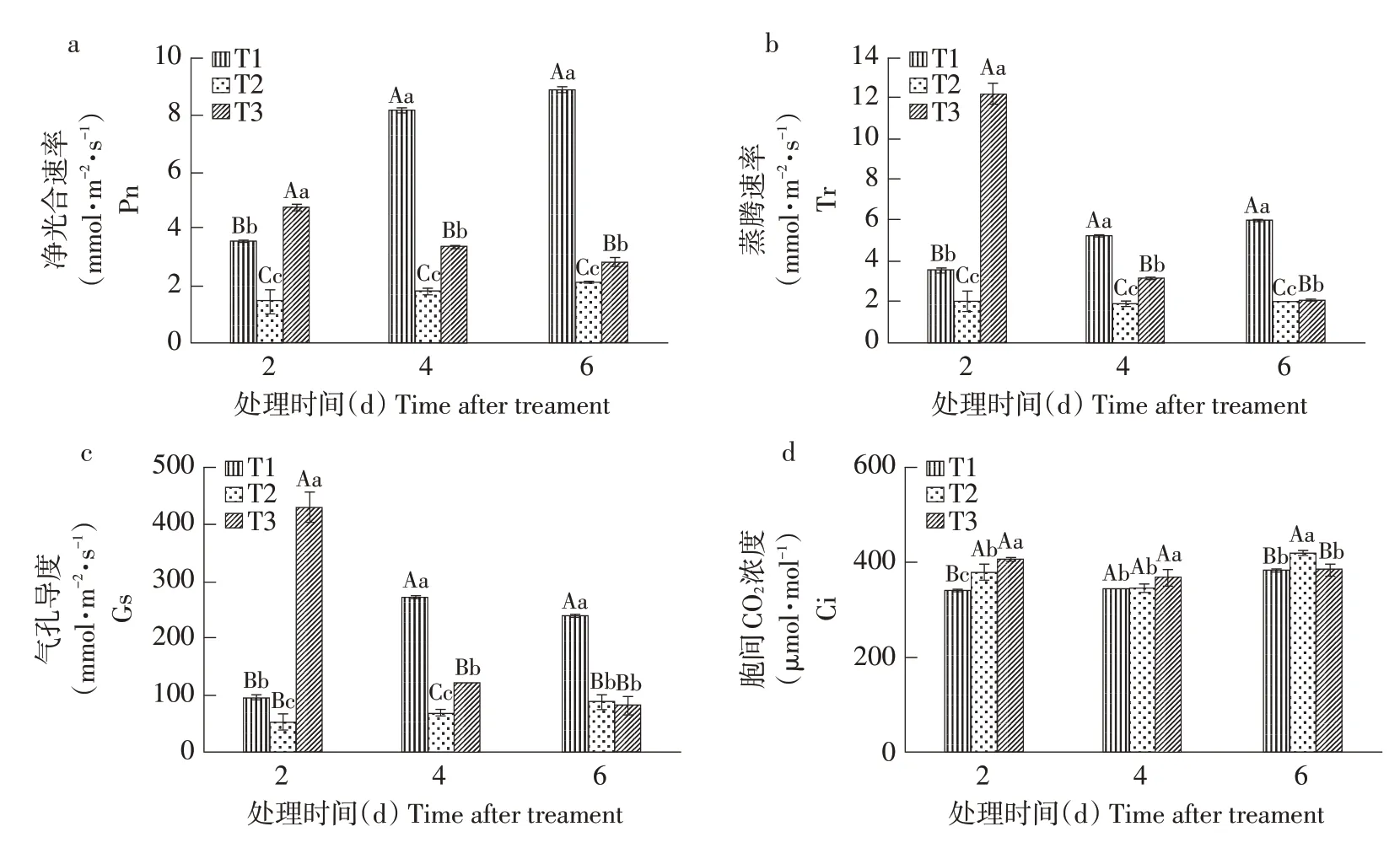
图3 不同处理下黄瓜叶片净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间二氧化碳浓度(Ci)变化Fig.3 Changes of net photosynthetic rate(Pn),transpiration rate(Tr),stomatal conductance(Gs)and intercellular carbon dioxide concentration(Ci)of cucumber leaves under different treatments
2.4 EBL对镉胁迫下黄瓜植株OJIP曲线和荧光参数的影响
2.4.1 EBL对叶片OJIP曲线的影响
与T1 对照处理相比,镉胁迫使不同处理天数下黄瓜叶片OJIP曲线发生形变,I相(30 ms)和P相(Fm)大幅降低。不同处理天数下,T3处理使植株I相(30 ms)和P相(Fm)较T2镉处理明显上升。T3处理在镉胁迫2 d 时J-P 期曲线上升幅度最大,随处理时间增加,J-P 期曲线增幅降低(见图4)。不同处理天数下T2 处理Fo 值高于T1 处理,T3 处理较T2处理下降,但差异不显著。

a、b、c分别表示镉胁迫2、4和6 d。a,b,c represent 2,4 and 6 d of cadmium stress,respectively.
2.4.2 EBL对叶片PSⅡ反应中心的影响
Fv/Fm是可变荧光和最大荧光比值,反映PSⅡ反应中心最大光化学效率。不同天数下T2 镉处理显著降低黄瓜叶片Fv/Fm,随处理时间增加呈先增后降趋势(见表3)。T3 处理则显著增加镉胁迫下Fv/Fm值,随时间变化趋势与T2处理一致。PIABS是基于光能吸收的性能指标,可准确反应植物光合机构性能状态。T2 处理显著降低不同处理天数黄瓜叶片PIABS值,T3 处理下PIABS值高于T2 处理,但仅镉处理2 d时差异显著。
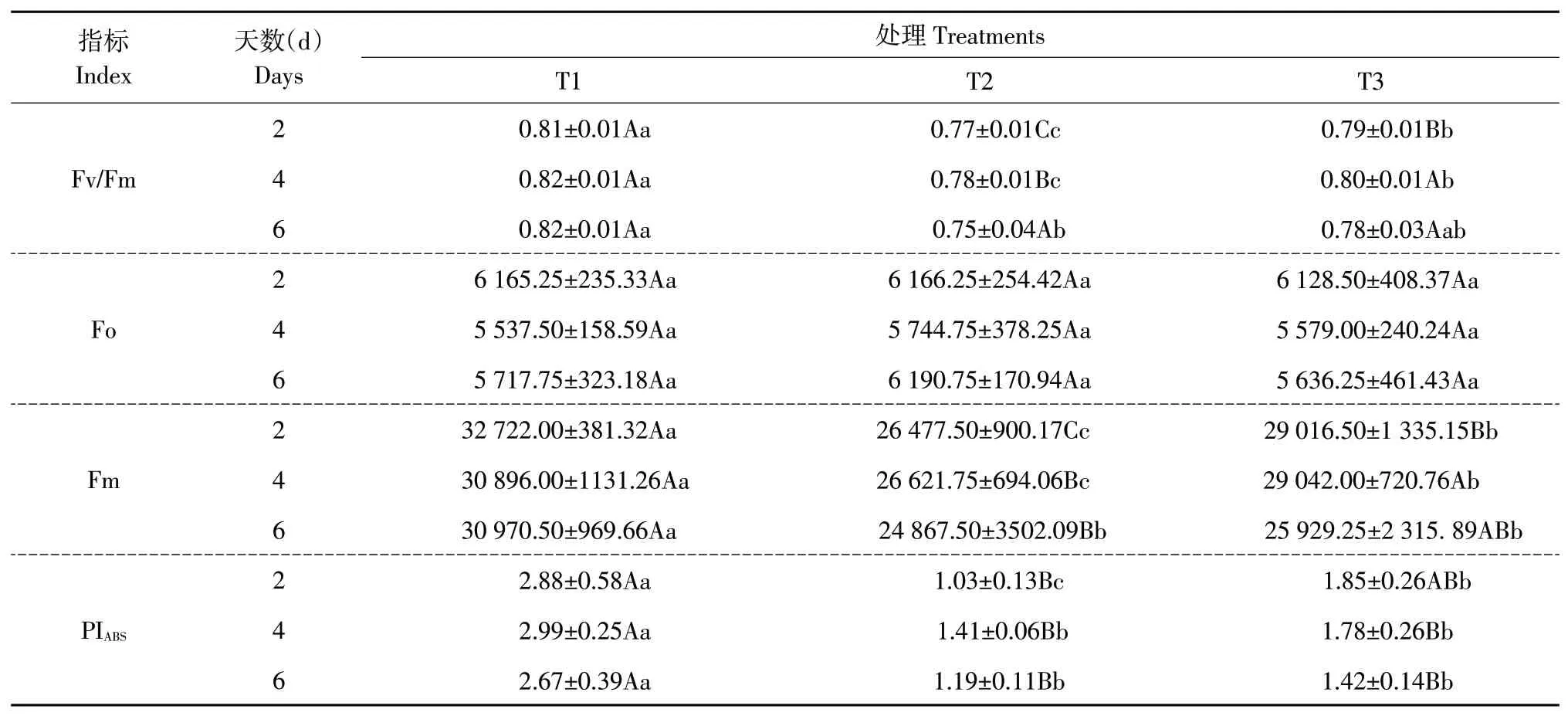
表3 EBL对黄瓜叶片叶绿素荧光参数的影响Table 3 Effects of EBL on chlorophyll fluorescence parameters of cucumber leaves
2.5 EBL 对镉胁迫下黄瓜植株MDA 和抗氧化酶活性的影响
由上述结果可知,镉胁迫6 d 时黄瓜在喷施EBL 后变化显著,故针对镉胁迫6 d植株测定MDA含量、抗氧化酶活性及观察分析叶片超微结构。
MDA 是评价植物膜脂过氧化程度指标。T2 镉处理组黄瓜叶片及根系MDA 含量显著增加,分别较T1对照处理提高47.97%、50.82%。T3处理组植物叶片及根系在镉胁迫下MDA含量与T1对照相比显著升高,分别提高46.59%、45.92%,T3 处理与T2处理相比,叶片及根系MDA含量下降但无显著差异,表明EBL 可适当降低镉胁迫下黄瓜膜脂过氧化程度(见图5a)。如图5b~d所示,T2镉处理显著降低黄瓜叶片及根系SOD、CAT 活性,增强POD 活性,其中叶片SOD、CAT 活性与T1 对照处理相比分别降低28.80%、19.57%,POD 活性增加26.85%,根系SOD、CAT 活性与T1 处理相比分别降低19.29%、27.78%,POD 活性增加38.17%。T3处理组黄瓜叶片SOD、CAT 活性较T2 处理分别增加11.70%、11.90%,POD 活性降低5.92%,黄瓜根系POD、CAT 活性较T2 处理分别增加3.68%、23.53%,SOD活性增加但未见显著差异。
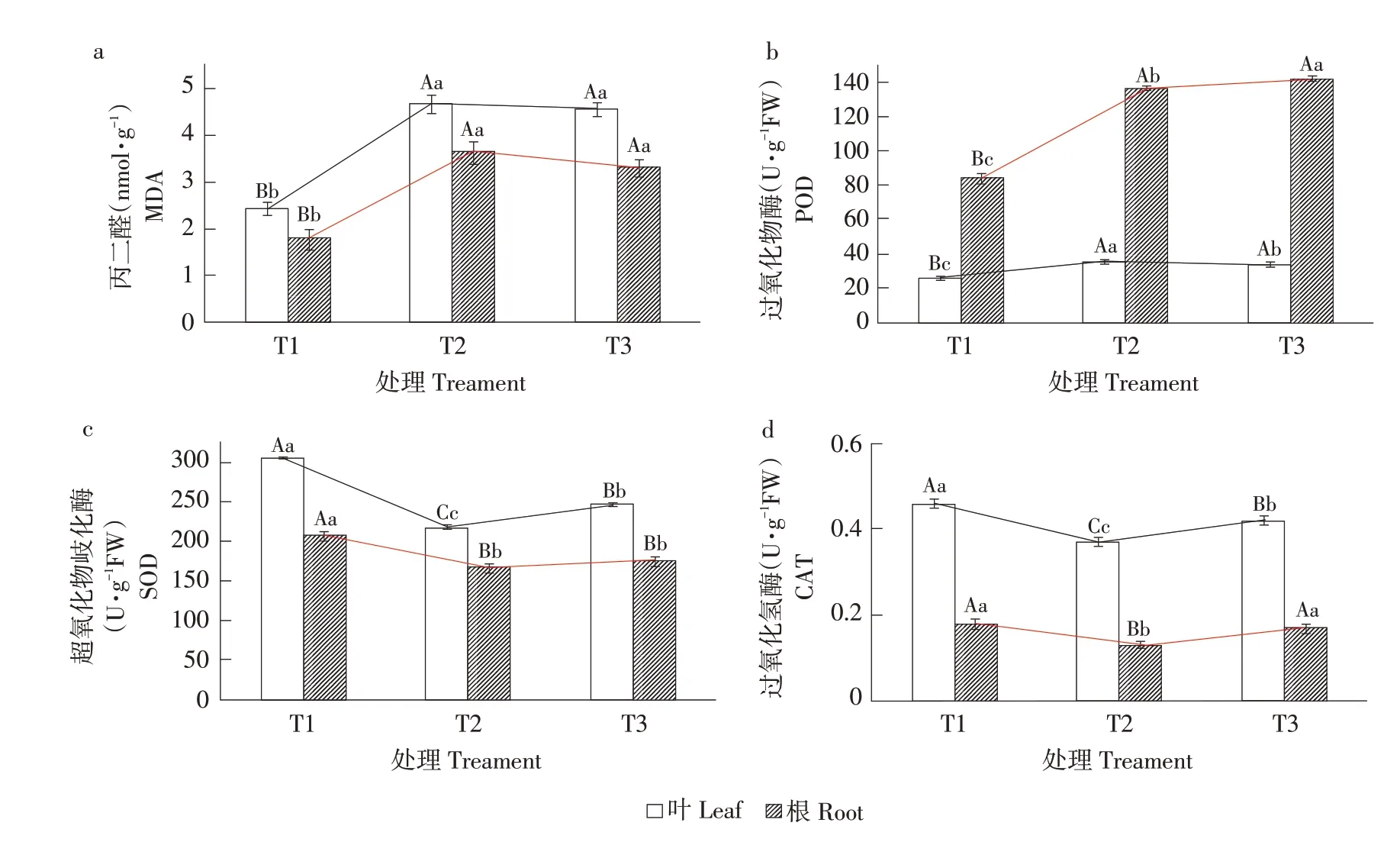
图5 EBL对镉胁迫下黄瓜叶片和根系MDA含量和抗氧化酶活性的影响Fig.5 Effects of EBL on MDA content and antioxidant enzyme activity in cucumber leaves and roots under cadmium stress
2.6 EBL对镉胁迫下黄瓜叶片超微结构的影响
黄瓜叶片经不同处理后超微结构如图6 所示。T1 处理,黄瓜叶片叶绿体呈饱满梭状,叶绿体未见明显肿胀,可见清晰类囊体膜,嗜锇颗粒较多。T2 处理导致细胞叶绿体形变,界膜不清晰,淀粉粒多且体积大,类囊体膜模糊不清,嗜锇颗粒较多,且较大;线粒体受损,结构模糊。T3 处理,叶绿体肿胀变形,类囊体膜较清晰,大基粒朵叠较弱,多为基质片层;嗜锇颗粒相对较少,线粒体结构发生改变。
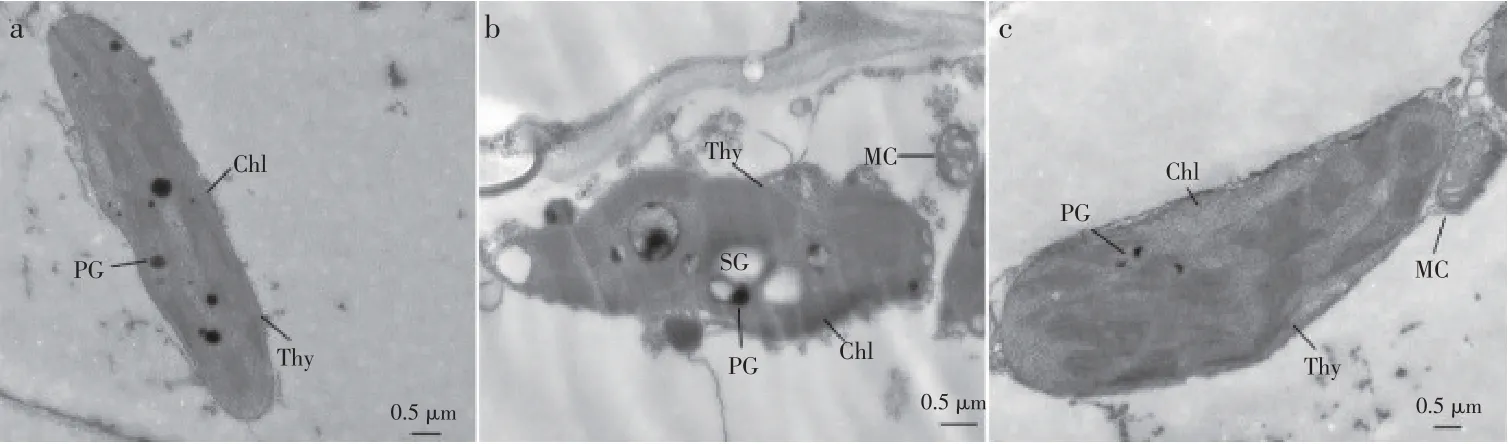
图6 不同处理下黄瓜叶片透射电子显微镜图片(×8000倍)Fig.6 Transmission electron microscope pictures of cucumber leaves under different treatments(×8000 times)
3 讨 论
植物受重金属胁迫导致大量活性氧自由基产生,攻击细胞膜不饱和脂肪酸,导致细胞膜透性增加,抑制植物细胞正常分裂,降低叶片活力,影响植物光合和呼吸作用,损伤细胞结构[19-20]。冯建鹏等发现高浓度镉导致黄瓜叶绿素合成受阻、降解加速,抑制植物叶片光合作用;PSII系统受到损伤,诱导黄瓜叶片SOD、CAT、G-POD 和APX等抗氧化酶活性降低,抑制植株生长[21]。本研究发现,镉胁迫抑制黄瓜生长发育,生物量、株高和根长明显下降,地上部和根部镉含量增加;喷施EBL后增加黄瓜在镉胁迫下株高、根长、鲜重和干重,镉处理第2、4、6天地上部和根部镉含量显著降低。与陆晓民等在叶面喷施EBL 通过提高黄瓜幼苗叶片抗氧化酶活性、降低MDA 含量及细胞膜透性,有效缓解光合速率下降,提高氯化钠胁迫下黄瓜幼苗鲜质量及地下部干质量促进幼苗生长研究结果相近[22]。Nazir等研究表明,BRs维持铜胁迫下番茄形态和生理生化特性[23]。在铜胁迫条件下,叶面添加EBL 显著提高光合效率、气孔运动、根系形态、细胞活力、叶绿体超微结构完整性,促进植物根和地上部对Ca2+、K+、Fe2+和Mg2+吸收,降低地上部和根部铜积累,最终促进番茄生长。Xie等证实EBL 可通过刺激抗氧化酶和减少金属吸收降低苋菜镉含量[24]。因此推测EBL可能通过促进其他离子吸收和维持离子稳态减少镉积累,缓解镉胁迫对黄瓜生长的抑制作用,有待进一步深入研究。
有关油菜素内酯研究表明,EBL通过提高植物抗氧化酶活性减少活性氧过度累积、减轻膜脂过氧化作用,稳定细胞膜结构与功能,防止叶绿素降解,提高其光合性能,使植物可应对生物或非生物环境胁迫[25-26]。本研究也显示,镉胁迫下黄瓜叶片和根系MDA 含量、过氧化物酶(POD)活性上升,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性显著下降。与单独镉处理相比,叶面喷施EBL黄瓜SOD、POD、CAT 活性显著上升,MDA 含量降低。与Ghassemi-Golezani 等在黑芥菜上研究结果一致[27]。Li等发现外源EBL降低水分胁迫下文冠果MDA 和活性氧含量,增加叶片含水量,提高抗氧化酶活性,最终促进幼苗生长[28]。张盛楠等证明,外源施用EBL 可通过增加水稻根部和地上部POD 和CAT 活性减轻膜脂过氧化程度,降低镉对水稻的毒害作用[29]。表明外源EBL通过诱导抗氧化物酶活性提高黄瓜抗氧化能力,清除植物体内产生的过量活性氧降低膜脂过氧化程度,从而缓解Cd毒害作用。
光合作用是生物体将光能转化为化学能的过程,是自然界中最重要化学反应之一。逆境条件影响光合作用,且不同植物、不同环境胁迫中光合障碍机理不同[30]。本研究发现,镉胁迫对黄瓜叶绿素含量、光合气体交换参数、细胞膜结构以及叶绿素荧光产生不利影响。这种影响可能是由于PSII 系统QA-到QB 电子传递过程受阻,阻碍叶绿素生物合成,破坏叶肉组织,光合酶可行性降低,叶片气孔数量和尺寸减少并影响CO2吸收[19]。吴秀等研究显示油菜素内酯可通过增强活性氧的清除、调节内源多胺含量变化,降低不利环境对光合器官造成的伤害[31]。Dong等研究发现油菜素内酯应用可增加大豆叶绿素含量,维持较高光能转化潜力,缓解铝胁迫对PSII 原初光化学反应及光合机构状态和结构的破坏[32]。Peng等研究表明镉影响龙葵正常生长,叶面喷施EBL 可通过提高光合色素含量改善光合性能、降低氧化损伤等,减轻镉对龙葵幼苗生长抑制效应[33]。因此,EBL可通过调节光合作用提高植物对重金属胁迫耐性。本研究也发现,与单独镉处理相比,叶面喷施EBL 黄瓜叶绿素含量、Pn、Tr、Gs、Fv/Fm、PIABS显著上升,OJIP曲线在J-P期较镉处理明显升高,细胞膜结构较为完整。表明EBL 通过对PSII 反应中心产生保护作用,减轻镉胁迫对黄瓜叶片的损伤[34]。在光合时间相同条件下,叶面喷施EBL 显著提高镉胁迫下黄瓜幼苗光合性能,有助于增强植物耐镉能力,但随镉处理时间增加呈降低趋势,说明EBL效应期较短,实际应用应注意补施。
综上,叶面喷施EBL 能够缓解重金属镉胁迫,后续将从分子生物学角度进一步研究缓解机制。
4 结 论
100 μmol·L-1镉胁迫降低黄瓜幼苗抗氧化酶活性,加剧膜脂过氧化程度,破坏类囊体膜结构,抑制其光合作用,降低生物量,增加镉积累量。叶面喷施0.5 μmol·L-1EBL 有助于维持镉胁迫下黄瓜幼苗叶绿体正常功能,通过提高抗氧化酶活性、清除体内过量活性氧,减轻细胞膜脂过氧化程度,保护PSII反应中心,提高光合色素含量和净光合速率从而提高光合性能,减轻镉积累、减弱镉毒害,维持黄瓜幼苗正常生长发育。

