发酵食品中产细菌素乳酸菌的筛选与鉴定
辛 婷,郭潇扬,王 钊,苏 楠
(河南牧业经济学院 食品与生物工程学院,河南 郑州 450046)
近年来,食品安全问题一直被人们密切关注,食品在加工、贮藏以及运输过程中容易受到腐败微生物的污染,导致感官品质下降或者腐败变质。在食品工业化生产中,为了预防食品变质和延长保质期,常常采用添加防腐剂的方法。常用的防腐剂大多为化学制剂,长期食用会对人体健康造成危害,因此,寻找新型替代品已成为目前的研究热点。
乳酸菌素能够使食品保持原有的风味和组织状态,抑制病原菌及腐败菌的生长,最终达到防腐和延长食品保质期的效果[1]。研究表明,乳酸菌及乳酸菌素对肉制品、乳制品、水产品、面包等均能起到良好的保鲜作用,目前研究最多且应用最广泛的是乳酸链球菌素,它已被50多个国家和地区广泛应用[2]。
乳酸菌素作为一种天然防腐剂,应用范围非常广阔,如将乳酸菌素直接添加到食品中,不仅可以起到有效的防腐作用,还可以增加食品风味;将其制成保健品用于医药工业,可有效改善胃肠道功能、增加机体免疫力。将乳酸菌作为发酵剂添加到泡菜、酸菜、酸奶等发酵食品中,同样能起到抑菌作用。
本研究主要从发酵食品中分离并筛选出有广谱抑菌作用的产细菌素乳酸菌,以期得到天然的具有食品防腐潜力的细菌素,为其在食品工业中的应用奠定基础。
1 材料
1.1 试验材料
光明畅优风味发酵乳、花花牛益生菌风味发酵乳、伊利牧场清晨风味发酵乳、光明植物活力乳酸菌饮料、养乐多活菌型乳酸菌饮料、孝感米酒、海天苹果醋、海天黄豆酱、聚味特萝卜条及各种家庭自制泡菜(西瓜酱、酸白菜、黄瓜条、糖蒜等)。
指示菌株大肠杆菌、志贺氏菌、沙门氏菌、单核细胞增生李斯特菌、金黄色葡萄球菌均由河南牧业经济学院食品与生物工程学院实验室保藏。
1.2 试验试剂
MRS培养基、牛肉膏、酵母浸粉、缓冲蛋白胨均购于北京陆桥技术有限责任公司,氯化钠、碳酸钙、葡萄糖、吐温80、磷酸二氢钾、乙酸钠、柠檬酸三铵、硫酸镁、硫酸锰、琼脂(粉)、乳酸、氢氧化钠、盐酸均购于天津市大茂化学试剂厂,过氧化氢酶、胃蛋白酶、木瓜蛋白酶、胰蛋白酶均购于国药集团化学试剂有限公司。
1.3 试验仪器及设备
微量高速冷冻离心机(湖南赫西仪器装备有限公司)、智城恒温培养振荡器(上海智城分析仪器制造有限公司)、生化培养箱(上海福玛实验设备有限公司)、电热式压力蒸汽灭菌器(浙江新丰医疗器械有限公司)、电热恒温水浴锅(金坛市希望科研仪器有限公司)、漩涡混合器(海门市其林贝尔仪器制造有限公司)、超净工作台(苏州净化设备有限公司)、显微镜(麦克奥迪实业集团有限公司)。
2 试验方法
2.1 产细菌素乳酸菌的初筛、分离纯化
准确称取试验所选酸奶、乳酸菌饮料、米酒、苹果醋、黄豆酱、萝卜条及家庭自制泡菜,将样品与MRS液体培养基按照1∶10的比例进行混合增菌,恒温培养箱37 ℃培养17 h,用生理盐水制备成梯度稀释液,移取200 μL适宜的梯度稀释液,涂布接种于含1.0%碳酸钙的MRS固体培养基中,37 ℃恒温培养48 h[3]。
从初筛的菌株中挑取周围有透明溶钙圈的单个菌株,在含碳酸钙的培养基中用平板划线法将其进行分离纯化,37 ℃培养48 h。取1环菌苔接种于LB固体斜面培养基中,37 ℃培养24 h后,将其放置到4 ℃冰箱中备用。
2.2 试验菌株发酵上清液的制备
从纯化后的试验菌株中挑取3环菌苔接种于MRS液体培养基中制成种子液,37 ℃恒温培养24 h,将种子液与MRS液体培养基按照1∶50的比例混匀,37 ℃恒温培养 24 h后,置于4 ℃、5 000 r/min的条件下离心15 min,取发酵上清液备用[4]。
2.3 指示菌菌悬液的制备
以大肠杆菌为例,其他4种指示菌沙门氏菌、志贺氏菌、单核细胞增生李斯特菌和金黄色葡萄球菌皆采用同样的方法制备。取1环大肠杆菌接种到LB固体斜面培养基中,37 ℃恒温培养24 h,然后挑取3环菌苔接种到LB液体培养基中,将其置于37 ℃、120 r/min的条件下摇床培养24 h,再将指示菌菌悬液进行适宜的梯度稀释,于4 ℃冰箱中保存备用[4]。
2.4 抑菌试验
采用双层琼脂扩散法进行抑菌试验[5],通过测量抑菌圈直径的大小来判断乳酸菌的抑菌效果。具体的试验操作流程如下(以大肠杆菌为例)。
培养皿底层倾注15 mL左右的LB固体培养基→待其完全凝固后均匀放置3个牛津杯→准确移取100 μL大肠杆菌菌悬液与10 mL(灭菌后温度保持在50 ℃左右)LB半固体培养基均匀混合→倒平板→待培养基凝固后拔出牛津杯→在打好的孔内加入70 μL试验菌株的发酵上清液→4 ℃冰箱中静置扩散3 h→37 ℃培养12 h→测量抑菌圈的直径→求其平均值→记录数据。
2.5 抑菌物质的确定
2.5.1 有机酸排除试验
用乳酸将MRS液体培养基调至与试验菌株发酵上清液相同的pH值,以志贺氏菌和单核细胞增生李斯特菌为指示菌进行抑菌试验。若上清液的抑菌圈直径大于同pH值乳酸抑菌圈的直径,则认为发酵上清液所起的抑菌作用不完全是由有机酸引起[6]。
2.5.2 过氧化氢排除试验
将过氧化氢酶用0.05 mol/L(pH值为7.0)磷酸盐缓冲溶液溶解配置成10 mg/mL的酶溶液,再将配好的酶溶液与同pH值的发酵上清液等体积混合,使过氧化氢酶溶液的最终质量浓度为5 mg/mL。37 ℃水浴2 h后调回原发酵上清液的pH值,进行抑菌试验,以未经过氧化氢酶处理的发酵上清作为空白对照[7]。
2.5.3 蛋白酶敏感试验
将胰蛋白酶、木瓜蛋白酶和胃蛋白酶分别用pH值为7.6、6.0、2.0的0.05 mol/L磷酸盐缓冲溶液配置成2 mg/mL的酶溶液,同时将发酵上清液调至各蛋白酶的最适pH值,将发酵上清液与蛋白酶溶液按照1∶1的比例混合匀,37 ℃水浴2 h后调回原发酵上清液的pH值,进行抑菌试验,以未经蛋白酶处理的发酵上清液作为空白对照[8]。
2.6 产细菌素乳酸菌的鉴定
2.6.1 菌落形态
在无菌条件下挑取1环抑菌效果最佳的菌株接种于10 mL的无菌生理盐水制备成菌悬液。充分混匀后移取200 μL菌悬液涂布接种到MRS固体培养基中,37 ℃恒温条件下培养48 h。观察该菌株的菌落形态、色泽、大小、质地以及边缘等基本特征,随后挑取1环菌苔进行革兰氏染色,观察菌落的染色情况。其中革兰氏染色步骤如下。
载玻片中央滴加1滴无菌生理盐水→挑取1环菌苔在水滴中涂匀→自然晾干→草酸铵结晶紫初染1 min→水洗→碘液媒染1 min→水洗→95%乙醇脱色30 s→水洗→复红复染1 min→水洗→自然晾干→镜检→油镜下观察菌落的个体形态。
2.6.2 生理生化试验
以《乳酸细菌分类鉴定及实验方法》[9]和《常见细菌系统鉴定手册》[10]中乳酸菌生理生化鉴定试验要求为参考依据,对试验菌株进行鉴定,其中生理生化试验主要包括以下几个方面[11-14]:
(1)过氧化氢酶试验
载玻片中央滴加1滴10%的H2O2,挑取1环菌苔在H2O2上涂匀,观察是否有气泡产生,若有气泡则为阳性反应(用+表示),反之为阴性(用-表示)。
(2)明胶液化试验
将供试菌株采用穿刺的方法接种于明胶培养基中,置于37 ℃条件下恒温培养24 h,空白对照不接菌。由于明胶培养基的组织状态对温度较为敏感,≥24 ℃呈液态,≤20 ℃呈固态。因此,在观察时应进行低温处理,观察试验管是否液化。若试验管液化,则说明为阳性反应(用+表示),反之为阴性(用-表示)。
(3)吲哚试验
将试验菌株接种于缓冲蛋白胨水培养基中,以未接菌的试管为空白对照,将其置于37 ℃恒温培养24 h。在培养基中加入1 mL乙醚充分振荡,静置几分钟,待培养液与乙醚出现分层时,沿着试管壁加入10滴吲哚试剂,观察乙醚层的变色情况。如果乙醚层呈玫瑰红色,说明试验菌株能够产生吲哚,视为阳性反应(用+表示),反之为阴性(用-表示)。
(4)淀粉水解试验
根据淀粉遇碘变蓝的原理,将试验菌株接种到淀粉培养基中,37 ℃恒温培养 24 h,滴加少量碘液于培养基表面,缓慢旋转平皿,使碘液铺满整个平板,观察平板上的颜色变化。如果培养基呈蓝黑色,菌落周围无色则表明淀粉水解为阳性反应(用+表示),反之为阴性(用-表示)。
(5)乙酰甲基甲醇试验(VP实验)
将试验菌株接种到葡磷胨水生化管中,同时以未接菌的生化管作为空白对照,封口后置37 ℃培养48 h。滴加甲液(6% α-萘酚酒精溶液)和乙液(40% KOH溶液),几分钟后若试验管呈红色则为阳性反应(用+表示),反之为阴性(用-表示)。
(6)糖发酵试验
将试验菌株接种于各类糖发酵生化管中,以未接菌的糖发酵生化管作为空白对照,封口后置37 ℃培养24 h,观察培养液的颜色变化。若呈黄色为阳性反应(用+表示),反之为阴性(用-表示)。
3 结果与分析
3.1 产细菌素乳酸菌的初筛结果
将增菌培养后的样品采用涂布的方法接种于含碳酸钙的MRS培养基,菌落周围产生透明溶钙圈的菌株则为试验菌株[15],试验初步筛选得到13株有溶钙圈的菌株,并将其编号为A1~A13。
3.2 抑菌试验结果
将初步筛选出的试验菌株进行抑菌试验,得到9株对革兰氏阳性菌和阴性菌有抑制作用的乳酸菌。从表1的数据中可以得出,大多数乳酸菌发酵上清液对志贺氏菌和李斯特菌有较强的抑制效果,抑菌圈直径达到21 mm左右;小部分乳酸菌发酵上清液对金黄色葡萄球菌的抑制作用也较明显,如A5、A7、A11、A13,它们的抑菌圈直径均在19 mm以上。从整体上看,复筛得到的9株乳酸菌A1、A2、A3、A4、A5、A7、A10、A11、A13均具有广谱的抑菌能力。因此,选择这9株菌株进行下一步试验。

表1 发酵离心上清液的抑菌效果 mm
3.3 抑菌物质的确定
3.3.1 有机酸排除试验结果
乳酸菌对指示菌的抑菌效果有可能是细菌素在起作用,但也不排除是有机酸的影响,因此,在试验过程中需排除有机酸的干扰[16]。以志贺氏菌和李斯特菌为指示菌进行抑菌试验,比较发酵上清液与同酸度乳酸之间的抑菌效果。从表2的试验结果可以得出,菌株A1、A3、A4、A5、A10、A11发酵上清液的抑菌圈略大于同pH值乳酸的抑菌圈,乳酸作用的比重均高于75%,说明这6株乳酸菌所起到的抑菌作用一定程度上是由有机酸引起的[17];而菌株A2、A7、A13发酵上清液中乳酸作用比重均低于70%,其中A2排酸后的抑菌效果最佳,说明这3株乳酸菌对指示菌的抑制作用并不单纯是由酸性物质所引起,其中还存在其他的抑菌物质[18],是否是细菌素的作用还需进一步验证。因此,选择A2、A7、A13 3个菌株做进一步的过氧化氢排除试验。

表2 排除有机酸干扰的抑菌试验
3.3.2 过氧化氢排除试验结果
在排除有机酸的干扰后仍需进一步排除过氧化氢所起到的抑菌作用,由表3的数据中可以看出,试验菌株经过氧化氢酶处理后与对照组相比,抑菌活性下降,这说明有部分抑菌作用是由过氧化氢所引起[19]。

表3 排除过氧化氢干扰后的抑菌试验结果
3.3.3 蛋白酶敏感试验
经排除有机酸和过氧化氢的干扰后,通过蛋白酶敏感试验进一步确定抑菌物质的性质。从表4的试验数据中可分析得出:A2、A7、A13菌株发酵上清液经不同蛋白酶处理后,抑菌效果不同程度下降。由此可见,发酵上清液所产生的抑菌物质具有蛋白质的性质,即发酵上清液中的抑菌物质有细菌素[20]。
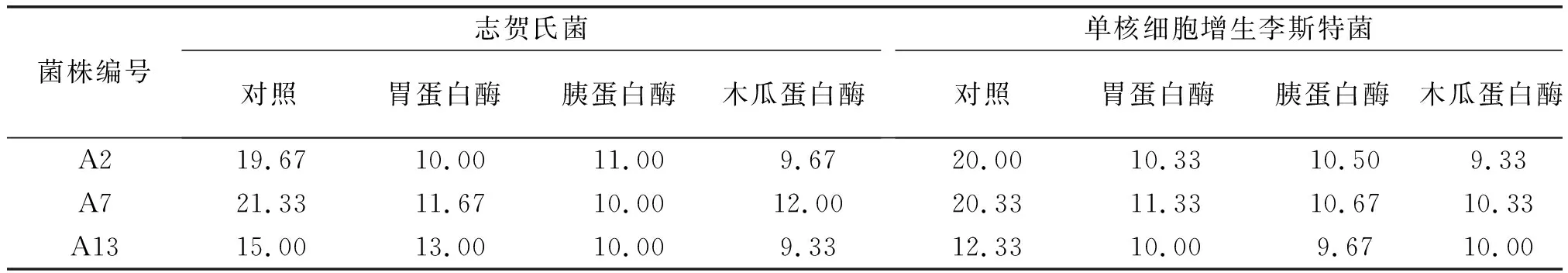
表4 经不同蛋白酶处理后的抑菌试验结果 mm
3.4 产细菌素乳酸菌的鉴定
3.4.1 形态学鉴定结果
经有机酸、过氧化氢排除试验以及蛋白酶敏感试验得出菌株A2、A7、A13发酵上清液中含有细菌素。结合表1可知,菌株A2对5株指示剂的整体抑菌效果最佳。将A2制备成菌悬液涂布于MRS固体培养基,经37 ℃培养48 h后观察。在MRS固体培养基上,菌株A2的菌落形态呈乳白色、较小的圆形、菌落表面光滑、边缘整齐、中央微微凸起(图1A)。经革兰氏染色呈阳性,在显微镜下观察该菌株呈规则的杆状,以单个或者短链状的形式排列(图1B)。

A.菌落形态;B.革兰氏染色图1 菌株A2的形态学鉴定
3.4.2 生理生化试验鉴定结果
由表5生理生化试验结果可以得出,该试验菌株能够发酵葡萄糖产酸,过氧化氢酶试验结果呈阴性,不能够液化明胶,不产生吲哚,不能够水解淀粉,VP实验结果呈阳性,能够发酵葡萄糖酸盐。由此可确定该菌株属于兼性异型发酵菌群。根据形态学观察及生理生化试验,初步鉴定A2为植物乳杆菌。
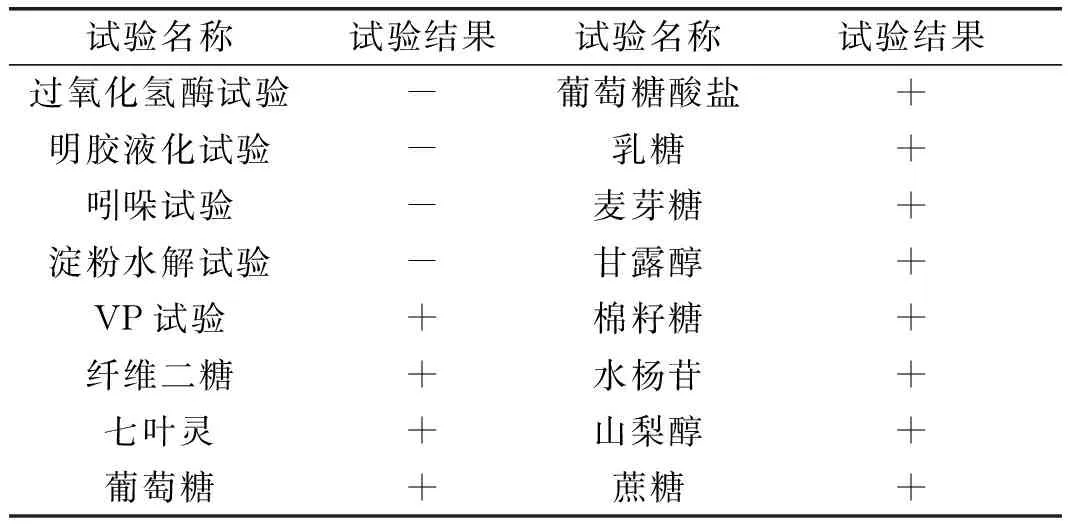
表5 乳酸菌A2生理生化特征
4 讨论与结论
本试验从多种发酵食品中筛选出9株具有一定抑菌活性的乳酸菌菌株,由于乳酸菌所产的抑菌物质有多种,是否是细菌素需进一步验证。经有机酸排除试验、过氧化氢酶试验、酶敏感试验证实上清液中如存在蛋白质类物质,则认为是细菌素[21,22]。最终,通过试验得到菌株A2、A7、A13能发酵产细菌素,其中A2抑菌效果最佳。
菌株A2具有广谱的抑菌性,不仅对2种常见的革兰氏阳性致病菌(单核细胞增生李斯特菌和金黄色葡萄球菌)具有很好的抑制作用,而且对3种革兰氏阴性致病菌(大肠杆菌、志贺氏菌、沙门氏菌)的抑制效果也很显著,尤其是抑制志贺氏菌和单核细胞增生李斯特菌的效果最佳,发酵上清液的抑菌圈直径分别达到23.33 mm和22.33 mm,高于较多文献中抑菌圈直径值。刘树昕等[23]从新疆传统酸奶中筛选出1株广谱抑菌乳酸菌B6,对金黄色葡萄球菌抑菌效果最佳,抑菌圈直径为20.76 mm。沈勇等[24]从花鲈鱼肠道中筛选出1株产细菌素粪肠球菌,发酵上清液对大肠杆菌的抑菌圈直径为16.58 mm。刘义等[25]从西南地区泡菜汁中筛选出1株产细菌素乳酸菌QH18-4,对大肠杆菌抑菌效果最佳,抑菌圈直径小于15 mm,对单核细胞增生李斯特菌抑菌圈直径小于10 mm。
经形态学观察及生理生化试验,初步鉴定菌株A2为植物乳杆菌。由于生理生化试验具有一定的局限性,下一步将结合16S rDNA测序结果进行进一步的鉴定。

