不同解冻方法对猪冷冻精液品质的影响
郝爱玲,曲云淼,张 祺,李孝娟,金 金,潘丽娜,赵一丹,于达恒,张 宇
(1.黑龙江省畜牧总站,哈尔滨 150069;2.广东省汕尾市农业科学院,广东 汕尾 516600)
家畜精液冷冻保存技术研究主要始于20世纪50年代,C.Polge等用甘油作冷冻保护剂,使牛、羊等许多哺乳动物的精液得以成功冷冻保存。但猪精液冷冻保存技术研究进展比较缓慢,采用猪冷冻精液进行人工授精的比例尚不足1%。生产上对猪精液冷冻技术的研究一直没有突破性进展,直到最近几年才在猪精液稀释液、解冻液、冷冻保护剂及冻精剂型等方面取得了一些研究成果,但对冷冻-解冻机制方面尚不十分清楚,还处于探索阶段。目前猪冷冻精液的应用比例仍然较低,主要用于种质资源保存及种猪场引种等。与其他家畜精子相比,猪精子不抗冻,对低温和冷冻都很敏感,在冷冻和解冻过程中更易受到损伤;解冻后精子复苏率较低,异常精子多,受胎率和产仔率低。由于猪精子对温度非常敏感,即使稀释液中加入了适当的保护剂并在适当的温度下冷冻,也必须使用适当的解冻方法才能保证解冻后的精子活力。适宜的解冻方法可以使精子快速通过精子冷冻的危险温度区,减少精子细胞的损伤。目前国内外对猪精液的冷冻方法研究得比较多,但对解冻方法和解冻程序研究得还不够深入。为此,本试验采用两种解冻方法对猪细管冻精进行解冻,检测了精子活力、生存时间和顶体完整率,试图找到更合适的猪精液解冻方法,现报道如下。
1 材料
1.1 冻精样品
猪细管冷冻精液,购自河南某公司。包括长白、大白、杜洛克三个品种20头份冻精,每头份4支,共计80支冻精。冻精规格为0.5 mL/支。
1.2 主要设备及器材
带有加温装置的相差显微镜(型号为OLYMPUS BX41),购自奥林巴斯(北京)销售服务有限公司;数显式恒温水浴锅(型号为HH·W21·420,温度控制在±0.1℃)3台、移液器(Eppendorf、0.5~10.0μL)1个、秒表3块、大镊子2把、温度计(0~100℃)3支、试管架、试管、毛巾、10μL枪头、载玻片、盖玻片、剪刀(细管冻精专用)、记号笔、血球计数器等,市购。以上设备及器材均由黑龙江省畜牧总站家畜冻精检测实验室提供。
1.3 主要试剂
猪冻精解冻稀释液,购自河南某公司(与猪细管冷冻精液来源一致);吉姆萨(Giemsa)染液、固定液、香柏油等,市购。
2 方法
2.1 试验准备
2.1.1 解冻稀释液的制备 将稀释粉按照说明加入纯化水,充分溶解后分装在2个三角烧瓶中,分别放到38℃和30℃恒温水浴锅中,备用。
2.1.2 校准水浴锅温度 试验前将实验室温度控制在25℃左右。分别取3支经权威部门检定过的温度计,对3个恒温水浴锅进行校准,1号水浴锅校准至38℃,2号校准至50℃,3号校准至30℃。
2.1.3 器材准备及显微镜预热 提前准备好大镊子、剪刀等器材,并打开显微镜加温板提前预热。
2.2 猪冷冻精液的解冻
将猪冷冻精液分成2组,每组20头份40支,1组为38℃水浴直接解冻30 s,2组为50℃水浴解冻16 s后再放到30℃水浴中静止40 s。
1组:从液氮罐中抽取同一号码的2支0.5 mL细管冻精,迅速放入38℃恒温水浴锅内,同时按下秒表;用镊子夹住细管在水中摆动几下,30 s后用镊子取出细管;用毛巾擦干,剪开超声波封口端,用精液杵棒杵棉塞端将精液杵进试管中,并逐步加入稀释液进行稀释,摇匀后用移液器取样,镜检。
2组:取2支和第一种解冻方法相同号码的冻精,迅速放入50℃恒温水浴锅内,同时按下秒表;16 s后放入30℃恒温水浴锅中,静置40 s后取出;后续操作同第一种方法。
2.3 猪冷冻精液解冻后的质量检测
2.3.1 冻后精子活力检查 首先检查相差显微镜加温板温度是否达到37℃,用移液器吸取10μL稀释摇匀后的精液,滴在载玻片上;盖上盖玻片,在200倍显微镜下选择不同视野观察前进运动的精子百分数,并调整相差显微镜观察不同层次的精子运动情况,多观察几个视野全面评定精子活力。对两种解冻方法解冻的精液分别进行活力检测并做好记录。1组和2组分别检测20头份猪冷冻精液样品。2.3.2 生存时间检查 将检查完活力的精液做好标记,继续放置在37℃恒温水浴锅中保存,分别在1,2,3,4 h后再检查活力。这项指标主要用来检查解冻后精子的生存能力,即观察精子在一定环境条件下维生命活动的时间,一般以37℃环境条件下保存,4 h内的精子活力来验证。
2.3.3 顶体完整率检查 制片:解冻后的精液用移液器吸取10μL滴在载玻片一端,用凹玻片利用拖片法将精液均匀拖布于载玻片上,制成均匀的精液抹片,自然干燥;用40%甲醛固定液固定,15 min后用清水冲去固定液,吹干或自然风干;用吉姆萨染液染色90 min,再用清水缓缓冲去染液,自然干燥后镜检。将两种方法解冻的精液分别制作顶体片,并用记号笔做好标记。
镜检:先用低倍镜找到精子密度适中的视野,再转到1 000倍油镜下仔细观察。顶体形态基本分为正常(顶体部分着色均匀、顶脊明显)、轻度膨胀(顶脊部分染色深浅不一、顶脊消失)、严重膨胀(顶体边缘膨大呈冠状)、顶体脱落(顶体部分脱落或全部脱落、细胞核裸露)。根据上述精子顶体形态分类仔细观察每个视野的精子形态,每张片子共检查300个精子,计算顶体完整精子所占百分数,即为顶体完整率。
2.4 数据的统计分析
试验数据采用SPSS统计分析软件进行配对检验。
3 结果与分析
3.1 不同解冻方法对解冻后精子活力的影响
分别将冻精在38℃水浴直接解冻30 s(1组)、50℃水浴解冻16 s后再放到30℃水浴中静置40 s(2组),结果表明,解冻后2组精子活力极显著高于1组(<0.01),见表1。

表1 采用不同解冻方法解冻后的精子活力测定结果Tab.1 Determination of sperm motility after thawing by different thawing methods
3.2 不同解冻方法对精子生存时间的影响
两组冻精解冻后精子活力下降速度都很快,1 h后已经有近50%检测样品精子活力降至0.10以下,3 h后60%以上样品精子活力降为0,4 h后两组精子活力几乎全部为0,各时间点组间均差异不显著(>0.05)。
3.3 不同解冻方法对精子顶体完整率和顶体形态的影响
两组冻精解冻后,2组精子顶体完整率极显著高于1组(<0.01),见表2。
表2 采用不同解冻方法解冻后的精子顶体完整率测定结果Tab.2 Determination of sperm acrosome integrity rate after thawing by different thawing methods
检测过程中发现顶体膨胀、顶体脱落的数量都很多,见图1和图2;而且1组比2组顶体损伤更为严重。

图1 精子顶体损伤情况Fig.1 The damage of sperm acrosome
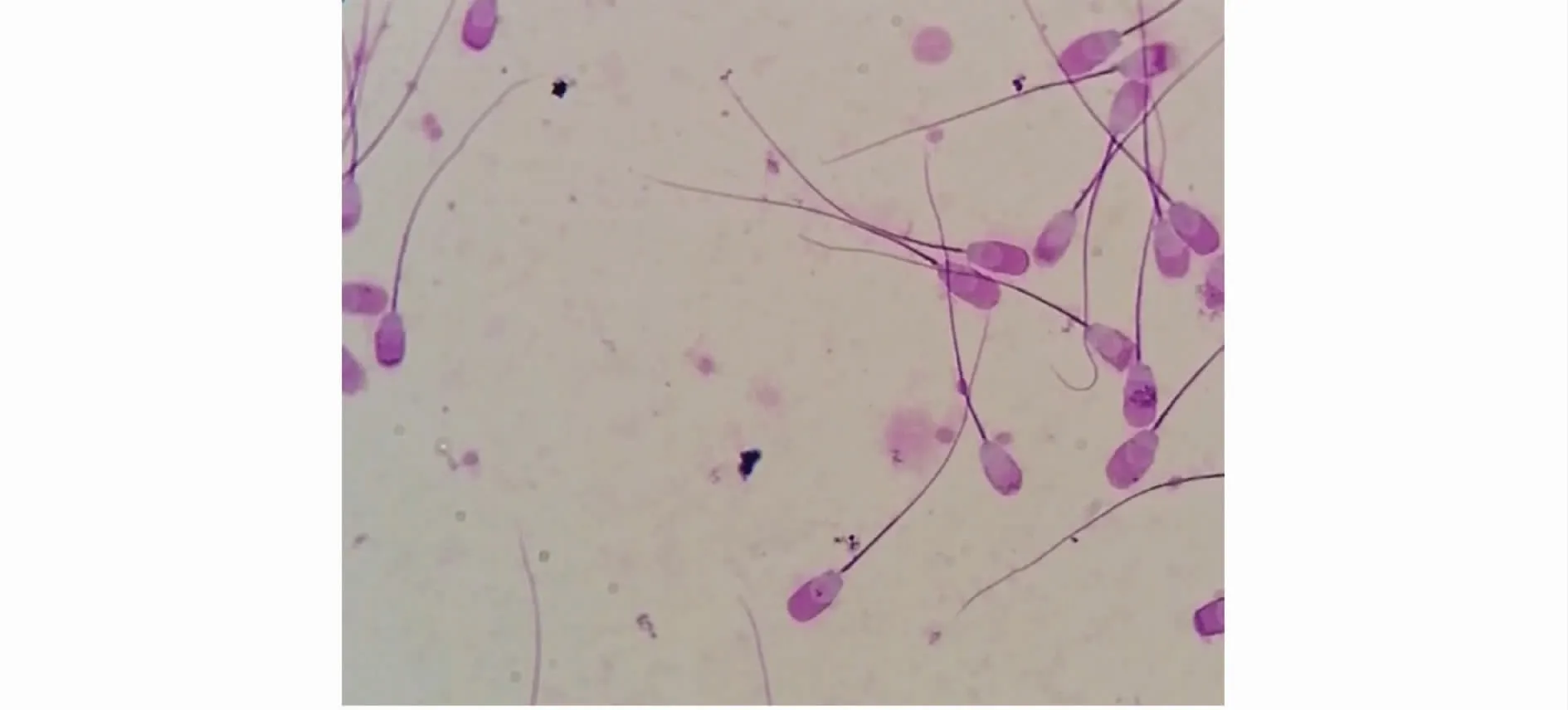
图2 精子顶体膨胀情况Fig.2 The damage of sperm acrosome
4 讨论
与冷冻过程一样,精子在解冻时也必须快速越过-5 ~-25℃危险温度区,以免低温对精子造成损伤。为减少物理损伤和溶解效应,解冻时要快速通过危险温区,尽量减少在危险温区的时间,只有采用合适的解冻温度和方法才能保证精子的复苏率。合适的解冻温度使冷冻精子能够快速越过危险温度区,从玻璃化状态转变为液态,减少对精子的伤害。因此,解冻温度和解冻方法是影响冻后精子复活和顶体再次损伤的重要因素。
顶体完整率是影响受胎率的重要因素,而且受胎率的高低与顶体完整率呈强正相关。由于精子头部顶体中至少存在着几种与受精有关的酶,因此精子顶体完整对于受精是至关重要的。在冷冻和解冻过程中均有可能造成精子顶体的损伤,解冻时温度由低温到高温也是造成顶体损伤的一个重要因素。精子顶体损伤可能主要是由解冻时的快速升温所致。
猪冷冻精液技术还不够成熟,有些技术还处于研究探索阶段,也包括解冻温度和方法。牛冷冻精液的精子活力在很大程度上取决于冷冻精液的解冻温度。关于牛冷冻精液的解冻技术方面已经有很成熟的经验,牛冷冻精液国家标准规定解冻温度是37℃。但猪精子有别于牛精子,其中有猪精液本身性质的问题,猪精子中含有较多的脂肪颗粒,容易受温度变化的影响,另外也有猪精液精清中一些重要物质缺失的原因,无论是冷冻过程还是解冻过程精子都容易受到伤害,需要通过试验研究找出适合的解冻方法,其中解冻温度和解冻时间都是关键环节。如果解冻速度过快,猪精液很可能解冻不完全,从而影响猪精子的活力。贾兰萍等认为,牛细管冻精的解冻时间过短不利于精子复苏,但解冻时间过长精液中释放的酶量过多、精子活力会迅速下降。因此,在猪冻精应用研究中需要找出合适的解冻温度和解冻时间以保证解冻后的精液品质。
解冻后不能只看精子活力,还要看生存时间,生存时间是影响受胎率的重要因素。对于牛冷冻精液高温(45℃)解冻,精子活力较高但生存时间较低;低温(36℃)解冻,精子活力较差但生存时间较长。本试验中,所有冻精样品生存时间均较短,这可能是猪精液冷冻过程中某环节处理不当造成的,如稀释液、平衡时间、冷冻程序等方面的原因;也可能是该批次冻精自身的原因,其他项目组反馈本批次冻精用于人工授精试验的受胎率很低。具体原因还需要在其他试验中继续观察、验证。
5 结论
与38℃慢速解冻冷冻精液相比,50℃快速解冻的猪细管冷冻精液的精子活力好而且顶体完整率高。

