湿法消解-原子荧光光谱法测定全血中硒
张晓梅 潘兴富
(北京市化工职业病防治院,北京 100093)
硒是人体必需的微量元素,缺硒可引发大骨节病与克山病等[1-2],硒过量又会引发毒害作用,所以准确测定人体内硒含量意义重大。血是人体硒水平的生物标记物之一,可反应人体几天内的硒水平,是国际上比较认可的硒监测指标[3-4]。血液样品中的硒检测主要有原子吸收光谱法[5]、电感耦合等离子体质谱(ICP-MS)法[6]、原子荧光光谱法[7]等,其中ICP-MS因灵敏度高、特异性强,但存在多原子干扰和质谱干扰等问题[8];原子吸收光谱法需根据样品进行基体改进,操作繁琐,周期长。目前,原子荧光光谱法因灵敏度高、检测限低被广泛应用于土壤、食品、金属材料等领域[9-11],将原子荧光光谱应用于血中硒的检测研究主要集中在血清样本,样品前处理多用微波消解,而对于全血中硒的原子荧光光谱法检测研究较少。样品常用的消解法有干法、湿法和微波消解,其中干法消解温度高,耗时长,微波消解耗时长,且消解后仍需赶酸,操作复杂,湿法消解操作简单,耗时短,被广泛应用。由于生物样本的珍贵性,检测时降低样本体积的必要性不言而喻,国外在十年前便提出了低体积概念,使小样品分析成为许多环境和医学相关研究目标的可能[12-13],而我国在低体积样品方面的研究未见报道。本文参考卫生行业标准(WS/T 109—1999)《血清中硒的氢化物发生-原子吸收光谱法》[14],低体积取样后采用湿法消解,以消解效率为评价指标,优化样品的消解条件,调试仪器参数,建立全血中硒含量测定的原子荧光光谱分析方法,以期为监测人群健康提供技术支持,同时为原子荧光光谱法检测全血中硒的标准制定提供参考。
1 实验部分
1.1 仪器及试剂
AFS-9770原子荧光光度计(北京海光仪器有限公司),配AS-50自动进样器;智能型电热板(林茂科技有限公司);实验中所用玻璃器具均以硝酸(50%)浸泡过夜,以去离子水清洗烘干后使用。
水中硒标准溶液(1 000 mg/L,坛墨质检科技股份有限公司),全血质控样品(SeronormTMTrace Elements Whole Blood L-2 RUO),硝酸(电子级70%,上海阿拉丁生化科技股份有限公司),高氯酸(AR 70.0%~72.0%,上海阿拉丁生化科技股份有限公司),盐酸(GR,国药集团化学试剂有限公司),硼氢化钠(AR,国药集团化学试剂有限公司),氢氧化钠(GR,北京化工厂有限责任公司)。
混酸(1+1):浓硝酸与高氯酸按体积比1∶1混合。
氢氧化钠(5 g/L):称取5.0 g氢氧化钠溶于水中,冷却后用水定容至1 000 mL。
硼氢化钠碱溶液(10 g/L):称取10.0 g硼氢化钠溶于氢氧化钠中,用氢氧化钠定容至1 000 mL。
盐酸溶液(5+95):吸取50 mL浓盐酸缓慢加入900 mL水中,冷却后用水定容至1 000 mL。
1.2 实验方法
根据样品中硒浓度与标准曲线线性范围,调节仪器灯电流、负高压等参数值,使其荧光强度响应值在合适范围。调节后的仪器参数为:载气300 mL/min,屏蔽气800 mL/min,负高压280 V,原子化器高度8 mm,Se总灯电流60 mA,辅助灯电流30 mA。
1.2.1 标准系列配制与测定
用盐酸溶液(5+95)将1 000 mg/L硒标准品逐级稀释成100 μg/L标准使用溶液后配制成0、1.0、2.0、4.0、6.0、8.0、10.0 μg/L的标准系列。以盐酸溶液(5+95)为载流,硼氢化钠碱溶液(10 g/L)为还原剂,连续用标准系列的零管进样,待读数稳定之后,将硒标准系列溶液按质量浓度由低到高的顺序分别导入仪器,测定其荧光强度,以质量浓度为横坐标,荧光强度为纵坐标建立标准曲线。
1.2.2 样品预处理与测定
取200 μL血样,加入1.8 mL超纯水后加1 mL混酸,于(150±10) ℃消解至淡黄色或无色透明并伴有白烟产生时,取下冷却,加入0.5 mL浓盐酸继续加热10 min,取下冷却后定容至10 mL。
空白样品:以200 μL超纯水代替样品,其他操作与样品处理方法相同。
与测定标准系列溶液相同的条件下,分别测定空白、样品溶液的荧光强度,与标准系列比较定量。计算方法如式(1)所示:
(1)
式中,ρ为样品中硒的质量浓度,μg/L;ρ1和ρ0分别为校准曲线计算出的试样和空白试样中硒的质量浓度,μg/L;V0为样品的定容体积,mL;V为样品的取样体积,mL。
1.2.3 消解效率评价方法
以市售质控样品为实验材料,采用控制变量法优化样品前处理条件,以质控样品标准值为参考,分别计算各个不同条件下样品的消解效率,具体计算方法如公式(2)所示,以消解效率评价优化前处理条件。
(2)
式中,E为样品的消解效率,%;ρ为测定样品中硒的质量浓度,μg/L;ρz为质控样品中硒的浓度值[本实验所用质控样品的硒质量浓度为(161±32) μg/L,消解效率计算中取161 μg/L作为ρz。
1.2.4 数据分析方法
数据以Excel统计,以Origin 8.6作图。
2 结果与讨论
2.1 标准曲线配制改进
比较标准曲线与工作曲线对样品测定影响,分取不同体积的硒标准溶液,按照实验方法进行消解,定容至10 mL后上机测定绘制工作曲线,标准曲线按照实验方法进行配制,结果如表1所示。两条曲线的相关系数均在0.995以上,对于同一质控样品的测定结果一致。以标准曲线测定浓度5 μg/L为工作曲线点,结果为(4.97±0.08) μg/L,进一步说明了标准曲线对于工作曲线的可取代性,建议直接以HCl(5%)将有证硒标准物质稀释后配制标准曲线,操作简单且检测效率高。

表1 不同曲线参数及样品测定结果
2.2 样品预处理方法的选择
2.2.1 消解温度的确定
取200 μL全血质控样品,加入1 mL混酸后,分别置于(120±10)、(150±10)和(180±10) ℃条件下进行消化。结果统计如表2所示。由表2可知,随温度上升,消解液颜色变浅,消解效率升高,但在(180±10) ℃消解30 min后,由于温度较高,消解速率快,消解液挥发至近干,此过程中部分硒因温度过高挥发损失,导致消解效率下降,这点与WS/T 109—1999中的说明相一致。所以实验采用(150±10) ℃作为后续样品消解温度。在样品前处理过程中需注意观察消解状态,防止消解温度过高导致使消解效率下降。

表2 不同温度下的消解情况
2.2.2 混酸添加量的确定
取5组血液样品,分别加0.5、1.0、1.5、2.0、2.5 mL混酸,其余操作按照实验方法进行,其消解效率变化如图1所示。混酸添加量0.5 mL时消解液最终呈黄色,消解不完全,消解效率仅为32.28%,混酸添加量1~2 mL时,均在80%以上,而混酸添加量为2.5 mL时,消解率有明显下降。混酸添加量大于1.5 mL时,消解30 min后消解液面未出现白烟,故延长了消解时间。可能由于消解时间过长导致样品中硒大部分转变为六价硒,后续与盐酸反应不充分导致消解效率的下降。混酸添加量为1 mL时,平均消解率达到最大值89.61%。在确定样品预处理方法时,尽量减少试剂用量以减少污染,所以本实验采取混酸添加量为1 mL。
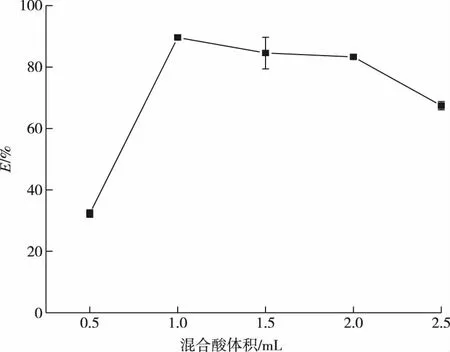
图1 混合酸添加量对消解效率的影响Figure 1 The effect of the amount of mixed acid added on the digestion efficiency.
2.2.3 消解时间的确定
样品在(150±10) ℃分别消解15、20、25、30、35 min后取下,其余操作按实验方法进行。消解率变化如图2所示。消解15 min时溶液呈黄色,基本澄清,但消解效率仅为67.32%,随时间延长,消解效率先上升后趋于平缓,在30 min时达到最大值97.26%,继续延长时间致使消解液近干,硒含量损失,消解效率下降,所以选取30 min作为消解时间。同时因电热板控温情况不同应及时观察消解液状态,防止消解时间过长导致消解效率下降。
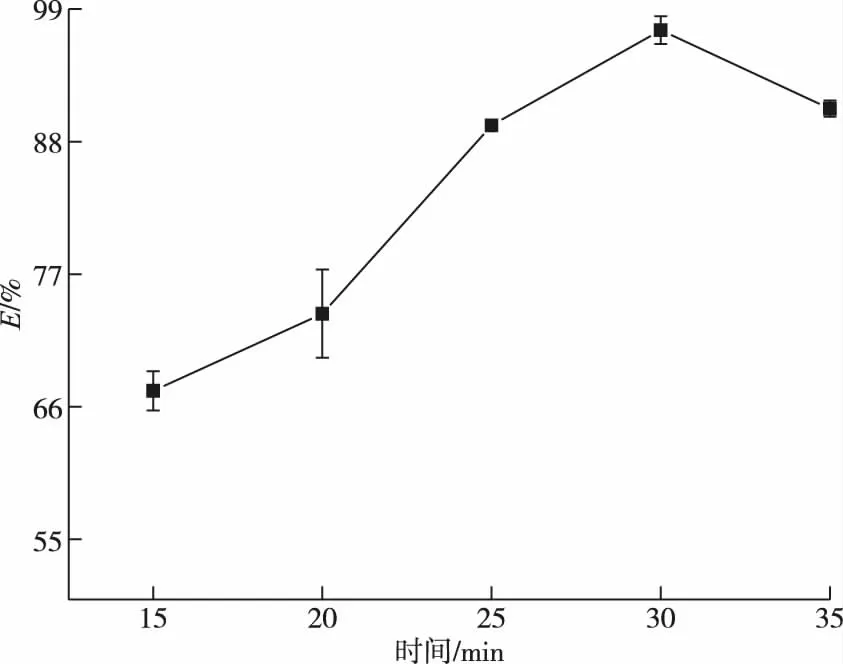
图2 消解时间对消解效率的影响Figure 2 The effect of digestion time on digestion efficiency.
2.3 线性范围与检出限
配制0、1、2、4、6、8、10 μg/L共计7个浓度点,进行血中硒含量标准曲线的测定,其线性范围为0~10 μg/L,相关系数为0.999 2,根据GBZ/T 210.5—2008《职业卫生标准制定指南第5部分生物材料中化学物质测定方法》中标准差法进行最低检出浓度实验。按上述优化后的方法连续测定10次空白溶液,由测定值计算浓度平均值和标准差,以3倍标准差计算最低检出浓度为0.143 μg/L。
2.4 方法准确度与精密度实验
配制50、150、250 μg/L剂量水平的加标样品,按照实验方法进行处理,同批测定样品浓度后计算精密度和加标回收率。结果显示,样品的平均加标回收率为90.9%~105%,精密度为1.5%~1.6%,方法的精密度和准确度均满足生物材料中化学物质测定方法要求,见表3。

表3 准确度与精密度测试结果
2.5 质控样品测定
以Sero全血质控为样品,经上述方法检测,结果为(147.367±7.415) μg/L,符合质控标准证书要求的(161±32) μg/L。根据质控标准证书中其他金属元素含量,推测样品中较高含量金属元素Pb (337±68) μg/L、Zn (7.1±1.4) mg/L、Cu (1.34±0.27) mg/L,对血中硒含量检测基本无影响。
3 结论
建立了全血中硒含量测定的湿法消解-原子荧光光谱分析方法,测定全血中硒线性情况良好,相对标准偏差和平均加标回收率均符合职业卫生标准生物材料中化学物质测定方法的相关要求,具有灵敏度高,精密度和稳定性好等特点。方法前处理操作简单,样品用量和消解用酸量均较少,微波消解法取样量一般为1 mL,而本实验取样量仅为200 μL,在很大程度上节省了实验样品和资源,也为环境和医学相关研究中的小样品分析提供了可能性。

